基于网络药理学研究塞来昔布治疗腺性膀胱炎的分子机制
朴松哲 陈静 洪涛 陈超前 周高波 柯莽
腺性膀胱炎(cystitis glandularis,CG)是一种以膀胱黏膜和下尿路上皮的腺上皮化生为特征的良性膀胱炎症性病变,发病率为0.9%~1.9%[1],临床表现主要有膀胱刺激征、血尿、会阴部不适、性交痛等,较难治愈,易复发。因此,继续探索治疗CG的更有效方法十分必要。研究发现,慢性膀胱炎症刺激是腺性膀胱炎的病因之一[2-3]。近年来有学者发现CG患者行膀胱电切术后给予选择性环氧化酶-2(cyclooxygenase-2,COX-2)抑制剂塞来昔布治疗后病情得到有效控制,且免疫组化染色结果提示COX-2蛋白在CG组织中表达呈阳性[4-5]。该研究结果为探寻治愈CG的有效方法提供了新的方向。但是,目前关于塞来昔布治疗CG的分子机制尚不清楚。因此,本研究基于网络药理学方法对塞来昔布治疗CG的作用靶点及可能的分子机制作一探讨,现将结果报道如下。
1 对象和方法
1.1 塞来昔布作用靶点分析 利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取塞来昔布(美国辉瑞公司,C17H14F3N3O2S)3D结构和简化分子现行输入规范表达式(simplified molecular input line entry specification,SMILES)(CC1=CC=C(C=C1(C2=CC(=NN2C3=CC=C(C=C3)S(=O)(=O)N)C(F)(F)F),导入Swiss Target Prediction(http://www.swisstarget prediction.ch)数据库,获取药物靶点。将药物靶点导入UniProt(http://www.uniprot.org)数据库,物种限定为人,将所有基因名校对为官方名称(official symbol)。
1.2 CG相关基因分析 分别利用GeneCards(http://www.genecard.org)数据库[6]和 CTD(http://ctdbase.org)数据库[7]查询与CG相关联的基因集合。
1.3 塞来昔布治疗CG靶点预测 将塞来昔布作用靶点基因集合与CG相关联的基因集合取交集,并绘制Venn图取交集,筛选塞来昔布治疗CG可能的潜在靶点。
1.4 蛋白相互作用(protein-protein interaction,PPI)网络构建 将上述基因集输入GENEMANIA(http://genemania.org/)数据库[8]构建 PPI网络。
1.5 富集分析 通过DAVID(https://david.ncifcrf.gov/)数据库[9],设定物种为人,阈值为P<0.05、伪发现率≤0.05,对上述基因集功能进行基因本体论(gene ontology,GO)功能富集分析和京都基因和基因组百科全书(Kyoto encycopedia of genes and genomes,KEGG) 信号通路富集分析。运用R 3.6.0软件ggplot2程序包绘制气泡图。
1.6 分子对接 利用PDB数据库(http://www.rcsb.org/pdb/)获取相应靶点的人源蛋白三维结构;利用ZINC数据库获取配体塞来昔布分子结构;参考Bikadi等[10]的分子对接方法评估塞来昔布与CG潜在靶点的结合能,结合能<0 kJ/mol表示配体与受体能够自发结合,且该值越小表示结合能力越高。
2 结果
2.1 塞来昔布治疗CG靶点分析结果 利用GeneCards、CTD数据库查询到与CG有关的靶点分别为253、21 964个,共筛选出塞来昔布治疗CG潜在靶点共8个,即 PTGS1、PTGS2、MAPK14、CCND1、HRH1、PARP1、CDK1和 RAF1,见图1(插页)。
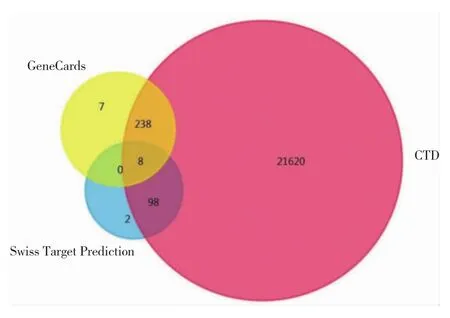
图1 塞来昔布靶基因与腺性膀胱炎(CG)相关基因的Venn图
2.2 PPI网络 利用GENEMANIA数据库导入上述8个基因构建PPI网络,发现塞来昔布治疗CG潜在治疗靶点以及与其直接或减价作用的靶点共28个,靶点之间相互联系达5种,见图2(插页)。
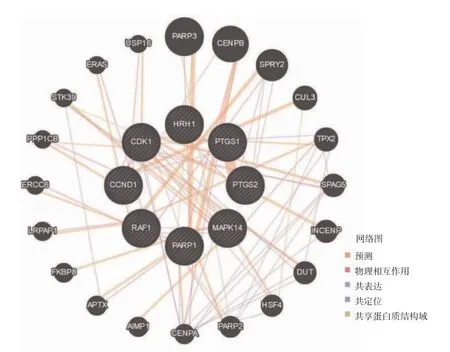
图2 GENEMANIA数据库构建塞来昔布治疗腺性膀胱炎(CG)作用基因集合的蛋白相互作用(PPI)网络
2.3 GO富集分析和KEGG信号通路富集分析 GO富集分析发现,塞来昔布治疗CG的靶点分别富集在后随链伸长、DNA修复、细胞分裂等生物学过程,细胞核、核浆、细胞质等细胞组分,DNA连接酶活性、蛋白激酶结合、NAD+ADP核糖转移酶活性等分子功能中;KEGG信号通路富集分析发现,该基因集主要富集在碱基切除修复、催产素信号通路、血管内皮生长因子信号通路等信号通路上,见图3(插页)。
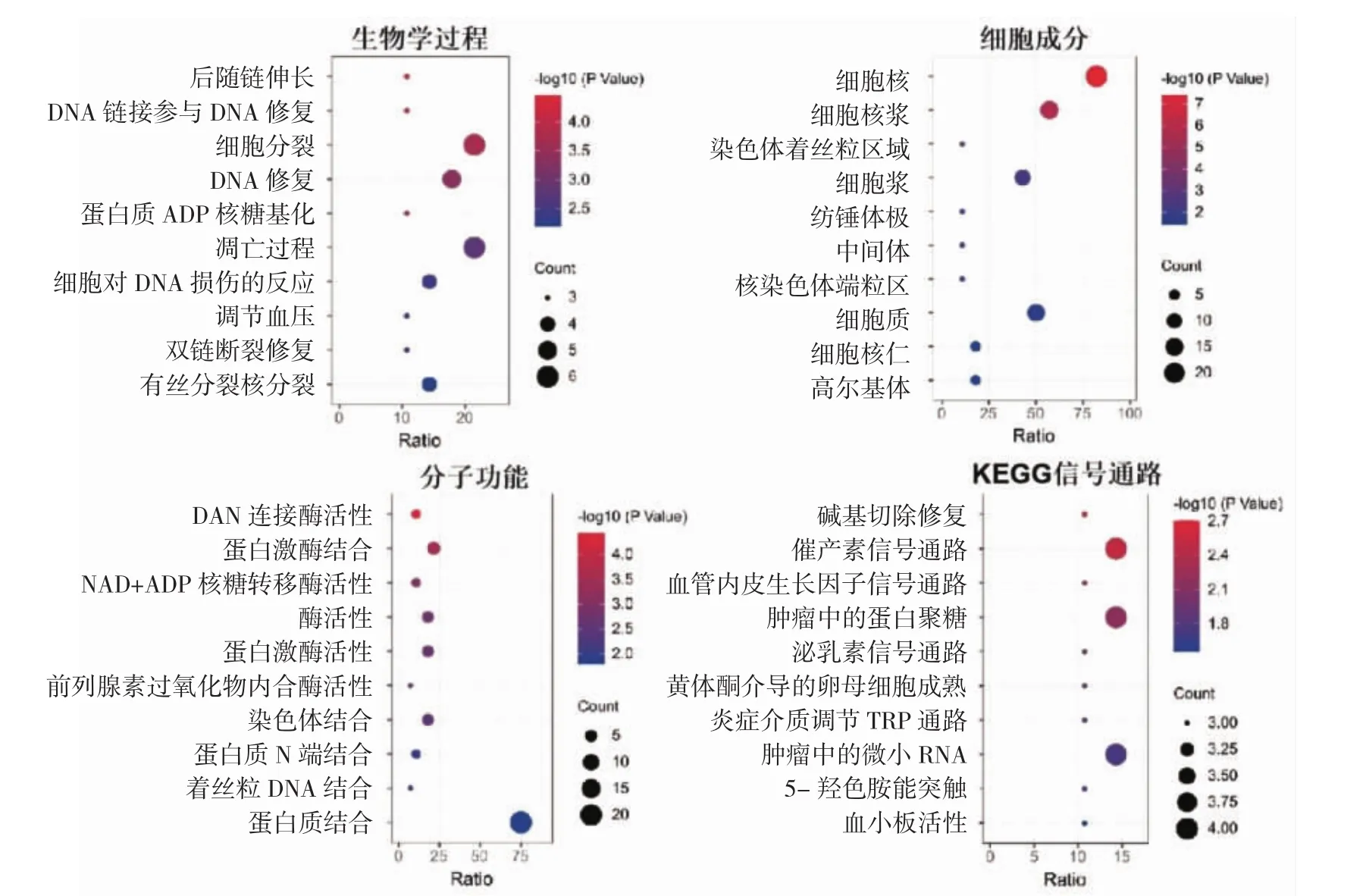
图3 塞来昔布治疗腺性膀胱炎(CG)靶基因集合的基因本体论(GO)富集分析及京都基因和基因组百科全书(KEGG)富集分析
2.4 分子对接结果 分子对接结果显示,塞来昔布与潜在靶点均有较好的结合能力。除PTGS2(COX-2)外,塞来昔布与CDK1的结合能力最高,与PTGS1的结合能力最低,见图4(插页)和表1。
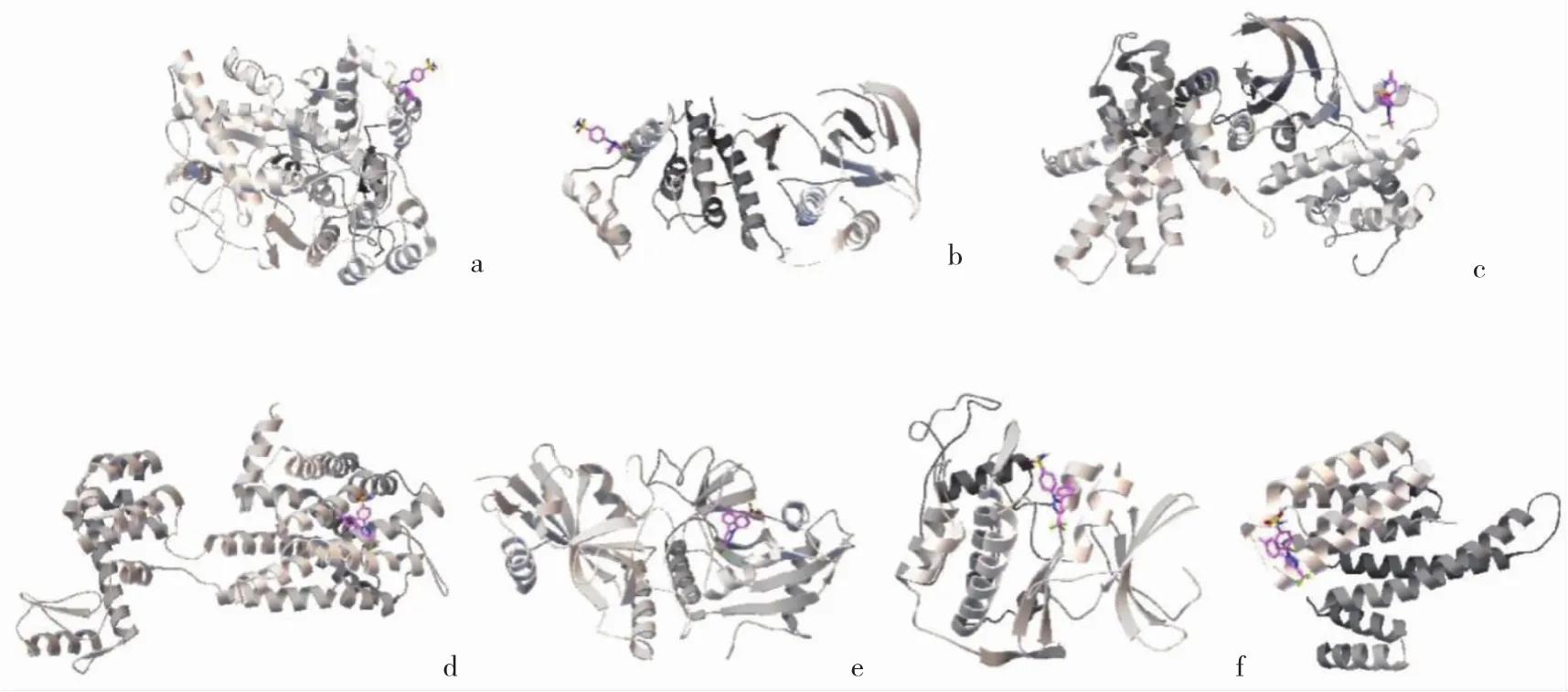
图4 塞来昔布与靶点分子对接(a:PTGS1;b:MAPK14;c:CCND1;d:HRH1;e:PARP1;f:CDK1;g:RAF1)

表1 塞来昔布与腺性膀胱炎(CG)潜在靶点的结合能(kJ/mol)
3 讨论
目前CG治疗尚无统一的方案。一种观点主张保守治疗,另一种观点则认为CG为癌前病变,主张予以电灼/电切术+化疗药物膀胱灌注[11]。近年来研究发现,COX-2在CG组织中高表达[12-14]。最近研究发现,CG患者行膀胱电切术后口服COX-2抑制剂塞来昔布后病情得到有效控制,且免疫组化染色发现COX-2蛋白在CG组织中表达呈阳性[4-5]。根据上述研究结果推测,COX-2异常表达可能与CG发生、发展有关,COX-2抑制剂有望成为治疗CG的新策略。
本课题组通过网络药理学和生物信息学分析发现,PTGS1、PTGS2、MAPK14、CCND1、HRH1、PARP1、CDK1和RAF1等8个基因是塞来昔布治疗CG的潜在作用靶点。PTGS1、PTGS2是催化花生四烯酸转化为前列腺素类、血栓烷类的关键酶,PG产物在炎症、疼痛和血小板聚集等方面起着重要作用。有研究发现CG组织中COX-2表达较正常膀胱组织增高,其中复发患者的 COX-2 表达显著增高[15]。MAPK14(p38α)是 4 个p38 MAPKs之一,p38 MAPKs在在由促炎细胞因子或物理刺激等细胞外刺激所引发的细胞级联反应中起重要作用,p38α和TNF-α表达上调与尿路上皮细胞凋亡有关[16]。CCND1基因编码细胞周期蛋白Cyclin D1,可抑制细胞从G1期向S期转换。人膀胱平滑肌细胞内CCND1可在LPS刺激下经NF-κB信号表达上调,进而促进细胞增殖和细胞外基质沉积,与慢性膀胱炎引起膀胱组织重建有关[17]。CG组织中CNND1表达较正常膀胱组织增高[17]。HRH1作为组胺最主要的受体压型,广泛分布于中枢和外周神经末梢,参与炎症反应、疼痛反应、血管调节和肥胖等生理过程的调节[18]。此外,组胺通过HRH1直接增强COX-2的表达和功能,从而上调PGI2、PGE2水平[19]。PARP1是PARP家族中最主要成员,在氧化应激诱导DNA损伤时被激活,消耗大量NAD,继而消耗ATP,导致细胞坏死;这说明抑制PARP1可通过减少细胞DNA损伤,从而对组织发挥保护作用[20]。研究发现,PARP-1在体内外均能与COX-2启动子区抑制元件-655/-632结合,与COX-2呈负相关,在调控COX-2表达中发挥重要作用[21]。CDK1主要与Cyclin A和Cycling B结合,进而调控细胞周期[22]。RAF1是Raf激酶家族成员之一,RAS/RAF/MAPK信号通路是多种刺激诱导COX-2转录的必要信号通路,与细胞生存有关[23]。该结果提示塞来昔布可能通过多靶点治疗CG。GO富集分析发现,塞来昔布治疗CG的预测靶基因集合分别富集在前列腺素内过氧合酶活性、丝氨酸/苏氨酸蛋白激酶活性、蛋白激酶结合等分子功能上和蛋白质定位、细胞对化学刺激的反应、磷酸盐代谢等生物学过程中。KEGG富集分析发现,该基因集合主要富集在细胞衰老、VEGF信号通路、内分泌抵抗等信号通路中。分子对接结果验证塞来昔布与其治疗CG的潜在靶点均有较好的结合。
综上所述,本研究通过网络药理学分析结合文献复习筛选出塞来昔布治疗CG潜在靶点共8个,这为进一步探索塞来昔布治疗CG的作用机制提供了理论依据。

