男性不育患者Y染色体微缺失、染色体核型及性激素水平分析
张恒 刘颖 徐旻 吴海啸 杨庆 胡洋
不孕不育是严重危害人类生殖健康的世界性问题。目前全球约有10%~15%的育龄夫妻受其困扰,而其中一半是由于男性因素引起的[1]。男性不育主要是外界环境因素和遗传因素相互作用,进而影响精子发生过程导致的,临床表现为男性生精障碍,如少精症、无精症等。遗传因素是男性不育的主要原因之一,约占30%[2]。Y染色体微缺失和染色体核型异常是目前已知的两个重要遗传学病因[3]。内分泌因素也是男性不育的主要原因之一,在精子发生和雄激素合成过程中,下丘脑-垂体-睾丸内分泌轴发挥重要的调节作用。因此,本文对362例男性不育患者Y染色体微缺失、染色体核型及性激素水平进行检测与分析,探讨其对男性患者不育诊断与治疗的价值。
1 对象和方法
1.1 对象 选取2017年1月至2021年1月因不育至金华市中心医院就诊的男性患者362例,排除梗阻性无精症患者。依据WHO第5版《人类精液检测与处理实验手册》相关标准评估精子质量:无精症112例,严重少精症151例,精液质量正常99例。本研究经医院医学伦理委员会审查通过,所有患者签署知情同意书。
1.2 方法 采集患者外周血标本3份,分别行Y染色体微缺失检测、细胞遗传学分析和性激素水平检测。
1.2.1 Y染色体微缺失检测 采用qRT-PCR法。使用DNA提取试剂盒提取200 μl抗凝血的基因组DNA,用NanoDrop 2000微型紫外分光光度仪(美国Thermo Scientific)测定所提取DNA的浓度。使用7500 qRT-PCR仪(美国ABI),根据欧洲男科协会/欧洲分子遗传质量协作网发表的序列位置标签对Y染色体无精子因子(azoospermia factor,AZF)a、AZFb、AZFc等3个区域缺失状态进行检测。反应体系:PCR混合物 22.75 μl,酶 0.25 μl,DNA 模板 2 μl(样品 DNA 浓度控制在10~100 g/L)。反应条件:95℃ 3 min;95℃15 s,63 ℃ 20 s,72 ℃ 20 s,共 10 个循环;95 ℃ 15 s,63℃ 32 s,72℃ 20 s,共30个循环。发展至第三阶段时,确定温度达到63℃后采集荧光信号。
1.2.2 染色体核型异常检测 采用细胞遗传学分析。取患者静脉血2 ml,加入浓度为500 U/ml的肝素抗凝,将经旋混转匀后用7号针头垂直滴25滴于盛有5 ml RPMI1640的培养瓶中,37℃封闭培养72 h,在终止培养前3~4 h加入秋水仙碱(20 mg/L)。将培养的细胞悬液离心,对分离的细胞进行低渗、固定、胰蛋白酶消化及吉姆萨染色处理,G显带。每例患者计数30个分裂相,寻找5个染色分散良好、带纹清晰的分裂相作核型分析,核型异常者加倍计数与分析。结合人类细胞遗传学国际命名体制确定异常核型的名称,并深入剖析异常核型。
1.2.3 性激素水平检测 采用贝克曼DXI 800全自动免疫分析系统及配套的血清试剂盒检测促卵泡激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)和催乳素(prolactin,PRL)水平。男性性激素水平正常范围:FSH 为 1.27~19.26 U/L,LH 为 1.24~8.62 U/L,T 为6.07~27.10 nmol/L,PRL为 55.97~278.36 mU/L。
1.3 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者Y染色体微缺失情况 362例患者中,Y染色体微缺失有28例(7.7%),包括AZFb位点缺失2例(0.6%)、AZFc位点缺失 21例(5.8%)、AZFbc位点缺失3例(0.8%)、AZFabc位点缺失2例(0.6%)。无精症组、严重少精症组、精子正常组Y染色体微缺失率分别为 11.6%(13/112)、9.9%(15/151)、0.0%(0/99),差异有统计学意义(P<0.05);3组患者Y染色体各位点缺失情况见表1。
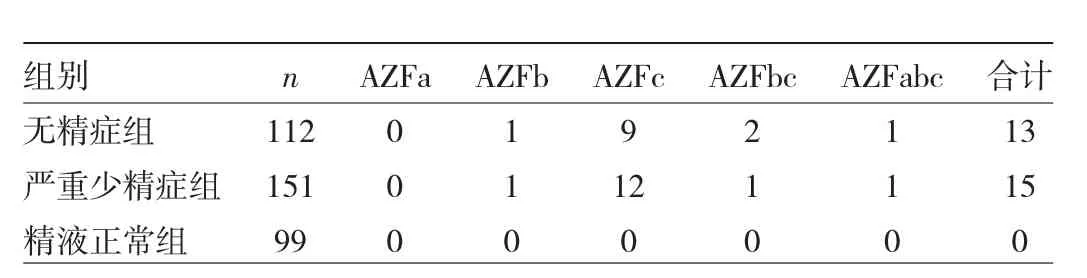
表1 3组患者Y染色体各位点缺失情况(例)
2.2 3组患者染色体核型异常情况 无精症组发现染色体核型异常18例,异常率为16.1%(18/112),包括染色体数目异常11例、染色体结构异常4例、性反转3例;严重少精症组发现染色体核型异常4例,异常率为2.6%(4/151),包括染色体数目异常2例、染色体结构异常2例;精液正常组未发现存在染色体核型异常,见表2。

表2 3组患者染色体核型异常情况(例)
2.3 3组患者性激素水平比较 3组患者FSH和LH水平比较,差异均有统计学意义(均P<0.05),其中无精症组、严重少精症组FSH、LH水平均明显高于精液正常组(均P<0.05);3组患者T和PRL水平比较,差异均无统计学意义(均P>0.05),见表3。

表3 3组患者性激素水平比较
3 讨论
在男性不育患者中,无精症、严重少精症占了较大的比例,临床上常见的原因有染色体异常、内分泌因素、外部环境因素、生殖道梗阻、睾丸病变、精索静脉曲张等。精子的发生是一个相当复杂的过程,减数分裂、有丝分裂均受到不同染色体的影响,当染色体不正常、基因缺失时,易导致精子异常,严重降低精子质量,最终影响生育功能。Y染色体微缺失、染色体核型检测能反映出部分遗传方面的原因,为男性不育患者的临床诊断和治疗提供新的路径[4]。
在无精症患者中,Y染色体的长臂常常缺失,这一现象最初由Tiepolo等[5]在1976年首次发现,经进一步研究后,该学者把位于Y染色体长臂1区1带(Yq1.1)并参与调控精子生成的区段命名为AZF。随后,Voget等[6]确定AZF的位置在Y染色体q臂第5、6区,基于此分成3个独立区域,包括AZFa、AZFb、AZFc。而AZF区域片段的变化、缺少,被称为Y染色体微缺失;这会影响精子形成,导致无精、少精等情况的发生,最终导致不育。Y染色体微缺失作为男性不育的第二大遗传因素,其发生率仅次于Klinefelter综合征。研究表明,无精症或严重少精症患者发生Y染色体微缺失的概率为2%~11%,某些地区表现出更高的发生率[7]。AZF区段的微缺失是不育的一个主要遗传原因,因此对男性不育患者开展Y染色体微缺失检测具有临床意义。某研究对相关临床数据进行分析后得出,Y染色体微缺失仅在 AZFa、AZFb、AZFbc、AZFc、AZFabc 等区域有相应表现[8]。此外,一些新的缺失位点也逐渐被发现,如在AZFb与AZFc区域之间发现了新的缺失位点,即AZFd区域;但目前新发现区段的缺失在临床上并无明确的临床意义,它们常常伴随其他区段缺失,而非独立存在。到目前为止,在AZF区域中与精子的发生密切相关的候选基因尚未有报道,所以AZF区域缺失的临床意义仍有较多的争议[9]。
本研究选择2013年版欧洲男科协会/欧洲分子遗传质量协作网关于Y染色体微缺失检测指南推荐的6个位点,对362例患者的进行AZF区域检测,结果发现Y染色体微缺失率为7.7%,其中AZFb、AZFc、AZFbc、AZFabc位点缺失率分别为0.6%、5.8%、0.8%、0.6%。可见,AZFc位点缺失在不育患者中的发生率最高,具有各种临床表型和组织学类型[10]。AZFc参与调控精原细胞向成熟精子的发生过程,这个区段的缺失通常会造成精子生成不足。有报道指出,在AZFc位点缺失的少精症患者中,精子数目呈进行性减少,临床上最终进展为无精症。若患者少精且AZFc位点缺失,则需要提前冷冻保存精液。在AZFc位点缺失的无精症患者中,约半数可以借助睾丸切开取精术(testicular sperm extraction,TESE)得到精子,并进行单精子卵胞浆显微注射辅助生育,然而由于Y染色体伴性遗传的存在,这些患者的男性后代会获得AZFc位点缺失,因此上述患者在行单精子卵胞浆显微注射辅助生殖时,建议进行优生学上的性别干预[11-12]。AZFb、AZFbc位点缺失患者的睾丸组织学特点主要有精子阻滞引发无精症或唯支持细胞综合征,采取睾丸组织切取术仍无法得到精子。当AZFb位点缺失时,会直接阻碍精原干细胞减数分裂期的发展,呈现生精阻滞,并伴随各种临床表现,精子多处于精母细胞阶段、精子细胞阶段。本研究结果显示,AZFa位点单独缺失情况并未出现。当AZFa位点缺失时,患者的睾丸体积明显缩小,不能产生精子,也不能通过显微取精获得精子,且出现唯支持细胞综合征、无精症的临床表现。
在男性不育的原因中,染色体核型异常是另一个不可忽视的遗传因素,目前最主要的染色体核型异常原因是Klinefelter综合征。Klinefelter综合征患者在有丝分裂阶段、减数分裂阶段,染色体联会紊乱,性染色体不分离,形成含有两个X的卵子,进而对男性性状基因产物表达产生一定的影响,最终表现出精子形成障碍、生殖器官发育不正常、激素水平不正常等。相关研究表明,Klinefelter综合征涉及的主要染色体核型为47,XXY和47,XYY,还有一部分是嵌合型(46,XY/47,XXY和46,XX/47,XXY)[13]。对于染色体核型异常患者,应通过细胞遗传学检测确定病因,积极寻求遗传学咨询并决定是否采取辅助生殖。
本研究还对男性不育患者的性激素水平作了检测,发现无精症组、严重少精症组FSH、LH水平均明显高于精液正常组,而3组患者T和PRL水平比较差异均无统计学意义。Pandey等[14]研究发现,Y染色体微缺失的无精症和严重少精症患者LH及FSH水平明显升高。下丘脑-垂体-睾丸性腺轴对男性睾丸生精能力具有调节、控制的作用,在促性腺激素释放激素的作用下,脑垂体会生成LH、FSH。通过FSH的影响,促使精母细胞形成成熟的精子细胞;通过LH的影响,促进睾丸间质细胞的增生,提高间质细胞水平,进而形成精子。若生精上皮细胞未出现异常,来源于支持细胞的抑制素会发挥着抑制作用,降低FSH水平;若支持细胞-生精小管复合体出现异常,则抑制素的分泌水平会降低,负反馈减弱,导致FSH水平升高。LH、T分泌在下丘脑-垂体-睾丸性腺分泌轴内分泌调控中是负反馈关系,当睾丸间质细胞受损时,来源于间质细胞分泌的T水平会降低,LH水平升高[15]。可见,检测男性不育患者性激素水平变化,有助于判断睾丸病理改变和功能状态。对于一些非梗阻性无精症患者,建议在TESE前进行性激素水平检测,若FSH高于正常值的2倍及以上则不建议行TESE。
综上所述,无精症和严重少精症与Y染色体、染色体核型异常和性激素水平等具有密切联系,但其相关机制十分复杂。随着辅助生殖技术的发展,对于一些无精症和严重少精症患者,可以借助TESE获得精子并行单精子卵胞浆显微注射辅助生殖。在开展辅助生殖治疗时,建议联合行Y染色体微缺失、染色体核型和性激素水平测定,为患者提供全方位的个性化遗传咨询。

