阿帕替尼治疗晚期卵巢癌疗效与安全性的Meta分析
徐 翔,叶明侠,赵恩锋,李立安,孟元光
卵巢癌是女性生殖系统常见的恶性肿瘤,发病率仅次于子宫内膜癌及宫颈癌,而死亡率却居首位[1]。患病初期的症状不明显,目前缺乏特异的筛查手段,70%以上的女性患者至晚期才会明确诊断[2-3]。目前对于卵巢癌的主要手段是手术联合化疗,部分患者可达到完全缓解,但约50%~75%的晚期患者存在复发的可能[4]。晚期复发的患者逐渐出现铂耐药,对化疗的反应降低,最终导致死亡。
近年来,国内外学者不断探索卵巢癌治疗的新药物及新方法,如腹腔热灌注、靶向药物及免疫治疗的开展为临床提供了更多的选择。其中靶向药物由于不良反应小,抗癌效果好,有望成为治疗复发性卵巢癌的新的策略[5]。阿帕替尼(艾坦)是我国自主研发的口服靶向药物,是作用于VEGFR-2上的小分子酪氨酸激酶抑制剂。作为靶向抗血管生成的药物,阿帕替尼可以抑制VEGR引发的内皮细胞的迁移,降低肿瘤血管的密度,抑制肿瘤的生长和转移,已获得国家食品药品监督管理总局(CFDA)批准,被证实治疗晚期胃癌有效且安全[6-7]。然而,阿帕替尼对于晚期卵巢癌的治疗较少,其疗效和安全性缺乏系统评估。本文旨在通过Meta分析评估阿帕替尼治疗晚期卵巢癌的疗效,以期为临床治疗提供科学依据及循证医学证据。
1 资料和方法
1.1 检索策略 检索Cochrane Library、PubMed、Embase、中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普期刊数据库与万方数据库。英文检索词:advanced ovarian cancer、ovarian neoplasms、advanced、Apatinib等。中文检索词:晚期卵巢癌、晚期卵巢肿瘤、甲磺酸阿帕替尼、阿帕替尼、艾坦。
1.2 文献纳入和排除标准
1.2.1 纳入标准 研究类型:自建库以来至2021年5月公开发表的关于阿帕替尼联合或不联合化疗治疗晚期卵巢癌的随机对照研究(RCT),语种为中文或英文。研究对象:>18岁的晚期卵巢癌患者。干预措施:试验组接受阿帕替尼联合或未联合化疗,对照组仅接受安慰剂或常规化疗。研究指标:无进展生存期(PFS)、总生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)、不良反应发生情况。
1.2.2 排除标准 非中文或英文文献。数据不全、未完成或重复发表的文献。综述类、会议及个案报道。阿帕替尼不同剂量自身对照或无对照的研究。
1.3 文献筛选及数据提取 两名研究者按上述检索策略独立检索相关文献,按纳入排除标准对文献进行筛查。将符合标准的文献全文下载并详细阅读,提取研究的基本信息,研究对象情况、干预措施方案及结局指标等。
1.4 文献风险偏倚评估 根据Cochrane协作网RCT偏倚风险评估工具对符合纳入标准的文献进行偏倚风险分析,利用Rev Man5.3软件绘制偏倚风险图。如出现分歧则研究者再讨论协商达成一致。
1.5 统计学处理 利用Rev Man5.3软件对文献中的数据进行统计分析。采用Q检验分析纳入的研究之间是否存在异质性。若I2≤50%,使用固定效应模型,若I2>50%,排除异质性因素后采用随机效应模型,对于异质性明显者可进行亚组分析。
2 结果
2.1 文献检索结果 共检索出427篇文献,删除重复文献155篇、题目及摘要不符的文献220篇,经阅读全文后共保留52篇文献,排除非晚期卵巢癌、非RCT及无法获取数据文献38篇,最终纳入11篇中文文献进行Meta分析。患者总例数681例,试验组333例(阿帕替尼联合化疗),对照组348例(常规化疗)。纳入文献基本特征见表1。

表1 纳入关于阿帕替尼治疗晚期卵巢癌文献的基本特征
2.2 Meta分析结果
2.2.1 无进展生存期(PFS) 仅纳入两篇文献进行无进展生存期分析[8,14]。根据 异质性 检验结 果(I2=100%),两项研究存在明显异质,采用随机效应模型进行分析。通过连续性变量分析得出,联合使用阿帕替尼可以延长晚期卵巢癌患者的平均PFS为3.62个月(95%CI为1.36~5.87,P<0.05,图1)。
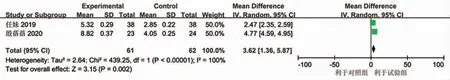
图1 阿帕替尼试验组与常规化疗对照组无进展生存期比较Meta分析
2.2.2 总生存期(OS) 仅两篇文献对晚期卵巢癌患者的总生存期分析[8,14]。根据异质性检验结果(I2=99%),两项研究存在明显异质,采用随机效应模型进行分析。通过连续性变量分析得出,联合使用阿帕替尼可以延长晚期卵巢癌患者的平均OS为5.21个月(95%CI为3.01~7.42,P<0.05)。
2.2.3 客观缓解率(ORR) 共纳入11篇文献[8-18],根据异质性检验结果(P=0.04,I2=47%),采用固定效应模型。结果显示联合阿帕替尼组(试验组)与常规化疗组(对照组)对晚期卵巢癌患者的ORR的具有显著差异(OR=3.40,95%CI为2.43~4.76,P<0.05)。
2.2.4 疾病控制率(DCR)11篇文献均报道了疾病控制率情况,根据异质性检验结果(P=0.28,I2=17%),采用固定效应模型。结果提示相对于常规化疗组(对照组),联合阿帕替尼组(试验组)具有更高的疾病控制率,差异有统计学意义(OR=3.21,95%CI为2.25~4.58,P<0.05)。
2.2.5 不良反应发生情况具体分析 共有8个研究分析了高血压的在两组间的不良反应,因I2=56%,考虑各研究间存在中度异质性,故采用随机效应模型。其余手足综合征等8项不良反应发生率的比较均采用固定效应模型(I2<50)。最终得出高血压、手足综合征、蛋白尿的发生率在两组间存在统计学差异(P<0.05),提示阿帕替尼组出现以上3项不良反应的概率高于常规化疗组。而胃肠道反应、白细胞减少等不良反应的发生率在两组间差异无统计学意义(P>0.05)。详见表2。
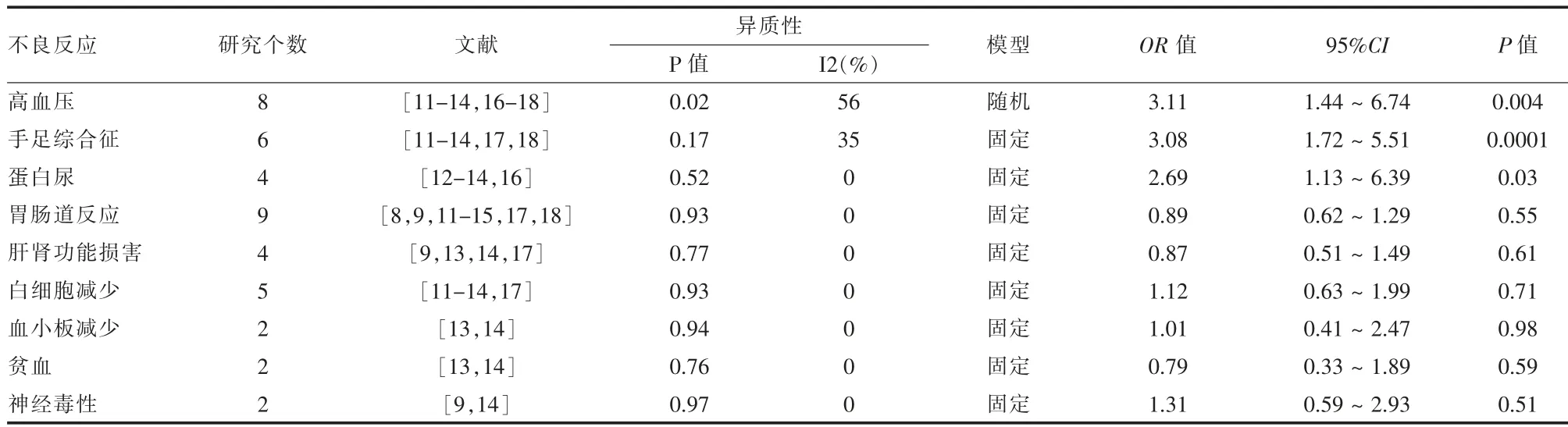
表2 阿帕替尼试验组与常规化疗对照组常见不良反应发生率的Meta分析
3 讨论
卵巢癌的早期诊断率低,不少患者出现腹胀厌食等消化道症状时已为晚期。晚期卵巢癌患者易出现肿瘤复发及化疗耐药,从而导致较差的生存质量和预后,晚期患者的死亡率高达59%,5年存活率仅为29%[19]。因此安全有效的新药对于晚期卵巢癌患者至关重要。有研究证实,阻断血管内皮生长因子受体(VEGFR)可有效抑制血管生成,从而抑制肿瘤的转移和生长[20]。而阿帕替尼可以选择性地抑制VEGFR-2,是一种新型的口服的靶向药物。已有多项研究报道,阿帕替尼在胃癌、肝癌、肺癌等多种实体瘤的治疗中取得了良好的疗效和安全性[7,21-22]。目前对于阿帕替尼对卵巢癌疗效及安全性研究仅局限于小样本临床试验,尚缺乏系统的评价和分析。
本研究涵盖了目前已发表的阿帕替尼治疗晚期卵巢癌的RCT。对纳入的11篇文献分析得出,阿帕替尼组的ORR与DCR均高于化疗组(P<0.05)。总结已有研究中的PFS及OS的情况,同样得出阿帕替尼组的PFS及OS均长于化疗组(P<0.05)。根据以上4个疗效指标的评估,推断阿帕替尼可以改善晚期卵巢癌的预后,为患者带来临床获益。另外,安全性方面,本研究主要针对临床用药中出现的主要不良反应进行分析。与多数靶向药物的不良反应类似,阿帕替尼组在胃肠道、血液系等其他不良反应的发生率与常规化疗组相当,但确实增加了高血压、手足综合征及蛋白尿的发生率,但通过对症治疗后基本可控。其发生原因可能与靶向药物的治疗机制相关,VEGFR抑制剂可以通过抑制内皮细胞的NO的合成而导致血压升高,同时蛋白尿及手足综合征的发生可能亦与肾脏及手足部血管VEGF的减少有关[23-25]。基于以上结果,在临床用药过程中应重点监测患者的血压、肾功能及指端感觉的变化,及时干预,使阿帕替尼更好的发挥治疗作用。
本研究还存在一些不足。第一,部分临床试验样本量小,缺乏多中心大样本的临床试验。第二,部分研究并未对随机化及盲法进行说明,可能存在选择偏倚。第三,纳入的研究都是在中国进行的,研究结果不一定适用于其他国家的患者。第四,各项研究的用药剂量及对照方法不全一致,可能导致异质性的增加。因此后续需要更多的大规模临床试验,以获得更科学有效的循证医学证据。

