冠心病与脑卒中患者外周血CYP2C19基因多态性分析
杨雯雯,陈稳,查艳芳,徐婷娟,沈国栋,胡世莲,程民
1.中国科学技术大学附属第一医院(安徽省立医院)西区肿瘤分子实验室,合肥 230031;2.安徽省老年医学研究所;3.肿瘤免疫与营养治疗安徽省重点实验室
氯吡格雷作为抗血小板治疗的基础药物,与阿司匹林联合应用是众多指南所推荐的用于预防和治疗急性冠脉综合征(ACS)、经皮冠状动脉介入术(PCI)后的患者发生缺血事件反复发作、以及急性心肌梗死的标准疗法[1]。然而氯吡格雷抗血小板作用在不同人群和个体之间存在巨大差异。临床上将氯吡格雷抑制血小板聚集作用降低,在接受标准抗血小板治疗后仍反复出现心血管事件的现象称为氯吡格雷抵抗。引起氯吡格雷抵抗的因素包括代谢基因的多态性、过低的氯吡格雷剂量、药物之间的相互作用、依从性差、血小板因素等,在众多因素中CYP2C19功能缺失基因的多态性是导致患者出现氯吡格雷抵抗的主要原因[2]。因此,在临床上对服用氯吡格雷的心血管病患者检测其CYP2C19基因型,根据分型结果合理选择药物,从而进行精确药物治疗,减少临床不良心血管事件的发生[3-4]。本研究分析4 270例冠心病与141例脑卒中患者的CYP2C19基因多态性分布特点,并探讨不同性别、不同年龄以及不同病种之间的基因型和代谢型是否具有统计学差异,以期为临床血小板聚集抑制剂的个体化应用提供依据。
1 对象与方法
1.1 研究对象 选取2016年3月至2019年10月于中国科学技术大学附属第一医院心血管内科和神经内科住院的4 411例检测CYP2C19基因的患者,诊断为冠心病或脑卒中,民族为汉族。其中冠心病4 270例,脑卒中141例;男性2 804例,女性1 607例;年龄范围22~96岁,中位年龄65岁。
1.2 基因检测
1.2.1 主要仪器和试剂 核酸提取纯化试剂盒、人CYP2C19基因分型检测试剂盒(荧光PCR法):苏州旷远生物分子技术有限公司;实时荧光定量PCR仪:德国罗氏诊断有限公司;台式高速离心机:德国艾本德。
1.2.2 核酸的提取、富集和纯化 取患者的外周血样本,EDTA抗凝。按照核酸提取纯化试剂盒说明书提取、纯化DNA,提取的DNA的1 h内进行下一步基因检测。
1.2.3 CYP2C19基因检测 (1)反应体系配置:按照人CYP2C19基因分型检测试剂盒配置CYP2C19*2型和CYP2C19*3型的样本、对照与质控品的反应体系。(2)设置PCR程序:37 ℃,2 min;95 ℃ 3min(95 ℃,30 s;56 ℃,30 s;65 ℃,45 s)10个循环;(95 ℃,30 s;56 ℃,30s※;65 ℃,45 s)30个循环,※处采集荧光信号;25 ℃ 1 min。(3)上机检测:将96孔板放入荧光PCR仪中,运行设定的PCR程序;(4)PCR程序运行结束后,分析扩增曲线,计算Ct值。根据2G、2A、3G、3A的结果判断为CYP2C19 c.681/636的GG/AA/纯合型或AG杂合型,最后判断为*1/*1、*1/*2、*1/*3、*2/*2、*2/*3、*3/*3中的何种基因型。
1.3 统计学处理 采用SPSS 22.0分析数据。采用Hardy-Weinberg遗传平衡检验样本的群体代表性,各组间比较采用χ2检验(脑卒中患者因样本量较少,其基因型的组间比较采用Fisher确切概率法)。P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg遗传平衡检验 经Hardy-Weinberg遗传平衡检验,4 411例患者CYP2C19*2、CYP2C19*3基因差异无统计学意义,提示该人群的基因分布具有群体代表性。见表1。
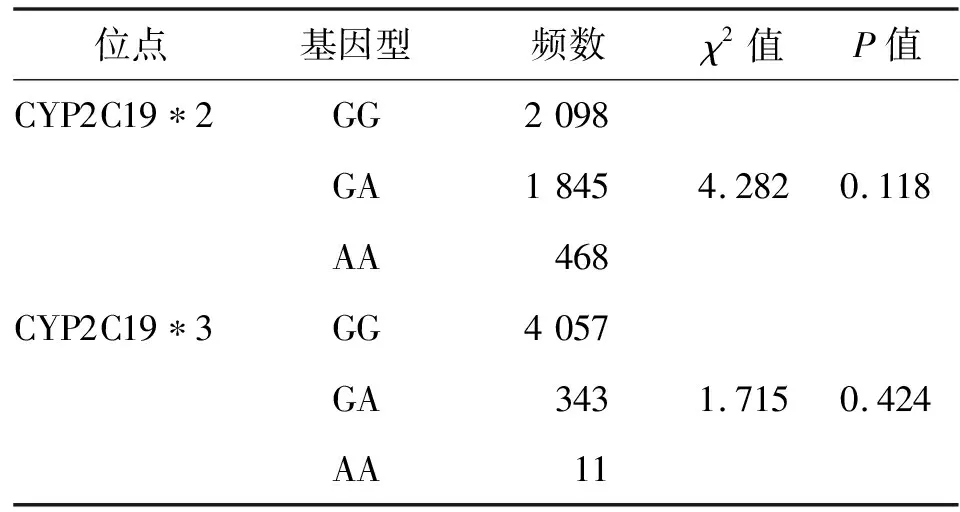
表1 CYP2C19 多态性位点Hardy-Weinberg平衡评估(n=4 411)
2.2 冠心病患者CYP2C19基因型和代谢型分布 冠心病患者共4 270例,其中男性2 720例,女性1 550例,中青年(<60岁)1 340例,老年(≥60岁)2 930例。男性人群基因型分布前三位分别为*1/*1(42.57%)、*1/*2(38.93%)、*2/*2(10.11%)型,女性人群基因型分布前三位分别为*1/*2(41.35%)、*1/*1(39.87%)、*2/*2(11.55%)型,代谢型均为中代谢型(44.82%,45.94%)最多;中青年与老年人群的基因型分布前三位均分别为*1/*1(41.87%,41.47%)、*1/*2(38.51%,40.41%)、*2/*2(11.19%,10.38%)型,代谢型均为中代谢型(44.40%,45.60%)最多。不同性别、不同年龄组之间的基因型和代谢型差异均无统计学(P>0.05)。见表2。
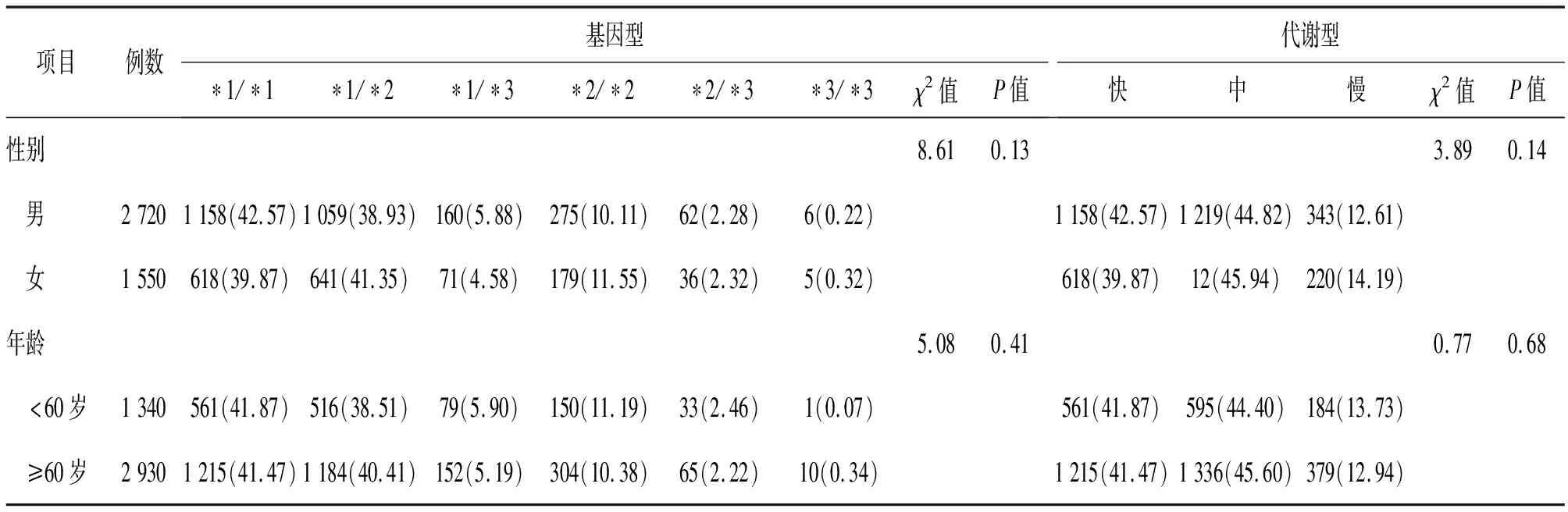
表2 冠心病患者性别、年龄和CYP2C19基因多态性分布[例(%)]
2.3 脑卒中患者CYP2C19基因型和代谢型分布 脑卒中患者共141例,其中男性84例,女性57例,中青年(<60岁)38例,老年(≥60岁)103例。男性人群基因型分布前三位分别为*1/*1(51.19%)、*1/*2(30.95%)、*1/*3(8.33%)型,女性人群基因型分布前三位分别为*1/*1(49.12%)、*1/*2(28.07%)、*2/*2(15.79%)型,代谢型均为快代谢型(51.19%,49.12%)最多;中青年与老年人群的基因型分布前三位均分别为*1/*1(63.16%,45.63%)、*1/*2(21.05%,33.01%)、*2/*2(7.89%,10.68%)型,代谢型均为快代谢型(63.16%,45.63%)最多。不同性别、不同年龄组之间的基因型和代谢型差异均无统计学意义(P>0.05)。见表3。
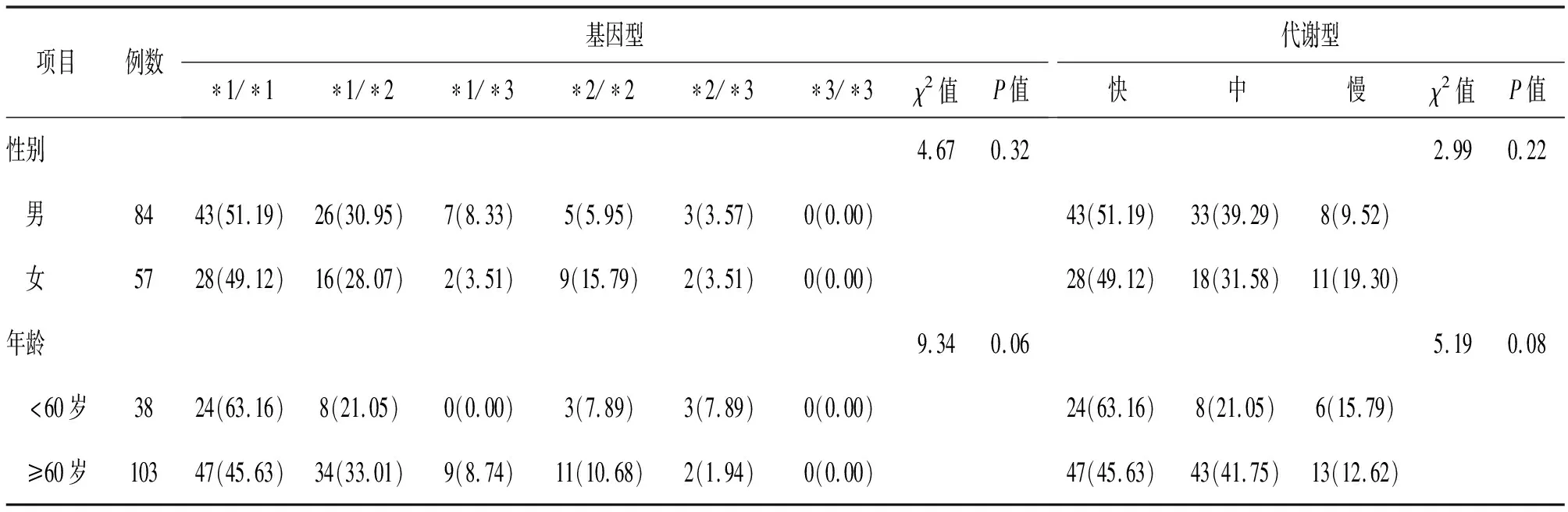
表3 脑卒中患者性别、年龄和CYP2C19基因多态性分布[例(%)]
2.4 冠心病和脑卒中患者CYP2C19基因型和代谢型比较 冠心病与脑卒中人群基因型分布前三位均分别为*1/*1(41.59%,50.35%)、*1/*2(39.81%,29.79%)、*2/*2(10.63%,9.93%)型,冠心病人群代谢型为中代谢型最多(45.22%),脑卒中人群代谢型为快代谢型最多(50.35%);不同病种之间的基因型和代谢型差异均无统计学意义(P>0.05)。见表4。
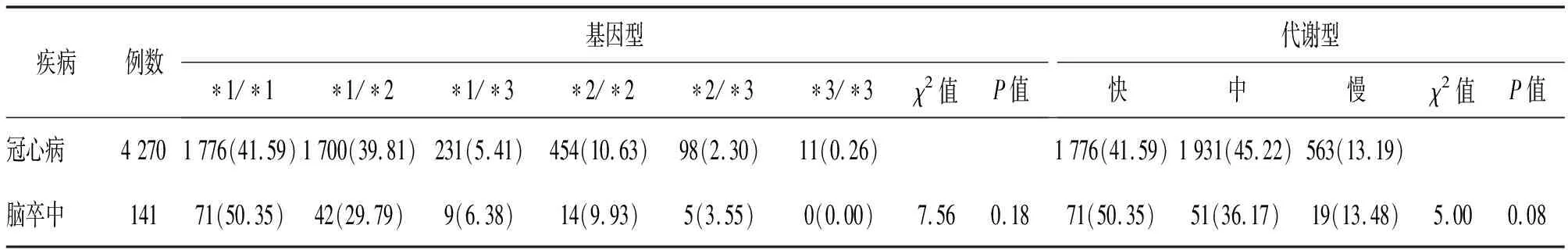
表4 不同病种CYP2C19基因多态性分布[例(%)]
3 讨论
CYP2C19 是细胞色素P450家族中重要一员,其基因多态性存在个体差异,这种多态性表现在基因编码区和非编码区存在许多碱基突变,这种突变会影响酶的活性,这是导致氯吡格雷抵抗的重要原因[5]。在接受氯吡格雷治疗的过程中,4%~30%患者存在氯吡格雷抵抗,在接受支架植入术后患者中1%~3%的患者出现亚急性支架内血栓,5%~6%存在双联抗血小板治疗抵抗[6-9]。为了改善这种由于基因多态性引起的氯吡格雷抵抗现象,2010年美国食品药品管理局(FDA)发布警告:通过CYP2C19基因型检测,对氯吡格雷慢代谢患者,建议增加氯吡格雷剂量或换用其他抗血小板药物。
本研究人群中,*1/*1和*1/*2基因型数量最多,*2/*2和*1/*3基因型次之,*2/*3和*3/*3基因型最少;代谢型方面,冠心病患者中代谢人群较多,而脑卒中患者快代谢人群较多。并且,不同基因型和代谢型与患者性别、年龄、病种之间的差异无关(虽然冠心病和脑卒中在快代谢和中代谢的数量上略有差异,但并无统计学意义)。
李洁等[10]的研究显示,安徽汉族人群与傣族、白族、回族、维吾尔族、哈萨克斯坦、蒙古族及黎族之间代谢型分布差异具有统计学意义。张秋等[11]及李琳等[12]的研究分别发现,苏州(中国东部)和武汉(中国中部)人群基因型前三位分别为*1/*2、*1/*1、*2/*2,与本研究结果略微不同;而代谢性均为中代谢型最多,与本研究结果相同。另据文献报道,在东亚和南亚人群中,CYP2C19*1/*1和*1/*2基因型最多,*2/*2和*1/*3基因型次之,*2/*3和*3/*3基因型最少[13],与本研究结果相符。
综上所述,冠心病和脑卒中患者存在基因多态性,且冠心病患者中代谢人群较多,而脑卒中患者快代谢人群较多;不同性别、不同年龄组之间以及两个病种之间的基因型和代谢性均差异无统计学意义。为了减少氯吡格雷抵抗的发生,推进精准医疗服务,建议临床使用氯吡格雷之前进行CYP2C19基因型检测。

