慢性乙肝肝硬化患者常见肠道菌群失衡与肝功能分级的关系研究
武 琼,李 艳,张 宁,张 锦
(1.榆林市第二医院消化内科,榆林 719000;2.延安大学附属医院妇科,延安 716000;3.延安大学附属医院消化内科,延安 716000)
肠道菌群与肝脏关系密切,两者不仅通过门静脉及淋巴系统建立直接的解剖学关联,同时肠道菌群辅助消化吸收,提供维生素K 等提高肝脏枯否细胞数量及功能,而肝脏则通过分泌性免疫球蛋白A、胆汁酸等维持肠道菌群生态平衡[1]。现阶段研究[2]显示肠道菌群失衡在肝硬化及多种相关并发症的发生及发展中起一定作用,但直接分析慢性乙型病毒性肝炎(Chronic Viral Hepatitis B,CHB)肝硬化患者肠道菌群失衡与肝功能Child-Pugh 分级相关性的报道尚少,基于此,本研究应用实时荧光定量PCR 技术检测肠道粪便总DNA,通过定量分析方案探讨了该问题,报告如下。
1 资料与方法
1.1 实验对象 2017 年1 月~2020 年12 月我院收治的CHB 肝硬化患者208 例及同期健康体检者100 例为对象,开展对照研究,本研究已获得院伦理委员会批准,纳入患者均知情且签署同意书。CHB 患者纳入标准:病历及诊断资料完整,且均符合《慢性乙型肝炎防治指南(2015 更新版)》[3]中CHB 肝硬化诊断相关标准;年龄18~65 岁;近1 个月内未应用抗生素、微生态调节剂等影响肠道微生态的药物。排除标准:近1 个月除HBV 外其它病毒、细菌及真菌感染;近1 个月内出现腹泻等胃肠道疾病;饮食习惯特殊者,如素食者。健康对照者均为常规检查正常者,同时排除饮食习惯特殊及近1 个月有可能影响肠道菌群行为或疾病者。
1.2 分组方案 根据Child-Pugh 分级结果,将患者中分级A 级者纳为A 级组,B 级者纳为B 级组,C 级者纳为C 级组,A 级组共101 例,男71 例、女30 例,年龄21~63 岁、平均(47.88±12.51)岁,乙肝病程8 个月~7年、平均(2.44±1.01)年,伴出血24 例;B 级组共86 例,男61 例、女25 例,年龄23~65 岁、平均(48.12±13.17)岁,乙肝病程2~15 年、平均(6.22±1.13)年,伴出血40例,伴腹水21 例,伴肝性脑病2 例;C 级组共21 例,男14 例、女7 例,年龄25~65 岁、平均(48.37±12.51)岁,乙肝病程5~20 年、平均(11.71±3.05)年。对照组共100 例,男64 例、女36 例,年龄18~65 岁、平均(48.50±12.37)岁,伴出血32 例,伴腹水27 例,伴肝性脑病7例。4 组性别、年龄对比,差异无统计学意义(P>0.05)。
1.3 实验步骤 ①粪便采集。所有对象的粪便标本均于排便后1h 内应用一次性采样勺采集,称取250mg 分装于EP 管,冻存于-80℃超低温冰箱,采集过程避免尿液污染。②总DNA 提取。主要试剂盒为天根生化科技生产的粪便基因组DNA 提取试剂盒DP328,参考试剂盒说明书,提取粪便总DNA,每份DNA 样品取2μl,应用分光光度计(SmartSpec 3000,美国Bio-Rad)检测样本质量。③实时荧光定量PCR 分析。主要分析常见菌属,包括肠杆菌属、肠球菌属、乳酸杆菌属、双歧杆菌属、拟杆菌属、梭菌属数量,针对细菌16s rRNA V4~V6 区设计对应均属特异性引物,构建质粒,通过荧光定量PCR技术检测对应菌属数量,单位按lg copies/g 湿粪表示。
1.4 统计学分析 采用SPSS 19.0 处理数据,计量资料均按mean±SD 表示,多组间对比采用重复测量的方差分析和SNK 检验,菌种数量与Child-Pugh 分级采用Spearman 相关性分析,菌种数量对诊断Child-Pugh 分级B~C 级的价值采用ROC 曲线分析,P<0.05 为差异有统计学意义。
2 结果
2.1 四组间实时荧光定量PCR 结果 经电泳图引物特异性检测,未见明显非特异性扩增,提示各细菌的引物特异性良好,能够用于实时荧光定量PCR。分析显示,6种细菌在不同组间表达均有明显差异,P<0.05。见表1。
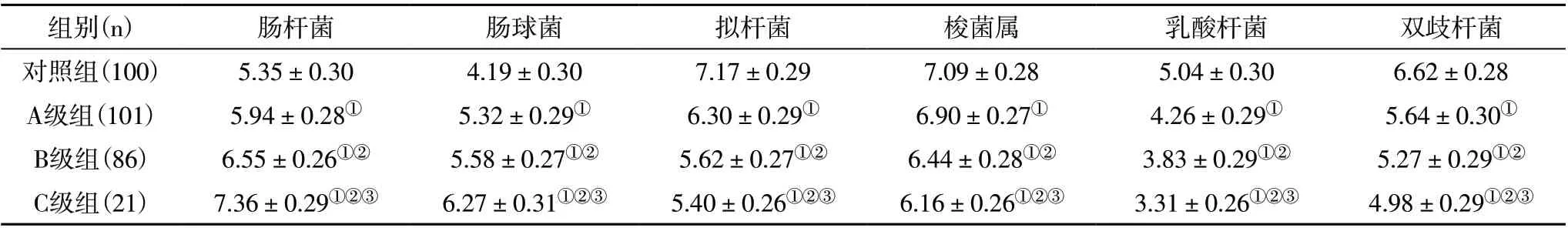
表1 四组间时候死荧光定量PCR结果对比(lg copies/g湿粪)
2.2 菌群数量与肝功能Child-Pugh 分级相关性分析对照组、A 级组、B 级组、C 级组分别赋值为0~3,经Spearman 相关性分析,肠杆菌、肠球菌数量与Child-Pugh分级正相关(P<0.001);拟杆菌、梭菌、乳酸杆菌、双歧杆菌均与Child-Pugh 分级负相关(P<0.001)。见表2。
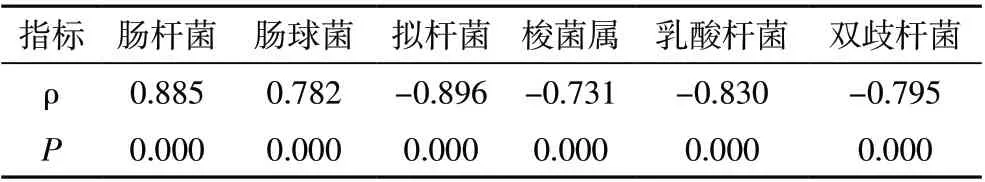
表2 菌群数量与肝功能Child-Pugh分级相关性分析
2.3 不同菌群数量对诊断肝功能Child-pugh 分级B ~C 级价值 R O C 曲线显示肠杆菌、肠球菌、拟杆菌、梭菌属、乳酸杆菌、双歧杆菌均能有效预测C h i l d-P u g h 分级B ~C,曲线下面积分别为0.817(P<0.001,95%CI=0.767~0.868)、0.800(P<0.001,95%CI=0.748~0.852)、0.747(P<0.0 0 1,9 5%C I=0.6 9 1 ~0.8 0 3)、0.7 9 2(P<0.0 0 1,9 5%C I=0.7 3 9 ~0.8 4 5)、0.7 6 2(P<0.001,95%CI=0.707~0.808)、0.932(P<0.001,95%CI=0.900~0.964)。进一步分析可知:肠杆菌数量≤6.05 单位时,其诊断特异度1.000,≥6.40 时诊断敏感度1.000,最佳截断值6.30 单位,此时敏感度0.797,特异度0.843;肠球菌数量≤5.09 单位时,其诊断特异度1.000,≥5.83 单位时其诊断敏感度1.000,最佳截断值5.43 单位,此时敏感度0.778,特异度0.810;拟杆菌数量≤5.84单位时,其诊断敏感度1.000,≥6.12 单位时诊断特异度1.000,最佳分界值6.08 单位,此时敏感度0.601,特异度0.850;梭菌属≤6.38 单位时,其诊断敏感度1.000,≥6.91 单位时诊断特异度1.000,最佳分界值6.69 单位,此时敏感度0.731,特异度0.810;乳酸杆菌≤3.76 单位时,其诊断敏感度1.000,≥4.31 单位时诊断特异度1.000,最佳分界值4.05 单位,此时敏感度0.804,特异度0.634;双歧杆菌≤5.12 单位时,其诊断敏感度1.000,≥5.72单位时诊断特异度1.000,最佳分界值5.44 单位,此时敏感度0.928,特异度0.895。见图1。
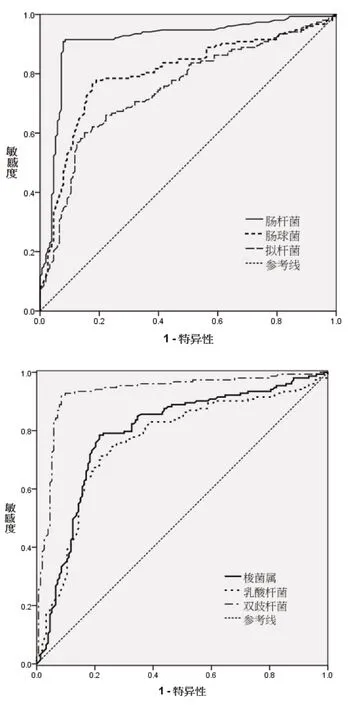
图1 不同菌群数量对预测肝功能Child-Pugh分级B~C级价值
3 讨论
CHB 肝硬化患者往往存在明显的免疫功能紊乱,机体免疫功能下降,肠道难以抵抗外侵菌定植及繁殖,因此肠道菌群生态平衡被打乱[4]。本研究纳入208 例患者,研究发现CHB 患者肠道菌群失衡,表现为肠杆菌属、肠球菌属数量上升,乳酸杆菌属、双歧杆菌属、拟杆菌属、梭菌属数量下降。张雯等[5]报道纳入65 例肝硬化患者和65 例健康人群,对比显示肝硬化患者肠道肠球菌、肠杆菌明显上升,双歧杆菌明显下降。这提示CHB 致肝功能损伤后,革兰阴性菌明显增加,这会影响肠道的辅助消化功能,且紊乱菌群可能直接上行至上消化道,释放内毒素,后者进入门静脉则会影响肝脏廓清能力,引发内毒素血症,加重肝病[6]。这提示改善肠道菌群紊乱可能有助于提升CHB 及肝硬化患者肝功能,从而提升疾病疗效。曹玲等[7]利用枯草杆菌肠球菌二联活菌胶囊治疗63 例肝炎后肝硬化失代偿期患者,显示能够有效降低内毒素水平,从而改善患者预后;石勇明等[8]利用双歧杆菌四联活菌片辅助治疗乙肝后肝硬化患者,结果显示能够进一步改善患者肝功能;梁惠[9]等报道也有类似结论。
肠道菌群紊乱和CHB 肝硬化患者肝功能下降可通过负性循环彼此促进[10],导致患者肝功能持续下降,这提示肠道菌群紊乱与患者Child-Pugh 分级也有一定相关性。本研究发现随Child-Pugh 分级的上升,患者肠道菌群失衡明显加剧,肠杆菌、肠球菌数量与Child-Pugh 分级正相关,拟杆菌、梭菌、乳酸杆菌、双歧杆菌均与Child-Pugh 分级负相关。唐源淋等[11]报道也显示肠球菌与谷丙转氨酶水平及谷草转氨酶呈正相关,双歧杆菌、拟杆菌等也分别于部分肝功能指标正显著相关性,提示肠道菌群紊乱与患者肝功能损伤程度有关,部分综述性报道[12]也有类似结论。
部分研究[13]还提示肠道菌群失衡在CHB 肝硬化其它并发症的发生及发展中起重要作用,并与患者预后情况有一定相关性。因此探讨主要菌种对诊断肝功能严重下降的界值有一定价值。本研究所纳入6 种细菌均能够有效诊断Child-Pugh 分级B~C 级,这提示其积极检测上述粪便中上述菌种水平,对早期预测患者预后有一定价值。本研究发现当肠杆菌数量≤6.05 单位、肠球菌数量≤5.09 单位、拟杆菌数量≥6.12 单位、梭菌属≥6.91 单位、乳酸杆菌≥4.31 单位、双歧杆菌≥5.72 单位时,患者肝功能多处于较良好水平,进一步提示在CHB 早期需要重视改善患者肠道菌群失衡,这与既往报道[14]结论相符。
本研究亦有一定不足:目前基于宏基组高通量全基因组测序技术检查肠道菌群,可检测到门、纲、目、科、属、种水平,肠道在属种水平有300 余种菌[15],本研究只检测了6 种常见,存在明显偏差,尚待后续研究补充。
总之,CHB 患者普遍存在肠道菌群失调,表现为肠杆菌属、肠球菌属数量上升,乳酸杆菌属、双歧杆菌属、拟杆菌属、梭菌属数量下降,且变化程度与肝功能有密切关系。

