沉默神经元HIF-1α和PTEN的表达对体外培养的大鼠神经元氧糖剥夺损伤的影响
唐静华,杨 颖,陈 洁,李廷玉,代 英
重庆医科大学附属儿童医院儿童保健科//国家儿童健康与疾病临床医学研究中心//儿童发育疾病研究教育部重点实验室//儿童营养与健康重庆市重点实验室,重庆400014
缺氧是机体循环障碍和代谢异常最常见的并发症之一,容易造成神经系统损伤。缺氧诱导因子1α(HIF-1α)是体内关键性的缺氧调节转录因子,在缺氧条件下,HIF-1α以异二聚体的形式与缺氧诱导因子β一起易位到细胞核并调控下游靶基因的表达[1,2]。磷酸酶并和张力蛋白同源物(PTEN)广泛参与到细胞生长、分化、增殖和凋亡等生长发育的关键过程中,它和HIF-1α在许多生理病理过程中都相互关联,如血管生成和胶质母细胞瘤等[3,4]。大量研究表明,随着HIF-1α的增加,PTEN表达水平降低,HIF-1α和PTEN的表达呈负相关[5-9];在我们前期不同缺氧模型研究中也发现二者呈负相关[10,11],但在缺氧下HIF-1α与PTEN 之间如何进行调控尚不清楚。本研究拟在神经元内针对性的沉默HIF-1α、PTEN以论证它们在缺氧条件下的调节机制,为临床治疗提供新思路。
1 材料和方法
1.1 主要材料
Si-hif-1α慢病毒、Si-pten慢病毒(和元生物公司);DMEM/F12 培养基、neurobasal 培养基、B27(Gibco),Medium 199培养基(Hyclone);胎牛血清(fetal bovine serum,FBS)(AusGeneX);Simply P总RNA提取试剂盒(莱博斯);RT-PCR、SYBR-Green Realtime-PCR(TaKaRa);Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒、乳酸脱氢酶细胞毒性检测试剂盒(碧云天);全蛋白提取试剂盒(KeyGEN);HIF-1α抗体、PTEN抗体(Abcam);GAPDH抗体(正能生物)。
1.2 方法
1.2.1 大鼠原代神经元的培养 将6孔板用多聚赖氨酸铺板过夜晾干,取孕17~20 d SD大鼠(重庆医科大学实验动物中心提供)胎鼠,冰75%酒精消毒后断头取出大脑,分离皮层及海马,轻轻剔除脑膜及血管后剪成约1 mm3小块(以上操作在冰上进行)。加入0.125%的胰酶,于37 ℃孵箱中消化10 min,加入等体积含10%FBS 的DMEM/F12培养基终止消化,轻轻吹打数次至均匀,200 目不锈钢筛网过滤。1000 r/min,5 min 离心后重悬,计数,以1.8×106/孔密度种植于包被过的多聚赖氨酸的6孔板内,置于37 ℃、5%CO2培养箱中培养。4~6 h后将培养液全部换成含0.5%青链霉素、0.5 mmol/L谷氨酰胺、2%B27的无血清neurobasal培养基,每3 d半量换液1次,倒置相差显微镜下观察细胞生长情况。
1.2.2 慢病毒感染神经元 原代神经元培养第3天弃一半神经元培养基。取出慢病毒于4 ℃溶解后加入到相应培养皿中轻轻混匀,每孔加病毒量(μL)=MOIx感染时细胞数/滴度(TU/mL)×1000。培养过夜,将含有病毒的神经元培养基全部换成新鲜培养基。慢病毒带有增强的绿色荧光蛋白(EGFP),在感染72 h后可用倒置荧光显微镜激发EGEP,观察其在细胞中的表达强度。
我们将病毒以不同的感染复数(MOI)(1、2、5、10、20)值感染神经元,在感染72 h后观察荧光表达,以得到最佳MOI值。
1.2.3 神经元OGD损伤 在神经元培养第7天弃去神经培养基,用PBS液洗细胞3次,换成M199培养基2 mL,置于孵箱中培养1.5 h,观察细胞形态,见胞体变圆,突起缩短,更换为新鲜Neurobasal培养基。对照组也换成新鲜培养基。
1.2.4 实验分组 将提取的原代神经元分成4组:(1)NC组:仅加空载病毒;(2)NC+OGD组:加空载病毒后缺氧;(3)Si-hif-1α+OGD组:加Si-hif-1α病毒后缺氧;(4)Si-pten+OGD组:加Si-pten病毒后缺氧。细胞均在培养第3天感染病毒,第7天建立OGD损伤模拟细胞缺氧,缺氧后24 h用于实验。
1.2.5 Realtime-PCR检测各组神经元中HIF-1α、PTEN及ⅤEGF的mRNA的表达 按Simply P总RNA提取试剂盒中的操作说明提取处理后的神经元总mRNA,进行去除基因组DNA 及逆转录反应。使用TB Green Premix Ex Taq Ⅱ和CFX Connect Real-Time System以cDNA为模板进行实时定量聚合酶链反应,扩增条件:95 ℃×30 s,95 ℃×5 s,60 ℃×30 s,共40个循环,95 ℃×30 s。所得的数据用内参基因β-actin进行标准化后再进行比较分析。本实验所涉及的引物均由艾科瑞生物合成,基因的引物序列见表1。
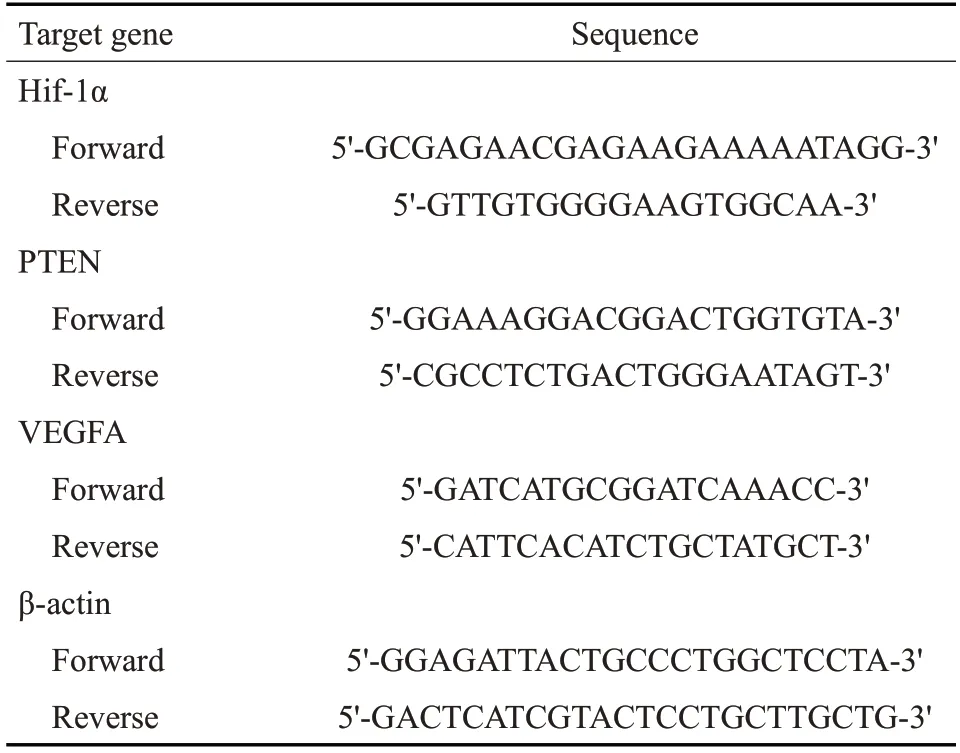
表1 基因的引物序列Tab.1 Primer sequences for the target genes
病毒感染效率的检测分组如下:CT组(不做任何处理),NC组,NC+OGD组,Si-hif-1α+OGD组(Y13625 CCATGTGACCATGAGGAAA,Y13626 GCCAGCA AGTCCTTCTGAT 和Y13627 GCTCATCCAAGGAG CCTTA)和Si-pten组(Y13628 GCTAAGTGAAGACG ACAAT,Y13629 GCCAGCTAAAGGTGAAGAT 和Y13630 CCGATACTTCTCTCCAAAT)。来分别确定HIF-1α及PTEN沉默效率最佳的一条病毒。
1.2.6 神经元细胞LDH测定和凋亡检测 LDH测定收集各组神经元培养基,离心弃沉淀后于-80 ℃密封冻存,临用前4 ℃溶解。按LDH试剂盒说明书要求取适量培养基加入试剂后摇床震荡混匀,避光孵育30 min,酶标仪(波长490 nm)测量各组吸光值A490nm,并根据说明书计算。
凋亡检测根据Annexin Ⅴ-FITC/PI试剂盒说明书,将390 μL Annexin Ⅴ-FITC 结合液、10 μL Annexin Ⅴ-FITC和20 μL 碘化丙啶染色液混匀后均匀覆盖到细胞表面,室温下避光静置反应15 min。将细胞于荧光显微镜下观察,在同一放大倍数、相同曝光条件下拍照,PI荧光信号呈红色。利用Image J 软件计数并统计。
1.2.7 Western blot检测神经元中HIF-1α,PTEN、p-PTEN、AKT、p-AKT和NR2A蛋白表达情况 收集细胞,预冷的PBS洗3次,加入细胞裂解液(Lysis Buffer:磷酸酶抑制剂:蛋白酶抑制剂:PMSF=1000∶10∶1∶5),冰上裂解30 min,制备蛋白样品,BCA 法检测各组样品蛋白浓度。取40 μg蛋白样品上样进行SDS-PAGE电泳分析,然后转膜至PⅤDF膜上,室温下快速封闭液封闭12 min,PBST 洗膜3 次后加入相应一抗4 ℃摇床孵育过夜。PBST洗膜5次,二抗封膜,室温摇床孵育1 h,再次洗膜5次。ECL化学发光法检测显影。使用ImageJ(NIH)对灰度图像进行定量分析,以GAPDH作为内部参考。
1.3 统计分析
每组实验至少重复3 次,使用的统计软件为GraphPad Prism 9.0,所有数据均用均数±标准差表示,多组样本间差异使用单因素方差分析比较,P<0.05为差异具有统计学意义。
2 结果
2.1 慢病毒的感染复数和感染效果
空载病毒NC(GL404NC2)以不同MOI(1、2、5、10和20)感染神经元,细胞内的荧光表达强度是评估慢病毒感染效率的一项指标,在感染72 h后用倒置荧光显微镜激发细胞内的EGFP检测其荧光表达强度。可以看出在MOI≥5的时候荧光强度差异不大(图1A、B)。因此,我们选择MOI=5用于后续的实验。
用qRT-PCR 分别检测Si-hif-1α和Si-pten病毒的感染效率,可见Y13627和Y13630的沉默作用最显著(P<0.001,图1C、D),所以选择这两条病毒用于后续实验。并且,结果显示CT组和NC组的HIF-1α和PTEN mRNA表达没有显著差异(P=0.99,P=0.98)。
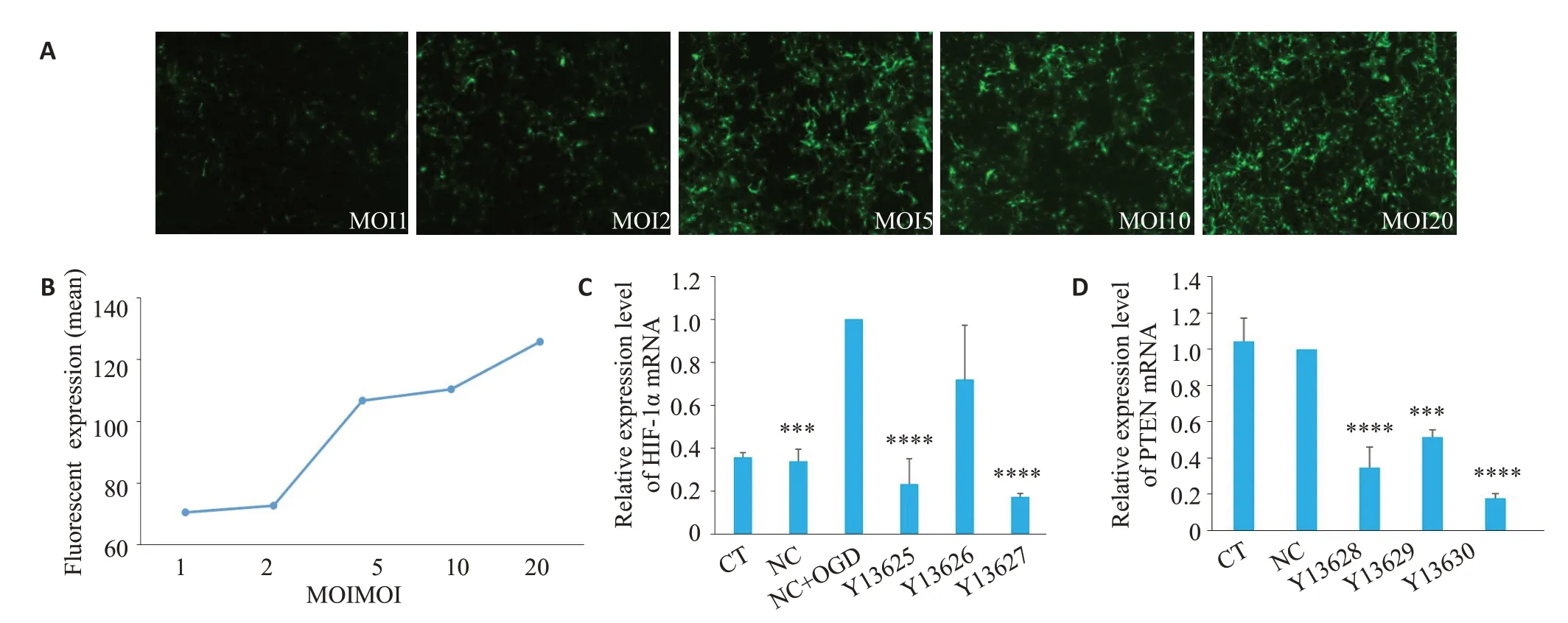
图1 慢病毒的感染复数和感染效果Fig.1 Multiply of infection (MOI) and infection effect of the lentiviral vectors in rat neurons.A:Fluorescence microscopy of the neurons at 72 h of lentivirus infection with different MOI (1,2,5,10,and 20) (Original magnification:×40).B:Fluorescence intensity analyzed by Image J.C:Relative HIF-1α mRNA expression levels in CT,NC,NC+OGD and Si-hif-1α+OGD groups (Y13625,Y13626,and Y13627).***P<0.001,****P<0.0001 vs NC+OGD.D:Rrelative PTEN mRNA expression levels in CT,NC,and Si-pten groups(Y13628,Y13629,and Y13630).***P<0.001,****P<0.0001.CT:Control.NC:Addition of empty virus only.NC+OGD:Addition of empty virus followed by hypoxia.
2.2 分别沉默HIF-1α和PTEN后缺氧神经元的损伤及凋亡水平检测
结果显示NC+OGD组较NC组神经元凋亡的数量显著升高(P=0.02);而在沉默HIF-1α后再去缺氧,神经元凋亡程度进一步加重(P=0.03);沉默PTEN后OGD神经元凋亡水平降低(P=0.04,图2A、B)。
神经元损伤与凋亡结果基本一致。缺氧后神经元的损伤加重(P<0.001),沉默HIF-1α后缺氧,神经元损伤进一步加重(P=0.002),沉默PTEN后可减轻OGD神经元的损伤程度(P=0.001,图2C)。
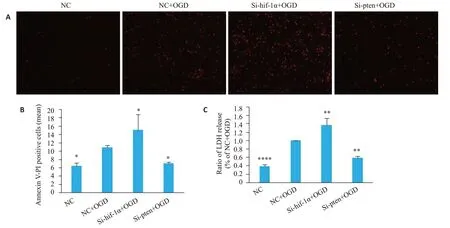
图2 沉默HIF-1α及PTEN下OGD损伤后神经元凋亡程度和损伤水平检测Fig.2 Apoptosis and LDH levels in the neurons in different groups.A:Late apoptosis(PI staining,red)of the neurons(×100).B:Number of apoptotic neurons in different groups (PI staining,red).C:Levels of LDH released by the neurons in each group.*P<0.05,**P<0.01,****P<0.0001 vs NC+OGD.
2.3 神经元中HIF-1α、PTEN及p-PTEN蛋白水平检测
在缺氧条件下,神经元中HIF-1α、PTEN可被成功激活,量化分析结果具有统计学差异(P=0.004,P=0.046),沉默PTEN后,对HIF-1α的表达无显著影响(P>0.99,图3A、B),而当HIF-1α被沉默后,PTEN较NC+OGD组再次增加且具有统计学差异(P=0.006,图3A、B)。p-PTEN是PTEN的稳定形式,我们采用p-PTEN/PTEN的比值来分析p-PTEN的表达变化,可以看到,缺氧后p-PTEN明显降低(P=0.01),当HIF-1α被沉默时p-PTEN的表达进一步降低(P=0.02),在沉默PTEN后,p-PTEN显著升高(P<0.001,图3A、B)。
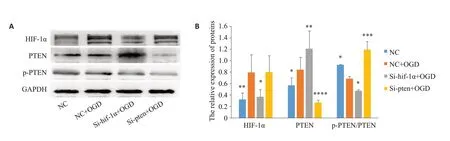
图3 Western blot检测神经元各组中HIF-1α、PTEN及p-PTEN蛋白表达水平的变化Fig.3 Protein expressions of HIF-1α and PTEN in the neurons with different treatments determined by Western blotting.A:Western blots of HIF-1α,PTEN and p-PTEN proteins.B:GAPDH-normalized HIF-1α and PTEN protein levels and PTEN-normalized p-PTEN protein level.*P<0.05,**P<0.01,***P<0.001,****P<0.0001 vs NC+OGD.
2.4 神经元中NR2A、AKT及p-AKT蛋白水平检测
NR2A在缺氧后有明显的升高(P=0.02),沉默HIF-1α后再缺氧,NR2A蛋白的表达又明显降低(P=0.04,图4A、B)。磷酸化的AKT是活化形式,用p-AKT/AKT来表示AKT的活性。缺氧后AKT的活性明显降低(P<0.001),PTEN被沉默后又出现明显升高(P=0.006,图4A、B)。
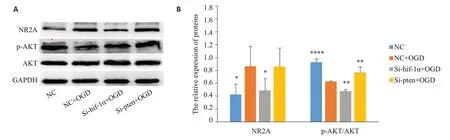
图4 Western blot检测神经元各组中NR2A、AKT及p-AKT蛋白表达水平的变化Fig.4 Expressions of NR2A,AKT and p-AKT proteins in different groups.A:Western blots of NR2A,AKT and p-AKT proteins.B:GAPDH-normalized NR2A protein level and AKT-normalized p-AKT protein level,*P<0.05,**P<0.01,****P<0.0001 vs NC+OGD.
2.5 各组神经元中ⅤEGFa mRNA水平检测
ⅤEGFa在缺氧后有明显的升高,结果具有统计学意义(P<0.001,图5),当沉默HIF-1α后在再缺氧,ⅤEGFa mRNA表达又明显降低,结果具有统计学意义(P=0.004),沉默PTEN下缺氧对ⅤEGFa的mRNA表达则无明显影响(P=0.12)。
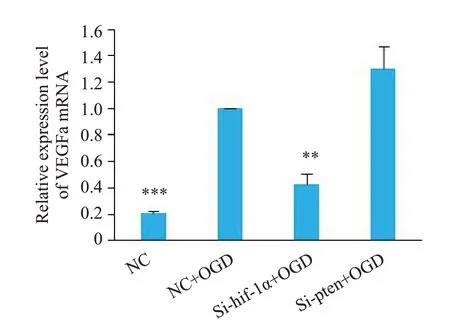
图5 qRT-PCR 检测各组中的ⅤEGFa mRNA的表达水平Fig.5 VEGFa mRNA expression levels detected by qRT-PCR in different groups.**P<0.01,***P<0.001 vs NC+OGD.
3 讨论
3.1 慢病毒介导的shRNA能感染SD大鼠原代神经元,并能有效沉默Hif-1α及PTEN的表达
RNA干扰能够特异性地、快速、高效地抑制靶基因的表达[12],以病毒为载体的shRNA可整合于靶细胞的目的基因而持久性的表达,它有助于阐明包括原代细胞在内的多种细胞类型的基因功能[13]。本研究用慢病毒介导的shRNA感染原代神经元,病毒的EGFP荧光表达强度显示慢病毒介导的shRNA能够感染SD大鼠原代神经元。通过qRT-PCR 检测病毒的感染效率,可见Y13627和Y13630的沉默作用最显著(P<0.001),并且CT组和NC组的目的基因表达没有显著差异(P=0.99,P=0.98),证明慢病毒本身不会影响目的基因的表达,由于各组均有病毒的作用,因此我们实验设计用NC组作为阴性对照组。这部分结果也证明慢病毒质粒构建成功。
3.2 缺氧条件下HIF-1α升高可保护OGD损伤后的神经元,降低神经元损伤及凋亡水平
HIF-1α在很多病理损伤及神经退行性疾病中可能发挥着重要的保护作用[14-18]。当机体处于正常的氧分压时,HIF-1α被脯氨酸羟化酶所羟基化后很容易被降解,而在缺氧状态下脯氨酸羟化酶的活性会受到抑制,聚集的HIF-1α进入细胞核与缺氧诱导因子β1相结合,形成具有活性的稳定型异源二聚体HIF-1[19,20],激活下游缺氧反应元件来介导细胞缺氧适应性反应[21]。我们课题组前期实验显示缺氧预处理可激活HIF-1α,促进细胞分泌神经营养和保护因子,从而有效修复缺氧缺血脑损伤新生大鼠认知功能[22],这与Xia等[23]的实验结果类似。本实验中也可以看到,缺氧后神经元细胞的损伤及凋亡情况均显著增加,此时有HIF-1α蛋白及保护因子ⅤEGF mRNA的升高,所以我们进一步有针对性的沉默HIF-1α基因,结果显示缺氧细胞的凋亡及损伤明显增加。我们又将PTEN基因沉默,显示缺氧神经元的损伤及凋亡情况明显好转,就更加肯定的得出HIF-1α的升高以及PTEN的降低对缺氧神经元有保护作用,他们可以降低神经元损伤及凋亡水平。
3.3 在神经元OGD损伤中HIF-1α的保护作用是通过抑制PTEN的活性来实现的
PTEN作为磷脂酰肌醇3激酶(PI3K)信号通路重要的负调控因子,广泛参与到细胞生长发育的关键过程中[24,25],它可拮抗PI3K/AKT的信号传导通路[26-28]。本实验中,可以看到在缺氧条件下,神经元中HIF-1α及PTEN均可被成功激活,这与我们之前讨论的HIF-1α和PTEN 的表达呈负相关相互矛盾。为了探究它们间的关系,我们在神经元内针对性的分别沉默这两个基因来探究它们的调节机制。研究发现当HIF-1α被沉默后,PTEN较仅缺氧时显著增加,当PTEN沉默后,对HIF-1α的表达无显著影响,故证实在神经元OGD损伤中HIF-1α对PTEN 有抑制作用。并且,随着PTEN 的升高及降低,p-PTEN及p-AKT的活性也出现相应变化。因而推测:在神经元OGD损伤中PTEN的活性被抑制可进一步激活PTEN-PI3K/AKT信号通路。
3.4 在神经元OGD损伤中的保护作用有突触可塑性调控的参与
本课题组前期实验发现用缺氧细胞的培养基对HIBD模型大鼠进行脑室内灌注,能改善大鼠的空间学习记忆,并且AMPA 的亚基GluR2 有明显升高,表明HIF-1α参与了AMPA的突触可塑性调控[22]。有学者在研究中发现PTEN也参与了细胞突出可塑性的调节,并且这种调节作用是通过PI3K信号通路实现的[29,30]。本实验结果显示在缺氧环境下,NMDA受体NR2A也被激活,并且随着HIF-1α的沉默而降低。我们推测HIF-1α可能通过调控突触相关蛋白的表达,而在缺氧神经元中发挥作用。
综上,缺氧神经元中,HIF-1α升高并且抑制PTEN来达到保护神经元的作用,这种保护作用中也有突触可塑性调控的参与。这将为缺氧导致的疾病的防治带来新的思路。