黑棘皮病和非黑棘皮病患者的总睾酮水平与胰岛素抵抗的相关性
张 玲,李贵芳,苏莉莉,杜 磊,周东雷,程晓芸,林紫薇,曲 伸1,
1南京医科大学附属上海十院临床医学院内分泌与代谢病科,上海 200072;2苏州大学附属常州肿瘤医院内分泌科,江苏 常州 213000;3同济大学附属第十人民医院内分泌代谢中心,同济大学附属第十人民医院减重糖尿病代谢外科,国家标准化代谢性疾病管理中心(上海市第十人民医院),同济大学医学院肥胖症研究所,上海200072
黑棘皮病(AN)多伴有超重和肥胖,以脂肪过剩、异位分布堆积为特征,常常出现糖脂代谢失调、性激素调节紊乱、β细胞分泌胰岛素增加、高胰岛素血症[1]。黑棘皮病是发生胰岛素抵抗和早期糖尿病的特异性表皮标志[2]。肥胖时高浓度胰岛素不仅与胰岛素受体的结合增加,还直接与皮肤角质形成细胞中胰岛素样生长因子受体结合,导致黑棘皮病的发生[3,4]。高雄激素血症、胰岛素抵抗和黑棘皮病综合征中,胰岛素抵抗和高雄激素血症的严重程度呈正相关[5],也有研究认为女性高雄激素、男性低雄激素与肥胖和黑棘皮病有关[6]。
但黑棘皮病皮肤症状的严重程度与雄激素水平并没有直接相关性[7],体脂总量增加的本身也不是黑棘皮病雄激素水平异常的主要原因[5]。研究表明,黑棘皮病空腹胰岛素水平和睾酮、雄烯二酮水平显著相关[7]。一项回顾性横断面研究发现,患有多囊卵巢综合征的肥胖女性游离雄激素指数、雄烯二酮、高雄激素血症与HOMA-IR正相关[8]。肥胖黑棘皮病男性患者雄激素水平总体偏低,而行袖带减重术后总睾酮水平与FINS、HOMA-IR正相关[9]。以往的研究多使用小样本,仅提示肥胖/超重的黑棘皮病和非黑棘皮病的发生发展过程中,雄激素总体异常和胰岛功能之间的相互作用可能起到重要作用,但具体的雄激素水平分级差异对不同疾病的影响尚待进一步研究。我们采用回顾性研究,分析不同总睾酮水平时,不同性别黑棘皮病和非黑棘皮病人群胰岛素抵抗和胰岛素敏感性等指标的差异,以探索总睾酮对胰岛功能影响的特点和规律,发现可能影响胰岛功能变化的总睾酮水平范围。
1 资料和方法
1.1 研究对象
自2010年01月~2019年12月,上海市第十人民医院内分泌科就诊的BMI≥24 kg/m2的患者共639例(男性年龄18~60岁,女性年龄18~50岁),其中黑棘皮患者266例,非黑棘皮患者373例,进行回顾性病例对照研究。本研究经上海市第十人民医院伦理委员会批准(临床注册号:ChiCTR-OCS-12002381),获得研究对象同意后采集基础资料。
1.2 诊断标准
(1)超重:体质量指数(BMI)≥24 kg/m2;(2)肥胖症:BMI≥28 kg/m2;(3)总睾酮水平:以上海市第十人民医院检测设备测定本地人群后确定的正常范围值为标准,女性总睾酮(TT)高于1.42 nmol/L为高雄激素,男性总睾酮低于6.68 nmol/L为雄激素降低;(4)黑棘皮病:颈部皮肤出现黑棘皮样病变,局限于颅骨下方,或超过颈部侧缘,宽度≥2 cm[10]。
1.3 排除标准
(1)糖尿病、继发性黑棘皮病、继发性肥胖症,伴急慢性重度感染、器官功能衰竭、恶性肿瘤及急性应激状态,妊娠及哺乳期女性,服用激素等影响雄激素水平的药物者。
1.4 指标测定及评估方法
研究对象空腹8 h,于次晨抽取静脉血,采用放射免疫法测定总睾酮。并进行75 g口服葡萄糖耐量实验(OGTT)和胰岛素释放实验(IRT),测定0、30、60、120、180 min血浆葡萄糖(GLU)和胰岛素(INS)水平,计算稳态模型-胰岛素抵抗指数(HOMA-IR)=PG0×INS0/22.5,胰岛素生成指数(IGI)=△INS30/△PG30=(INS30-INS0)/(PG30-PG0),稳态模型-胰岛β细胞功能指数(HOMA-β)=20×INS0/[PG0-3.5],总体胰岛素敏感性指数(WBISI)=10 000/平方根{INS0×PG0×[(PG平均×INS平均)]},血糖曲线下面积(AUC-GLU)=0.5×[30×(PG0+PG30)+30×(PG30+PG60)+60×(PG60+PG120)+60×(PG120+PG180)],胰岛素曲线下面积(AUC-INS)=0.5×[30×(INS0+INS30)+30×(INS30+INS60)+60×(INS60+INS120)+60×(INS120+INS180)]。
1.5 统计学方法
统计学分析及图表绘制用SPSS 22.0 软件进行。协方差分析用于比较正态分布两组组间差异。组间构成比用卡方检验。以时间为横坐标,分别以血浆葡萄糖、血浆胰岛素水平为纵坐标,绘制四分位总睾酮水平时血浆葡萄糖及胰岛素曲线图。P<0.05为差异有统计学差异。
2 结果
2.1 不同总睾酮水平血糖和血糖曲线下面积变化
不同总睾酮水平黑棘皮病、非黑棘皮病患者的血糖无明显统计学差异(图1、2)。男性和女性的AUC-GLU在不同总睾酮水平均无明显统计学差异(表1)。
2.2 不同总睾酮水平胰岛素和胰岛素曲线下面积变化
女性非黑棘皮病组中,随着总睾酮水平升高,胰岛素水平呈升高趋势。30、120 min的INS,在总睾酮Q4水平上较Q1升高(P<0.05)。120 min的INS,在总睾酮Q3水平时,也出现升高(P<0.05,图1)。男性非黑棘皮病组中,随着总睾酮水平下降,胰岛素水平呈升高趋势。120、180 min的INS,在总睾酮Q1水平明显升高(Q1较Q4,P<0.01)。女性和男性的黑棘皮病组较非黑棘皮病组的胰岛素总体水平升高,黑棘皮病组中INS在不同总睾酮水平均无明显统计学差异(图2)。

图1 OGTT and IRT:女性非黑棘皮病患者及黑棘皮病患不同总睾酮水平血糖和胰岛素变化Fig.1 Curves of glucose and insulin levels changes in OGTT and IRT female NAN and AN patients with different total testosterone levels.NAN quartile groupings of female (NAN,Q):NAN,Q1 (TT 0.06-0.72 nmol/L);NAN,Q2(TT 0.73-1.20 nmol/L);NAN,Q3(TT 1.21-1.82 nmol/L);NAN,Q4(TT 1.86-10.20 nmol/L).AN quartile groupings for female(AN,Q):AN,Q1(TT 0.09-0.69 nmol/l),AN,Q2(TT 0.76-1.16 nmol/L);AN,Q3(TT 1.22-1.83 nmol/L);AN,Q4(TT 1.86-6.86 nmol/L).aP<0.05 vs Q1.NAN:Non-acanthosis nigrican;AN:Acanthosis nigrican.
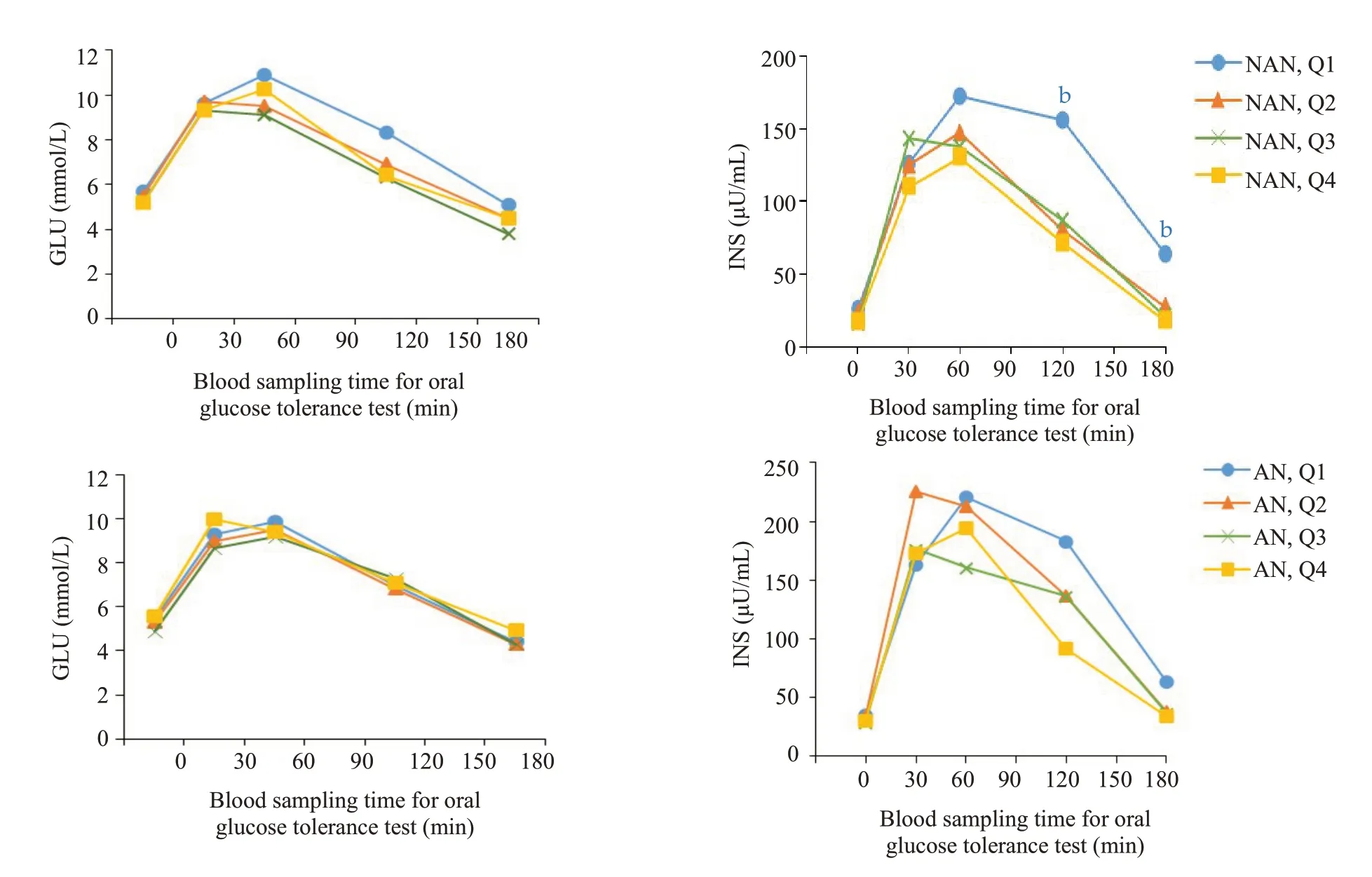
图2 OGTT and IRT:男性非黑棘皮病患者及黑棘皮病患不同总睾酮水平血糖和胰岛素变化Fig.2 Changes of glucose and insulin levels in OGTT and IRT in male NAN and AN patients with different total testosterone levels.NAN quartile groupings for males (NAN,Q):NAN,Q1 (TT 0.10-6.40 nmol/L);NAN,Q2 (TT 6.50-9.30 nmol/L);NAN,Q3 (TT 9.50-12.00 nmol/L);NAN,Q4 (TT 12.20-44.40 nmol/L).AN quartile groupings for males (AN,Q):AN,Q1(TT 0.16-6.20 nmol/L);AN,Q2 (TT 6.46-9.20 nmol/L);AN,Q3 (TT 9.40-12.10 nmol/L);AN,Q4(TT 12.20-18.00 nmol/l).bP<0.01 vs Q4.NAN:Non-acanthosis nigrican;AN:Acanthosis nigrican.
黑棘皮病组女性和男性的AUC-INS较非黑棘皮病组总体水平升高。女性总睾酮在Q2水平时,黑棘皮病组AUC-INS 较非黑棘皮病组AUC-INS 明显增加(P<0.01)。男性总睾酮在Q2-4水平时,黑棘皮病组AUC-INS均较非黑棘皮病组增加(P<0.05)。非黑棘皮病组女性随着总睾酮升高,AUC-INS呈升高趋势。与非黑棘皮病患者Q1比较,AUC-INS在女性非黑棘皮病患者Q3升高(P<0.05)、非黑棘皮病患者,Q4显著升高(P<0.01)。非黑棘皮病组男性随着总睾酮下降,AUC-INS呈升高趋势。与非黑棘皮病患者,Q4比较,AUC-INS 在男性非黑棘皮病患者,Q1 升高(P<0.05,表1)。
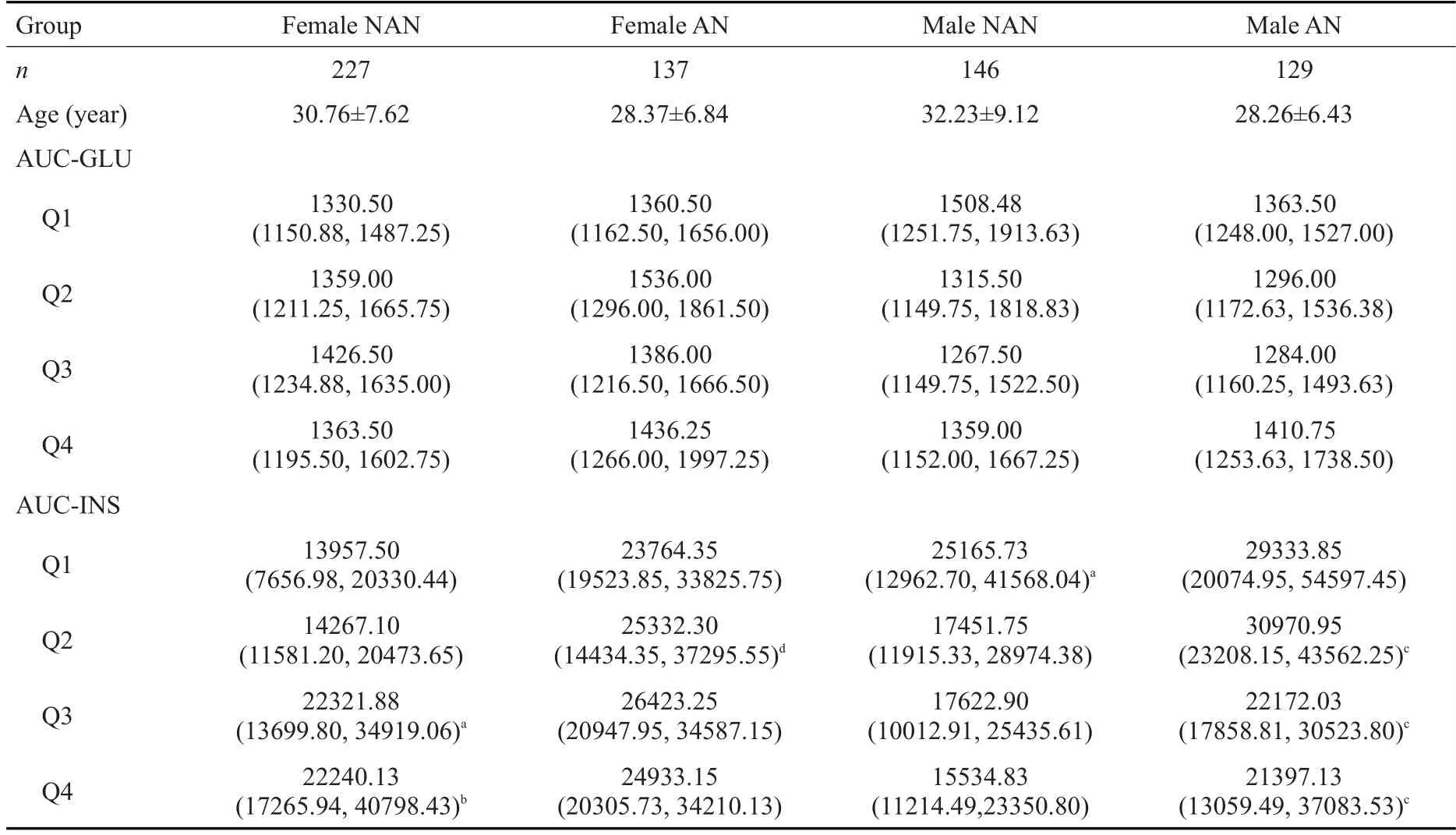
表1 OGTT和IRT:非黑棘皮病及黑棘皮病患者不同总睾酮水平血糖曲线下面积、胰岛素曲线下面积变化Tab.1 Changes of glucose and insulin area under the curve in OGTT and IRT in female NAN and AN patients with different total testosterone levels
2.3 不同总睾酮水平胰岛素抵抗和胰岛素敏感性比较
在不同总睾酮水平,黑棘皮病男性和女性的HOMA-IR总体水平较非黑棘皮病组高(女性Q2组P<0.05;男性Q1组P<0.05,Q3-4组P<0.01)。黑棘皮病组的WBISI平均水平总体低于非黑棘皮病对象(女性Q1,4 均P<0.05,Q2P<0.01;男性Q2,4 均P<0.01,Q3P<0.05);女性Q4较Q1明显下降(P<0.05),男性Q1较Q4明显下降(P<0.05)。女性及男性的黑棘皮病组IGI总体较非黑棘皮病组高(女性Q1P<0.05;男性Q3P<0.05)。女性及男性的黑棘皮病组HOMA-β较非黑棘皮病组总体升高,但仅在男性中有明显统计学差异(Q1-4组均P<0.01)。提示黑棘皮病患者较非黑棘皮病患者胰岛素抵抗程度加重、胰岛素敏感性降低,同时胰岛细胞代偿功能也相应增强(表2)。
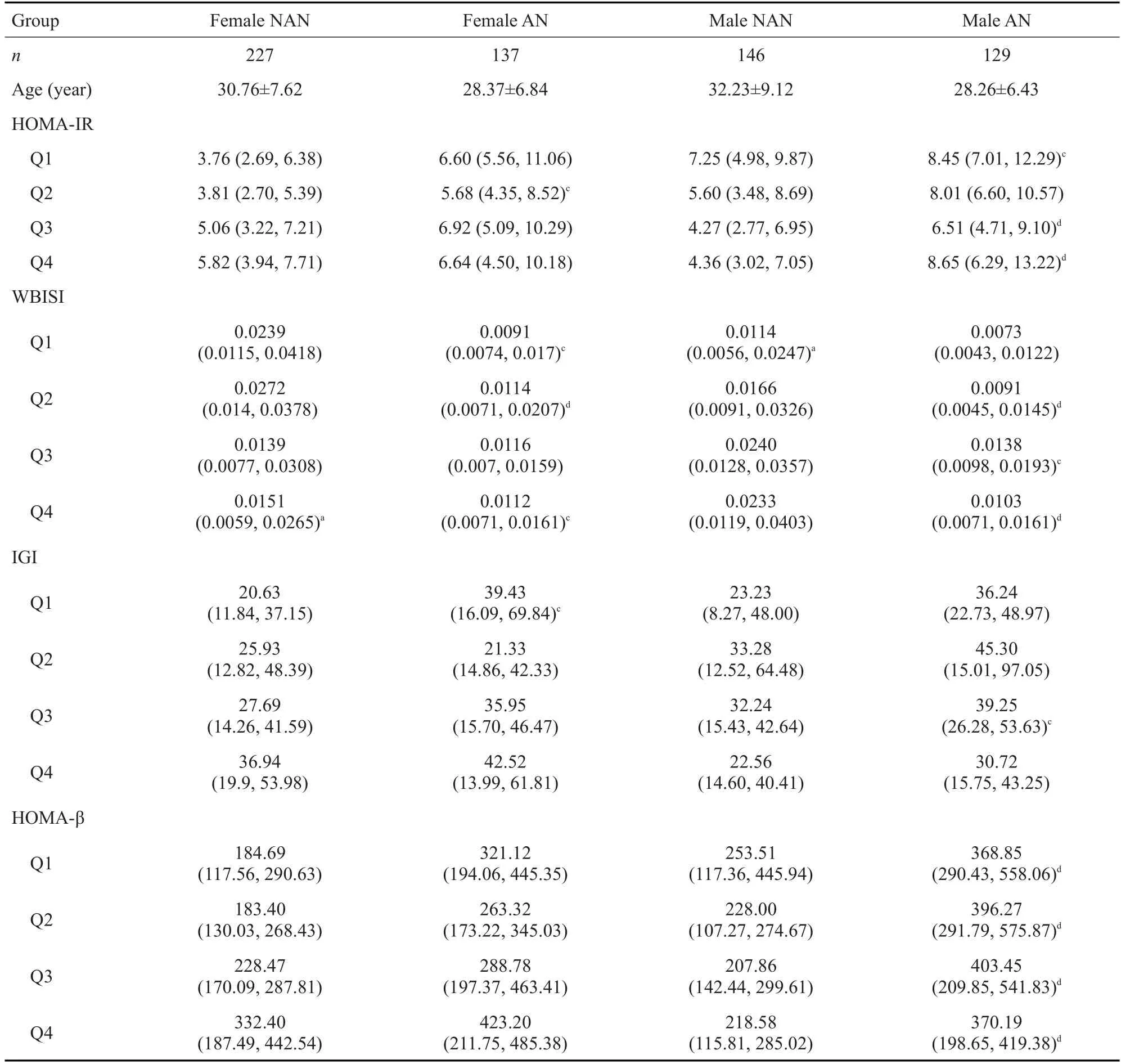
表2 非黑棘皮病及黑棘皮病HOMA-IR、WBISI、IGI、HOMA-β比较Tab.2 Comparison of HOMA-IR,WBISI,IGI and HOMA-β among male and female patients with NAN and AN
3 讨论
本研究发现,不同总睾酮水平时,黑棘皮病人群均较非黑棘皮病人群高胰岛素血症和胰岛素抵抗指数加重。有研究证实,雄激素主要与皮下脂肪的异位分布和肥大脂肪细胞功能异常相关,并不直接受到体脂总量影响,而这可能是雄激素调节胰岛素抵抗的关键因素[11]。女性雄激素水平异常升高可导致胰腺、肝脏、骨骼肌、脂肪等多个组织器官代谢紊乱,加重全身胰岛素抵抗的发生[12],刺激神经元[13]和胰岛β细胞雄激素受体激活,内质网应激加重,胰岛功能紊乱、高胰岛素血症和胰岛素抵抗加重[14]。而男性低睾酮水平时,胰岛细胞中的雄激素受体受到抑制,活性下降,脂肪积聚增加[15],同时减少肌肉中胰岛素敏感性的分子标记表达,增加内脏脂肪组织和肝脏脂肪变性,进一步促进胰岛素抵抗[14]。在雄激素作用下,胰岛素抵抗和高胰岛素血症相互加重、同时相互抑制,从而不断维持循环血糖水平保持相对稳定[16]。本研究发现,非黑棘皮病患者女性在总睾酮达Q4水平时胰岛素水平和AUC-INS出现明显升高、WBISI下降,而非黑棘皮病患者男性总睾酮低至Q1水平,AUC-INS出现明显升高、WBISI下降,推测在非黑棘皮人群中,女性总睾酮Q4水平、男性总睾酮Q1水平对胰岛素的影响更明显。提示总睾酮水平改变在非黑棘皮病患者中可促进高胰岛素血症、降低胰岛素敏感性,但只有总睾酮水平异常达到一定程度时,才会出现胰岛素水平和胰岛素敏感性改变的明显差异。
本研究证实,总睾酮在非黑棘皮肥胖和黑棘皮病患中对胰岛素抵抗的调节存在明显性别差异。女性肥胖引起的高胰岛素血症可以胰岛素和胰岛素样生长因子因其结构、序列和功能的高度同源性,高浓度胰岛素持续升高可抢占胰岛素样生长因子的受体结合部位,抢先与胰岛素样生长因子受体结合,刺激女性卵巢分泌直接使血清性激素结合球蛋白水平下降,从而导致高雄激素血症[17]。黄体生成素和人绒毛膜促性腺激素在高胰岛素状态下也可增加细胞因子水平,促进高雄激素血症的发生[18]。过量雄激素[19,20]。植入双氢睾酮的雌性大鼠,高糖高雄激素刺激胰岛素分泌增加,胰岛氧化应激反应增加了33%,线粒体功能紊乱,胰岛素敏感性下降,胰岛素抵抗稳态模型指数升高[21]。女性肥胖引起的全身性炎症反应和β细胞损伤过程中,循环雄激素水平异常升高、β细胞中过量的雄激素受体激活,可能导致β细胞功能障碍[22]。而肥胖男性雄激素水平明显下降,可能是睾丸间质细胞和脂肪细胞分泌的瘦素和黄体生成素增多导致[23]。在肥胖引起的持续高胰岛素刺激下,雄激素结合球蛋白结合力增强、黄体生成素脉冲幅度增加可导致男性雄激素水平下降[23]。女性循环雄激素升高是非生理性的,这种雄激素异常升高模式激活雄激素受体、促进胰岛素分泌,而男性雄激素则可以是生理性减少,这种接近正常范围的下调模式引起雄激素受体活性下降、促进肥胖和胰岛素抵抗[14]。男性雄激素缺乏和女性雄激素过剩,分别通过雄激素受体缺乏或过量的作用产生代谢功能障碍[24]。这些可能是导致非黑棘皮患者男性和女性总睾酮呈反向改变时,均出现高胰岛素血症加重、胰岛细胞敏感性下降的主要原因。
本研究显示,与非黑棘皮病患者比较,IGI、HOMA-β在黑棘皮病男性和女性中总体水平升高,而HOMA-β在黑棘皮病男性患者的总睾酮各水平均有显著升高,提示黑棘皮病患较非黑棘皮病患者人群胰岛细胞功能增强,但黑棘皮病组人群未发现胰岛素抵抗和胰岛细胞功能指标随着总睾酮水平变化出现的显著性差异。我们推测,这是雄激素的“正负反馈”系统起到了某种调节作用。
去除雄激素受体的雄性小鼠出现迟发的总脂肪量和内脏脂肪量增加,表现出高脂联素血症,脂联素可增强胰岛素敏感性[25]。雄激素水平下降、雌二醇/睾酮比值增加,可有效增加糖尿病雄鼠β细胞数量[26],改善胰岛β细胞功能。基因组学层面的研究发现,雄激素可促进胰岛β细胞分化的关键基因表达,由此促进人诱导多能干细胞来源的胰岛β细胞分化率增加12%到35%[27]。胰岛中存在多种参与雄激素类固醇合成途径的关键蛋白,睾酮可以下调胰腺组织雄激素受体mRNA,提高胰岛素mRNA水平,促进胰岛素mRNA表达,减少胰岛细胞早期凋亡损伤[28]。也有研究认为胰腺中的雄激素可能以自分泌或旁分泌的方式作用于胰岛[29],直接作用于胰岛细胞提高胰岛细胞功能状态。肥胖的脂肪毒性所致的胰岛素抵抗和炎症因子激活也可抑制下丘脑-垂体-性腺轴,而低睾酮则进一步促进内脏脂肪团积累,加剧促性腺激素的抑制、睾丸分泌睾酮减少[30,31]。这表明肥胖/超重的非黑棘皮病及黑棘皮病中雄激素存在正反馈调节作用。
另一方面,随着脂类分解减少、脂肪细胞增生肥大,引起胰岛素抵抗加重和雄激素变化程度增加,雄激素对胰岛细胞功能的某种“负反馈”调整系统也开始启动。有最新研究发现,男性发生胰岛素抵抗时的睾酮下限较胰岛素敏感男性降低了2.29 nmol/L[32]。表明雄激素在一定水平时发生胰岛素抵抗和促进胰岛素细胞功能的作用才更加明显。有分析推测,男性雄激素不足的程度达到中度水平时,加重胰岛素抵抗的作用才明显,而此时胰岛β细胞的分泌功能尚可维持在一定水平;当雄激素不足达到严重程度时,胰岛素抵抗和β细胞功能衰退才比较明显[14]。一项新的研究表明雄激素可通过雄激素受体对胰岛素抵抗产生改善和加重相反作用,这证实了我们的假设。健康男性雄激素受体的CAG少量重复与低体脂肪含量、低血浆胰岛素独立相关[33]。雄激素受体外显子CAG重复序列CAG长于23时,睾酮的增加表现出改善胰岛素抵抗的作用,而长度不足23时,游离睾酮增加可抑制胰岛素敏感性、加重胰岛素抵抗[34]。进一步的研究证实了我们的推论。高糖培养基中INS-1细胞培养72 h,睾酮(浓度0.05~0.5 μg/mL)显著降低INS-1细胞死亡率,但低浓度和高浓度睾酮的却不显示该保护作用[35]。
本研究尚存在一些不足之处,需要进一步扩大样本量,需对于不同年龄阶段、不同体质量人群进一步分层分析,并增加游离睾酮、性激素结合球蛋白等水平,尚需针对性地深入分析和探讨。