天然虾青素治疗肾透明细胞癌的作用机制:基于网络药理学与生物信息学方法
高俊杰,杨丹丹,曹若雪,潘雪珊,夏 俊
蚌埠医学院检验医学院1肿瘤基础研究与临床检验诊断重点实验室,2生化与分子生物学教研室,安徽 蚌埠 233030;3连云港市第二人民医院检验科,江苏 连云港222000
肾透明细胞癌是一种常见的泌尿系统恶性肿瘤,是肾细胞癌的主要亚型,约占肾细胞癌的80%。肾透明细胞癌患者与其他肾癌亚型患者相比,具有更高的肿瘤复发率和转移率[1]。根据癌症统计报告显示全球每年约有140 000例肾透明细胞癌患者死亡[2]。虽然早期肾癌可以通过手术或射频消融的方法治疗,但高达三分之一的患者会出现远处转移,而转移性肾透明细胞癌却是致命的[3]。目前,临床上治疗肾癌的手段主要包括化疗、放疗、INF-α治疗和舒尼替尼靶向治疗等,但是无论是放疗化疗或者靶向治疗均会产生较为明显的副作用导致肾透明细胞癌患者的总体预后不佳[4]。因此,探索潜在生物标志物以及有效的治疗药物将有利于肾透明细胞癌的早期诊断和治疗。
虾青素(3,3′-二羟基-β,β′-胡萝卜素-4,4′-二酮)是一种红色脂溶性类胡萝卜素,相对分子质量为596.84,分子式为C40H52O4。天然虾青素广泛存在于多种微生物和海洋动物中[5],目前市场上商品化的天然虾青素主要来源于雨生红球藻[6]。研究表明天然虾青素具有很强的生物活性,包括抗氧化作用、抗脂质过氧化作用等[7],作为强抗氧化剂,主要表现在其能够淬灭单线态氧,阻止脂质过氧化及清除自由基,可以避免细胞内脂质、核酸和蛋白质等组分免受损伤[8],并且可以通过调节线粒体-凋亡途径来改善氧化应激和抑制细胞凋亡[9]。动物实验、细胞实验与临床观察表明虾青素具有抗肿瘤活性,如虾青素能够抑制口腔癌、皮肤癌、乳腺癌、结直肠癌、肝癌以及神经母细胞瘤等肿瘤细胞的增殖,且具有诱导肿瘤细胞凋亡、抑制肿瘤细胞侵袭等作用[10-14]。小鼠体内实验表明虾青素可以通过增强小鼠的免疫反应继而发挥抗肿瘤作用[15]。但是天然虾青素在防治肾透明细胞癌中的作用未见明确报道。
网络药理学对天然化合物的作用疗效进行深度挖掘而生物信息学可以在肿瘤的研究中发挥巨大作用[16,17]。我们通过网络药理学联合生物信息学的方法从宏观上对天然虾青素抗肾透明细胞癌作用的分子机制与功效网络进行挖掘,用分子对接技术从微观角度对其主要成分与靶点结合程度进行预测,并通过细胞学实验对以上结果进行验证,对天然虾青素治疗肾透明细胞癌的作用机制进行了初步探索。
1 材料和方法
1.1 实验材料和试剂
人肾透明细胞癌细胞系769-P和786-O购自中科院细胞库,RPMI 1640 培养基(Gibco),胰蛋白酶(Biosharp),胎牛血清(Clark),RNA提取试剂盒、逆转录试剂盒、荧光定量PCR试剂盒购自南京(诺唯赞),引物(上海生工),虾青素试剂(MedChemExpress)纯度≥98%,CCK-8试剂盒和BCA试剂盒(上海碧云天),PGF抗体(ABclonal)、β-antin抗体(ABclonal)、羊抗兔IgG二抗(联科生物)。
1.2 细胞培养
肾透明细胞癌细胞系769-P和786-O分别培养在含有10%胎牛血清的RPMI 1640培养基中,并放置在37 ℃含5%CO2的细胞培养箱中培养。
1.3 虾青素作用靶点的收集
利用药物与靶标分析网站(PharmMapper,http://www.lilab-ecust.cn/pharmmapper)[18,19]检索虾青素所含的有效化学成分,获取对应靶点,并利用UniProt数据库(http://www.uniprot.org)将所有靶标转换为官方基因符号。利用Cytoscape3.8.2软件构建虾青素的作用靶点网络。
1.4 肾透明细胞癌相关靶基因提取
TCGA 癌症基因组图谱(https://genomecancer.ucsc.edu/)是一个大型癌症基因组数据库,该数据库是公开开放的,因此无需获得道德委员会的批准。通过检索TCGA数据库下载得到肾透明细胞癌患者mRNA表达数据和临床预后资料,并以logFC>|1|校正后P<0.05,筛选出与肾透明细胞癌密切相关的作用靶点。
1.5 蛋白质相互作用(PPI)网络的构建
将获得的虾青素的作用靶点及肾透明细胞癌疾病靶点通过Ⅴenny2.1进行靶点映射,利用String数据库(https://string-db.org/)获得共同靶点基本数据及其关系数据,利用Cytoscape3.8.2 进行PPI 网络可视化处理。
1.6 GO富集分析
下载ClusterProfiler R功能包对虾青素与肾透明细胞癌的共同靶点进行GO富集分析。获得与虾青素治疗肾透明细胞癌的密切相关生物过程(BP)、细胞组成(CC)和分子功能(MF)。
1.7 分子对接
在Uniprot 和RCSB PDB(RCSB protein data bank,https://www.rcsb.org)中获取靶蛋白的结构文件,Pubchem(https://pubchem.ncbi.nlm.nih.gov)获取主要化合物的三维结构,应用AutoDock软件进行分子对接,应用PyMOL对分子对接结果进行分析和绘图。
1.8 CCK-8增殖实验
将肾透明细胞癌细胞系769-P和786-O以2×104细胞/mL的密度接种在96孔板(每孔100 μL培养基)中。接种后12 h,用DMSO(对照组)和虾青素[50、100、150、200 μmol/L]分别处理肾透明细胞癌细胞,每个浓度包括5个重复。48 h后吸去96孔板中培养基,并在每孔中加入混有10µL CCK-8试剂的100µL完全培养基,培养箱孵育4 h后用酶标仪在450 nm波长下读取吸光度,测量细胞增殖和活力,以上实验重复3次。
1.9 实时荧光定量PCR(RT-qPCR)
使用RNA提取试剂盒提取经过不同浓度天然虾青素处理后的肾透明细胞癌细胞总RNA。PCR中使用的引物如下:PGF正向引物5'-GAACGGCTCGTCAGAGGT G-3',反向引物,5'-ACAGTGCAGATTCTCATCGCC3';GAPDH,正向引物,5′-CAGCCT CAAGATCAGCA-3′,反向引物,5′-TGTGGTCATGAGTCCTTCCA-3′。通过2-ΔΔCt方法计算mRNA相对表达量,实验重复3次。
1.10 蛋白质免疫印记分析
使用胰酶将不同浓度虾青素处理48 h后的肾透明细胞癌细胞从6孔板上消化下来,使用RIPA裂解液在低温条件下裂解细胞获得蛋白质。使用BCA试剂盒测定蛋白质浓度,使用聚丙烯酰胺凝胶电泳分离变性后的蛋白,将分离胶上的蛋白转移到PⅤDF膜上,将带有蛋白质的PⅤDF膜放入5%脱脂奶粉中封闭处理2 h。将封闭好的膜条按照分子量的不同进行分割然后置于不同抗体中4 ℃冰箱摇床上过夜。第2天,使用TBST洗去一抗后在室温条件下继续孵育相对应的二抗2 h。使用TBST洗去未结合的二抗后在膜条上滴加曝光液进行免疫印迹反应。
1.11 统计学分析
本章所有实验均含有3个生物学重复,本章的数据均为3 个生物学重复的平均值。采用GraphPad prism8.0软件对实验数据进行统计学分析,所用数据用均数±标准差表示。两组之间的比较采用t检验,多组之间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 虾青素的有效作用靶点
通过PharmMapper数据库检索和筛选并去重后共得到虾青素的有效作用靶点278个(图1)。以虾青素为中心,按照虾青素与靶点结合系数由高到低分为6个不同颜色的圈图,内圈结合系数评分最高,外圈结合系数评分最低。
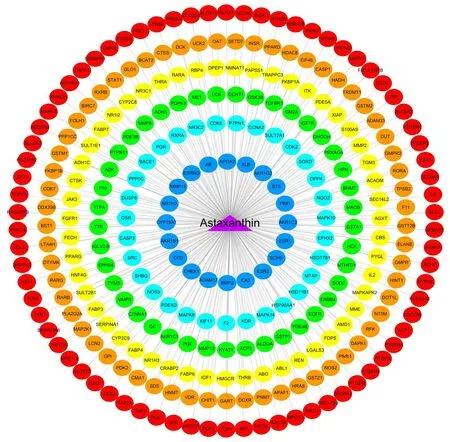
图1 虾青素-靶点网络图Fig.1 Astaxanthin-target network.
2.2 肾透明细胞癌疾病靶点的筛选
从TCGA数据库中检索得到与肾透明细胞癌密切相关的人类靶点1590个(图2)。其中以红色圆点表示与肾透明细胞癌发生发展呈正相关的靶基因共1081个,以绿色圆点表示与肾透明细胞癌发生发展呈负相关的靶基因共509个。
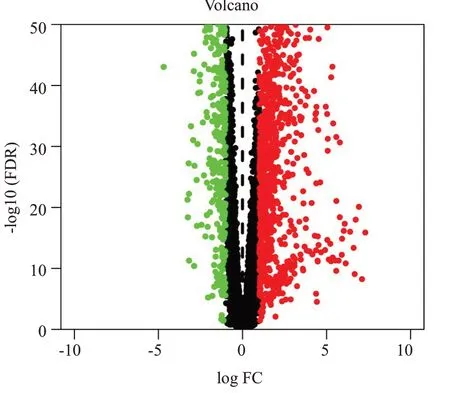
图2 肾透明细胞癌密切相关靶点火山图Fig.2 Volcano map of closely related targets of renal clear cell carcinoma.
2.3 PPI 网络构建
对278个天然虾青素作用靶点和1081个肾透明细胞癌相关靶点使用Ⅴenny2.1取交集,获得33个天然虾青素治疗肾透明细胞癌的预测靶点(图3)。以节点大小及颜色反映靶点的度值大小,边的粗细表示节点间关联分值的大小,绘制PPI网络图(图4)。通过PPI筛选出天然虾青素治疗肾透明细胞癌的核心靶点7个,分别为表皮生长因子受体(EGFR)、果糖二磷酸A(ALDOA)、激酶插入域受体(KDR)、组织蛋白酶S(CTSS)、Src家族酪氨酸激酶(HCK)、胎盘生长因子(PGF)和受体酪氨酸激酶(MET)。
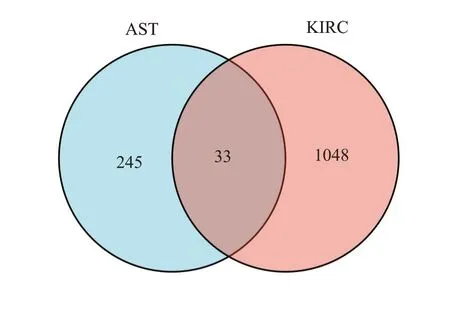
图3 虾青素-肾透明细胞癌有效作用靶点Ⅴenn图Fig.3 Venn diagram of effective targets of astaxanthin-renal clear cell carcinoma.

图4 虾青素-肾透明细胞癌的蛋白间相互作用(PPI)网络图Fig.4 Protein-protein interaction(PPI)network of astaxanthin and renal clear cell carcinoma.
2.4 GO功能富集分析
GO富集分析表明,虾青素治疗肾透明细胞癌的33个靶点主要涉及117个生物学过程,38个细胞组分,68个分子功能(图5)。其中生物学过程主要包括自身磷酸化、细胞趋化、炎症反应。细胞组分主要集中在囊腔、分泌颗粒腔、胞质泡腔等。分子功能方面,涉及蛋白质酪氨酸激酶活性、跨膜受体蛋白激酶活性、药物结合以及蛋白磷酸酶结合。

图5 GO富集分析Fig.5 GO enrichment analysis.
2.5 核心靶基因筛选
在肾透明细胞癌中对EGFR、ALDOA、KDR、CTSS、HCK、PGF和MET这7个核心靶点进行表达差异筛选和生存分析筛选,结果显示7个靶点在肿瘤组中表达均增高,其中PGF表达增高最为显著(图6A)。生存分析筛选得出KDR和PGF与肾透明细胞癌患者生存时间密切相关,其中高表达PGF的患者生存时间要短于低表达PGF患者(图6B)。
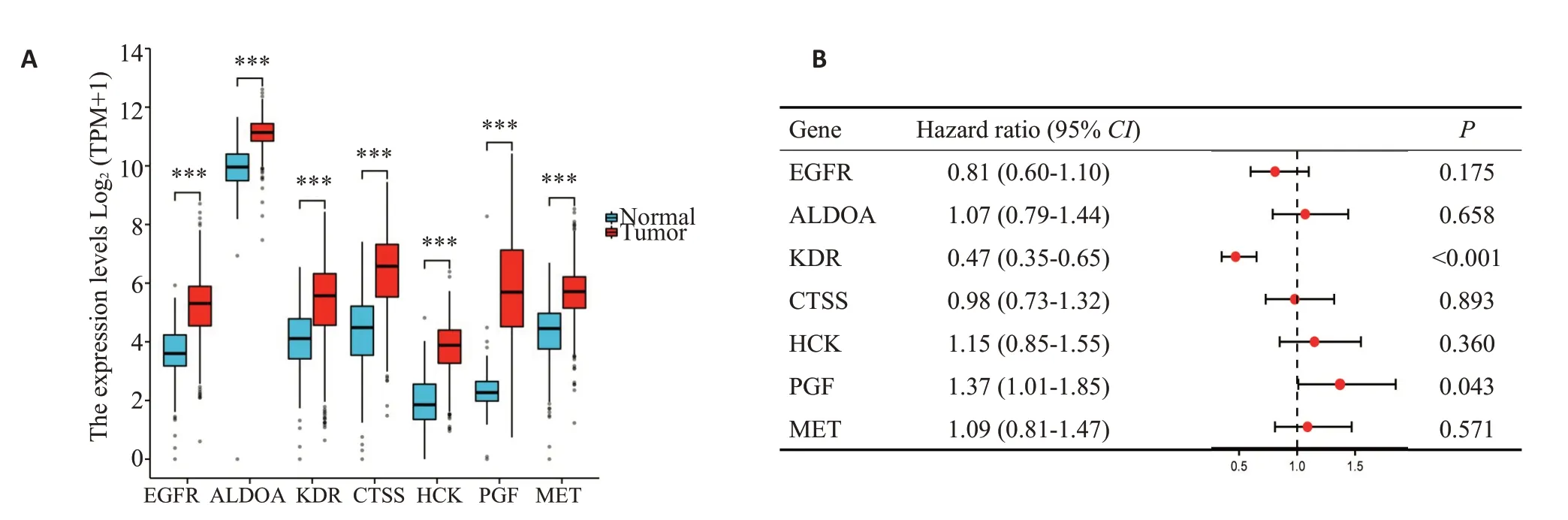
图6 核心靶基因在肾透明细胞癌以及癌旁组织中的相对表达量以及生存分析森林图Fig.6 Relative expression and survival analysis of the core target genes in renal clear cell carcinoma (KIRC) and adjacent tissues.A:Expressions of EGFR,ALDOA,KDR,CTSS,HCK,PGF and MET mRNA in KIRC and normal tissues (Tumor=531,Normal=100.***P<0.001 Tumor vs Normal).B:Survival analysis forest map (HR>1, P<0.05 indicates a negative correlation with survival time;HR<1,P<0.05 indicates a positive correlation with survival time).
2.6 PGF在肾透明细胞癌中表达增高并与不良预后相关
生物信息学结果显示PGF在肾透明细胞癌肿瘤组织中表达增高(P<0.001,图7A)。在配对标本中,肿瘤组的PGF 表达明显高于邻近癌旁组织(P<0.001,图7B)。通过分析PGF在人类33种肿瘤中表达情况发现PGF在大部分肿瘤中表达增高,其中在肾透明细胞癌、胰腺癌、肺癌以及胶质瘤中表达增高更为显著(图7C)。生存分析显示,高表达PGF的患者比低表达PGF患者的总体生存期更短(HR=1.37,95%可信区间:1.01-1.85,P=0.043;图8A)。诊断性ROC曲线显示PGF在肾透明细胞癌的AUC 曲线下面积为0.951(95%CI:0.924-0.977)(图8B),而从患者临床特征与PGF表达关系中可以得出PGF主要与肾透明细胞癌的T(原发肿瘤的范围)分期相关(表1)。
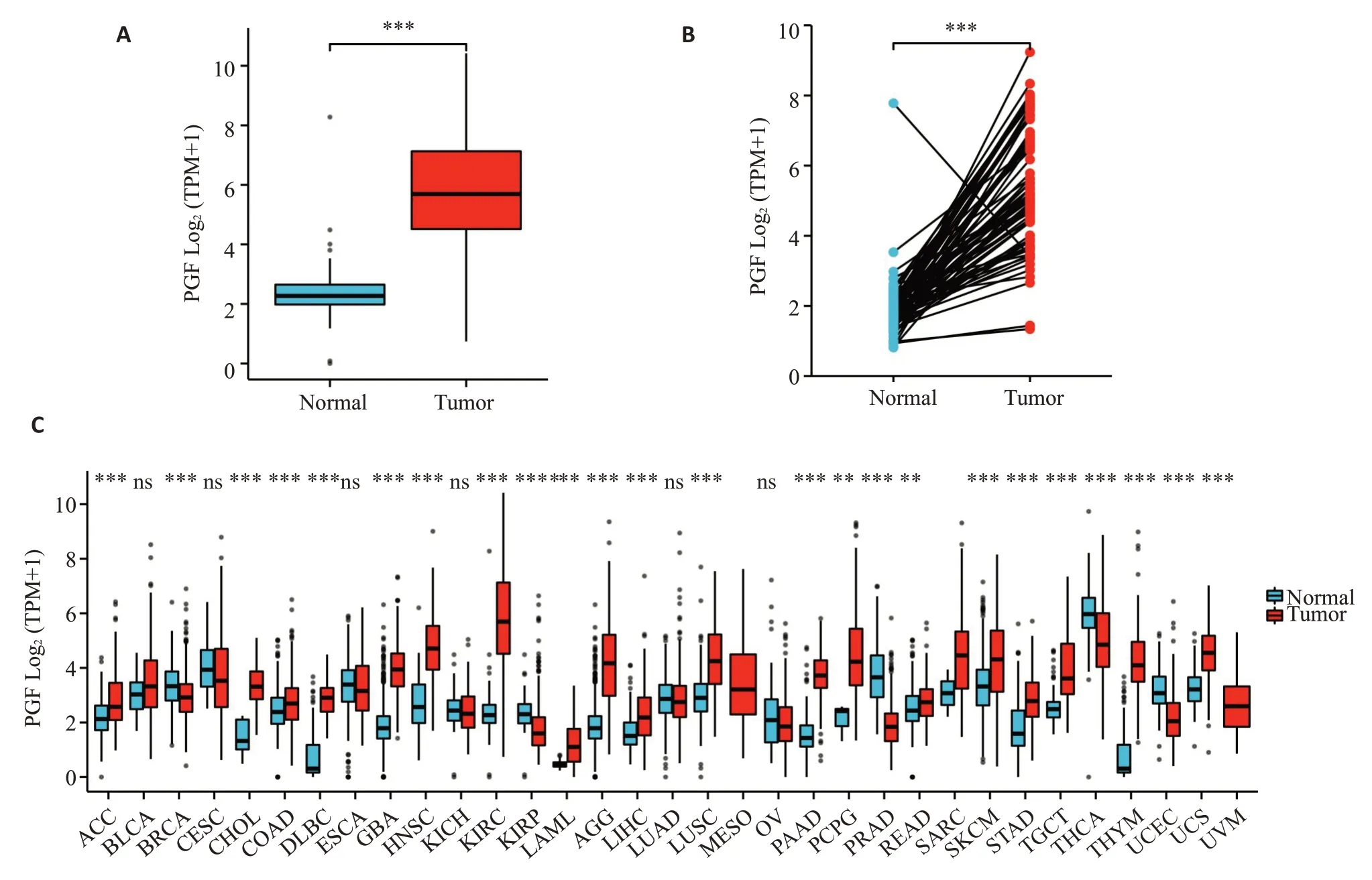
图7 肾透明细胞癌以及癌旁组织中PGF的相对表达量Fig.7 Relative expression of PGF in KIRC and adjacent tissues.A:Expression level of PGF in KIRC and normal tissues(Tumor=531,Normal=100,***P<0.001).B:Expression of PGF in KIRC and paired tissues(Tumor=72,Normal=72.***P<0.001).C:PGF expression levels of different tumor types in TCGA database.
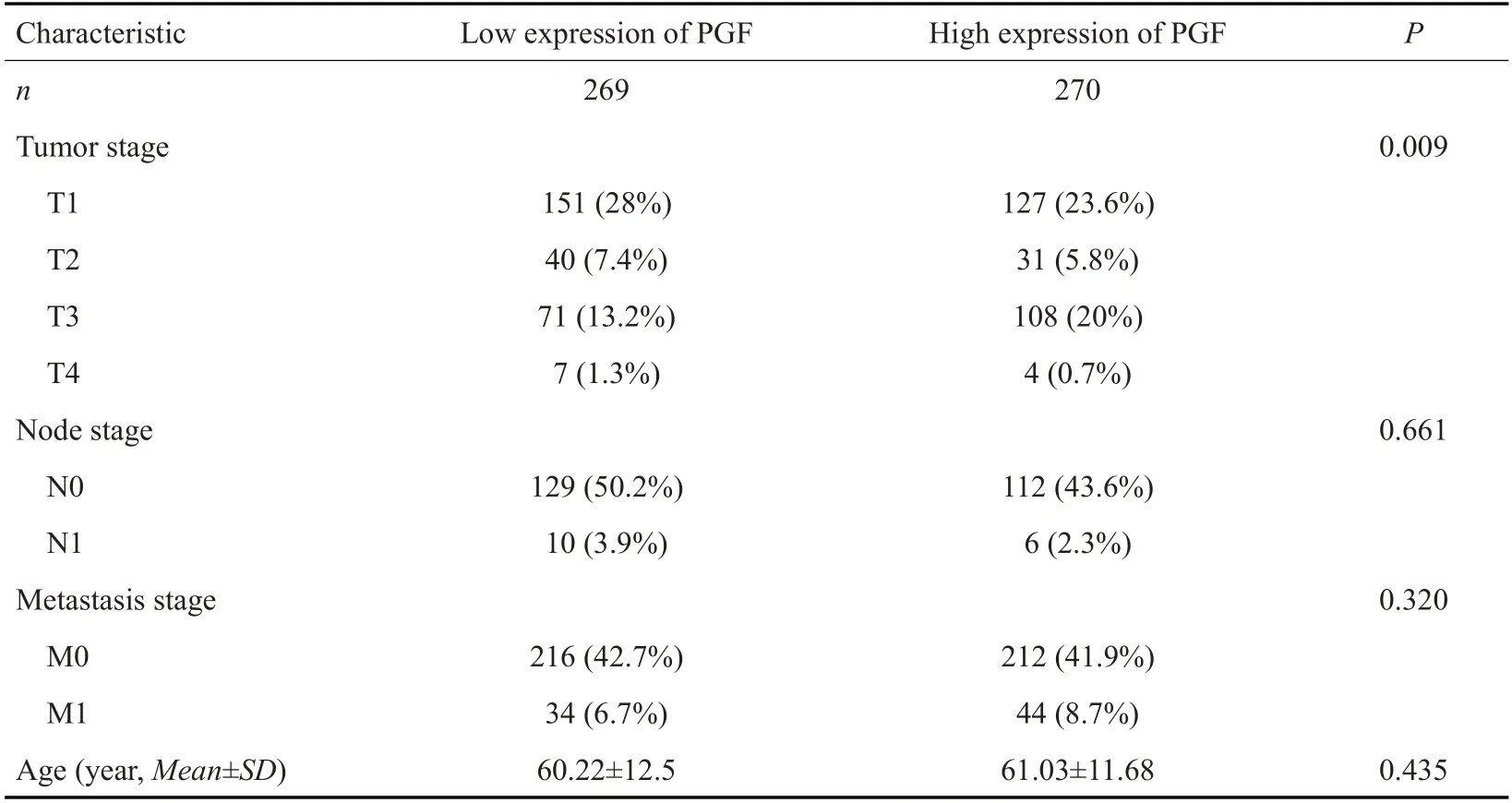
表1 TCGA中PGF低和高表达的KIRC患者的人数统计和临床特征Tab.1 Clinical characteristics of KIRC patients with low and high PGF expressions in TCGA

图8 PGF在评估肾透明细胞癌患者预后以及诊断性价值Fig.8 Prognostic and diagnostic value of PGF for renal clear cell carcinoma.A:Overall survival curve based on TCGA data.B:Diagnostic ROC curve.
2.7 分子对接
将虾青素的活性成分与胎盘生长因子蛋白(PGF)进行分子对接验证,得到PGF与虾青素分子对接结果为-5.43 kcal/mol(图9)。
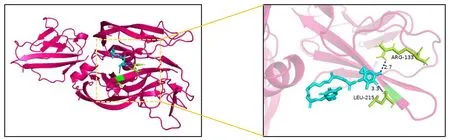
图9 虾青素与PGF分子对接模式图Fig.9 Docking mode of astaxanthin and PGF molecule.
2.8 虾青素抑制肾透明细胞癌的增殖
肾透明细胞癌细胞系769-P 和786-O 分别用DMSO和虾青素(50、100、150、200 µmol/L)处理48 h。CCK-8结果显示当天然虾青素浓度为50µmol/L时即可显著抑制769-P和786-O细胞的增殖,并且随着天然虾青素浓度的升高抑制效果越明显(图10)。
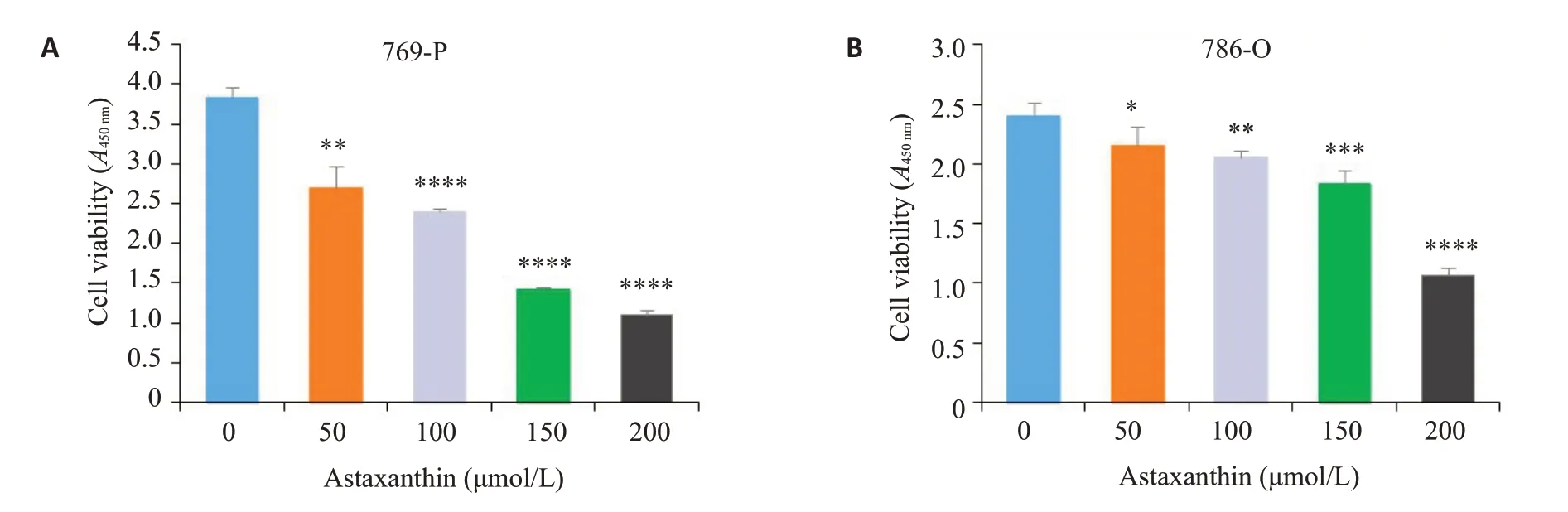
图10 肾透明细胞癌细胞株在不同浓度虾青素作用下增殖能力Fig.10 Effect of different concentrations of astaxanthin on proliferation of renal clear cell carcinoma cell lines 769-p(A)and 786-O(B)(*P<0.05,**P<0.01,***P<0.001,****P<0.0001 vs 0 μmol/L).
2.9 虾青素可以抑制肾透明细胞癌中PGF的表达
利用RT-qPCR技术检测经过不同浓度虾青素处理后肾透明细胞癌细胞系中PGF mRNA的表达水平(图11A、B)。结果显示经过不同浓度虾青素处理后肾透明细胞癌细胞系769-P和786-O细胞中PGF mRNA的表达与对照组(DMSO处理)相比均有下降(P<0.01),并且随着虾青素浓度的提高PGF mRNA的表达下降更为显著,表现出了一定的剂量依赖性。Western blot技术检测经过不同浓度虾青素处理后肾透明细胞癌细胞系中PGF蛋白的表达水平(图12A、B)结果显示当虾青素浓度为50µmol/L时对PGF蛋白的表达没有显著影响,而当虾青素浓度继续升高时,PGF蛋白表达受到了明显的抑制(P<0.05),且随着天然虾青素浓度升高PGF蛋白表达降低越明显。

图11 不同浓度虾青素处理后肾透明细胞癌细胞中PGF的mRNA表达量Fig.11 Effect of different concentrations of astaxanthin on PGF mRNA expression in renal clear cell carcinoma cell lines 769-p(A)and 786-O(B)detected using RT-qPCR(**P<0.01,****P<0.0001 vs 0 μmol/L).

图12 不同浓度虾青素处理后肾透明细胞癌细胞中PGF的蛋白表达量Fig.12 Effect of different concentrations of astaxanthin on PGF protein expression in renal clear cell carcinoma cell lines 786-O(A)and 769-p(B)detected using Western blotting(*P<0.05,**P<0.01,***P<0.001 vs 0 μmol/L).
3 讨论
临床上通常将肾癌分为4种类型,分别为肾透明细胞型肾癌、肾颗粒细胞型肾癌、肾混合细胞型肾癌、肾未分化细胞型肾癌。其中肾透明细胞型肾癌占了肾癌的70%~80%。虽然肾透明细胞癌是恶性程度最低的一种肾癌,但是肾透明细胞癌通过血道途径转移的机率极高,约有60%的病人存在转移可能。近年来,随着高通量测序技术的迅猛发展,与肾透明细胞癌紧密相关的测序结果越来越多,为早期诊断和治疗肾透明细胞癌提供了新的方法和思路。因此,在本研究中,我们从TCGA数据库中提取基因表达数据,随后进行了PPI网络分析、差异分析、生存分析等明确了单基因PGF在肾透明细胞癌的发生发展中可能存在一定作用。
本研究共发现了1081个与肾透明细胞癌密切相关的差异基因,并筛选出了EGFR、ALDOA、KDR、CTSS、HCK、PGF和MET 7个核心基因。众多研究表明肾透明细胞癌与EGFR、ALDOA、KDR、CTSS、HCK及MET等基因相关[20-25]。这也表明虾青素可能是通过作用以上靶点从而对肾透明细胞癌发挥直接或者间接的调控作用。而PGF作为一种与血管内皮生长因子同源的生长因子,它可能也与肾透明细胞癌的发生发展存在一定关系,当使用PGF抑制剂TB403抑制PGF的表达后,肾透明癌的增殖能力受到了抑制[26],PGF也可以促进血管生成和内皮细胞生长,并刺激他们的增殖和迁移,同时PGF可以与受体FLT1/ⅤEGFR-1结合促进肿瘤细胞的生长[27]。研究发现,PGF在肾透明细胞癌患者的血清中表达升高,与ⅤEGF的表达呈正相关,表明其可以促进肿瘤细胞的增殖[28]。本研究表明,PGF在肾透明细胞癌中表达增高,且高表达PGF的患者有着更差的预后同时ROC曲线也表明PGF表达的高低对肾透明细胞癌的诊断具有一定预测价值。
大量研究数据表明天然虾青素在多种肿瘤如乳腺癌[29]、宫颈癌[30]、结肠癌[31]、食管癌[32]、胃癌[33]、肝癌[34]、白血病[35]、肺癌[36]、口腔鳞状细胞癌[37]、前列腺癌[38]、皮肤癌[39]和膀胱癌[40]中发挥重要抑制作用,同时对糖尿病、心血管疾病、神经退行性疾病[41,42]等多种疾病具有潜在作用,它的抗氧化特性可以用于抵抗病变细胞的氧化损伤,调节炎症介质的释放[43]。我们在前期工作的基础上,利用网络药理学和生物信息学研究虾青素治疗肾透明细胞癌的分子机制。GO富集分析表明虾青素治疗肾透明细胞癌的关键靶点主要涉及自身磷酸化、细胞趋化、炎症反应等生物学过程。通过CCK-8实验我们发现不同浓度的虾青素作用于肾透明细胞癌细胞株均会有一定的抑制增殖的作用,并且随着药物浓度的增高,这种抑制效果越明显。紧接着我们利用生物信息学的手段筛选出了1 个虾青素治疗肾透明细胞癌的核心靶点PGF,利用分子对接技术发现虾青素分子能和受体蛋白PGF发生结合的结合能为-5.43 kcal/mol,若结合能<0,表明配体分子能和受体蛋白自发地结合,结合能<-5.0 kcal/mol,表明其结合性好。同时我们利用RT-qPCR验证了虾青素可以降低肾透明细胞癌中PGF的表达,而且这种抑制效果也是随着虾青素浓度的增高而增强。以上结果表明,虾青素可以抑制肾透明细胞癌的增殖并且抑制肾透明细胞癌中PGF的表达。当然虾青素是通过什么机制去影响了肾透明细胞癌的恶性生物学行为以及PGF的表达还需要通过后续的研究去证明。
本研究采用网络药理学和生物信息学研究思路,挖掘、分析虾青素多靶点防治肾透明细胞癌可能的作用机制,聚焦虾青素重要分子靶点PGF,从生物信息学角度入手分析了PGF可能作为一个癌基因在肾透明细胞癌的发生发展中发挥作用,同时也验证了虾青素能够影响PGF的表达,为后续深入研究可能的作用机制做出了铺垫,也为探索虾青素防治肾透明细胞癌的研究提供了新的思路。