亚健康状态人群肠道菌群结构明显失调:基于某医院150例护理人员分析
张星星,蔡文文,廖生武,何璇昱,杨秋玉,白 杨,阮伟清
南方医科大学1南方医院惠侨医疗中心,2护理学院,3南方医院门急诊片区,4南方医院消化内科,广东 广州510515
肠道菌群(GM)及其代谢产物在维持人体健康稳态中起至关重要的作用[1,2],近年来,亚健康状态与肠道菌群失衡的关系越来越受到关注。亚健康状态(SHS)是人体处于健康和疾病之间的一种状态[3,4],常伴有食欲不振、腹部不适、便溏便秘等胃肠道症状[5,6],慢性疲劳综合征(CFS)为其中一种亚型[7]。Sheedy等[8]基于细胞培养的技术,观察到CFS人群肠道中的革兰氏阳性需氧菌明显占优势,尤其是肠球菌和链球菌。Fremont等[9]研究来自比利时和挪威的CFS组和健康对照组肠道菌群的差异,发现CFS组的类杆菌属(Bacteroides)减少。Shukla等[10]收集了CFS组和对照组的运动前、运动后15 min、48 h、72 h的症状报告、血液和粪便标本,发现CFS人群主要菌群的相对丰度增加更显著,血液中细菌清除时间延长。
上述研究均提供了亚健康状态人群肠道菌群失调的证据,但由于既往研究的纳入标准、测序技术的不同,导致亚健康状态人群具体何种肠道菌群改变及变化的特点尚无定论[11,12]。近年来,16S rRNA测序技术的发展,弥补了传统鉴定方法无法准确鉴定细菌种属的缺点,已广泛用于肠道菌群的研究[13],但未进一步明确何种肠道菌群失调在亚健康状态发生发展中起着重要作用。在本研究中,我们运用16S rRNA测序技术,比较亚健康人群和健康人群的菌群构成差异,明确其差异物种。
1 资料和方法
1.1 临床资料
1.1.1 一般资料 选取2020年11月~2021年5月南方医科大学南方医院工作的护理人员150例作为研究对象,其中亚健康人群75例为亚健康组(SHS组),男性6例,女性69例,年龄20~40岁;选择75例同期健康人群作为健康对照组(H 组),男性2 例,女性73 例;年龄21~40岁。组间年龄、性别、BMI、吸烟、饮酒差异无统计学意义(P均>0.05),SHS 组亚健康总分明显高于H 组(P<0.05)。由于抗生素和激素对肠道菌群影响较大[14],要求所有志愿者在采样前2月均未接受过任何抗生素和激素治疗。所有参与志愿者均已签署实验知情同意书。此项研究通过医院伦理委员会批准,所有纳入的研究对象均签署知情同意书(伦理编号:NFEC-2020-278)。
1.1.2 纳入标准 亚健康组纳入标准:(1)年龄在20~40岁,性别不限;(2)亚健康的判定标准参照《亚健康的中医临床研究指导原则(试行)》[3],满足以下条件:入组持续3个月以上反复出现的不适状态或适应能力显着减退,但能维持正常工作;无重大器官器质性疾病及精神心理疾病;尽管具有明确的非重大器官器质性疾病或精神心理疾病诊断但无需用药维持,且与目前不适状态或适应能力的减退无因果联系;(3)亚健康评定量表诊断为亚健康状态;(4)研究对象同意参加本次研究。健康组纳入标准:(1)年龄20~40岁,性别不限;(2)无重大器官器质性疾病及精神心理疾病;(3)尽管具有明确的非重大器官器质性疾病或精神心理疾病诊断但无需用药维持;(4)亚健康评定量表诊断为健康状态;(5)研究对象同意参加本次研究。
1.1.3 排除标准(1)入组前2月内曾使用抗生素、微生态制剂者;(2)过敏体质或对药物过敏者;(3)妊娠或准备妊娠、哺乳期妇女;(4)怀疑或确有酒精、药物滥用史者;(5)有消化系统疾病病史及手术史者;(6)有高血压、糖尿病、冠心病、乙肝、肺结核病史者;(7)认知功能障碍不能给予充分知情同意者。
1.2 调查工具
1.2.1 一般情况调查问卷 调查内容包括年龄、性别、BMI、是否吸烟、饮酒。
1.2.2 亚健康评定量表[15]该量表包括3个子量表(生理亚健康、心理亚健康和社会亚健康)、9个维度(精力、身体运动功能、社会适应、正向情绪、社会资源与社会支持、认知功能、心理症状、器官功能、身体症状)和39个条目,其中正向计分20条,反向计分19条。采用Likert 5级评分,总分为0~100分,各维度、子量表及总量表得分越高,表示健康状况越好。计算公式:转化分=(原始分-理论最低分)/(理论最高分-理论最低分)×100。排除疾病人群后,当生理子量表低于阈值68,或心理子量表低于阈值67,或社会子量表低于阈值67时,被诊断为亚健康状态。该量表Cronbach's α系数为0.917,重测信度为0.644。
1.3 标本收集
本研究采取病例对照研究的方法,根据纳入、排除标准招募调查对象,首先由2名课题组成员(经过量表评定一致性培训)对调查对象进行亚健康评定量表评定,并收集调查对象的一般资料,当场回收问卷,后期由双人录入电脑中。所有研究对象在清晨(6:00-9:00)用粪便采集管(IGE)收集中间段没有接触空气和地面部分新鲜的粪便标本2~3 g,按操作说明混匀后在15分钟内将装有样品的采集管置于-80 ℃冰箱保存。
1.4 DNA提取和PCR扩增
基因组DNA 通过E.Z.N.A.®DNA Kit(Omega Bio-tek,Norcross,GA,U.S.)试剂盒按照说明书进行提取。使用紫外分光光度计(NanoDrop 2000,Thermo Scientific)检测DNA的浓度和纯度,用2%琼脂糖凝胶电泳鉴定DNA完整性。使用引物515F(5'-GTGCCA GCMGCCGCGGTAA-3')和806R6(5'-GGACTACⅤS GGGTATCT AAT-3')扩增细菌16S rRNA基因的Ⅴ3-Ⅴ4高可变区。使用qiagen公司提供的胶回收试剂盒回收产物,Tris-HCl 洗脱,2%琼脂糖电泳检测。
1.5 文库构建和上机测序
使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq6000进行上机测序。
1.6 生物信息分析
样本委托北京诺禾致源股技术有限公司进行高通量测序,根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列后使用FLASH软件(Ⅴ1.2.7)对每个样本的reads进行拼接,得到原始Tags数据(Raw Tags)。拼接得到的Raw Tags,需要经过严格的过滤处理得到高质量的Tags数据(Clean Tags)。参照Qiime(Ⅴ1.9.1)的Tags质量控制流程,进行如下操作:a)Tags截取:将Raw Tags从连续低质量值(默认质量阈值为≤19)碱基数达到设定长度(默认长度值为3)的第一个低质量碱基位点截断;b)Tags长度过滤:Tags经过截取后得到的Tags数据集,进一步过滤掉其中连续高质量碱基长度小于Tags长度75%的Tags。经过以上处理后得到的Tags需要进行去除嵌合体序列的处理,Tags序列通过与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据。通过USEARCH软件对序列进行聚类,将序列相似度≥97%的序列归为同一OTU,然后通过OTU与数据库比对,对OTU进行物种注释。α多样性分析用Chao1指数和Shannon指数来评估。β多样性用基于Weighted Unifrac 距离的PCoA 分析。基于LEfSe方法分析,LDA最小值设为4,进行2组之间的比较,寻找在2组之间具有显著差异的菌属。
1.7 统计学方法
采用SPSS 23.0统计学软件进行数据分析,计数资料采用频数和构成比描述,组间比较采用卡方检验;正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;偏态分布的计量资料,采用中位数和四分位数M(P25,P75)描述,组间比较采用Mann-WhitneyU检验。检验水准α=0.05。
2 结果
2.1 亚健康组与健康组一般情况比较
2组年龄、性别、BMI、吸烟、饮酒差异无统计学意义(P均>0.05),SHS组亚健康总分明显高于H组(P<0.05)(表1)。
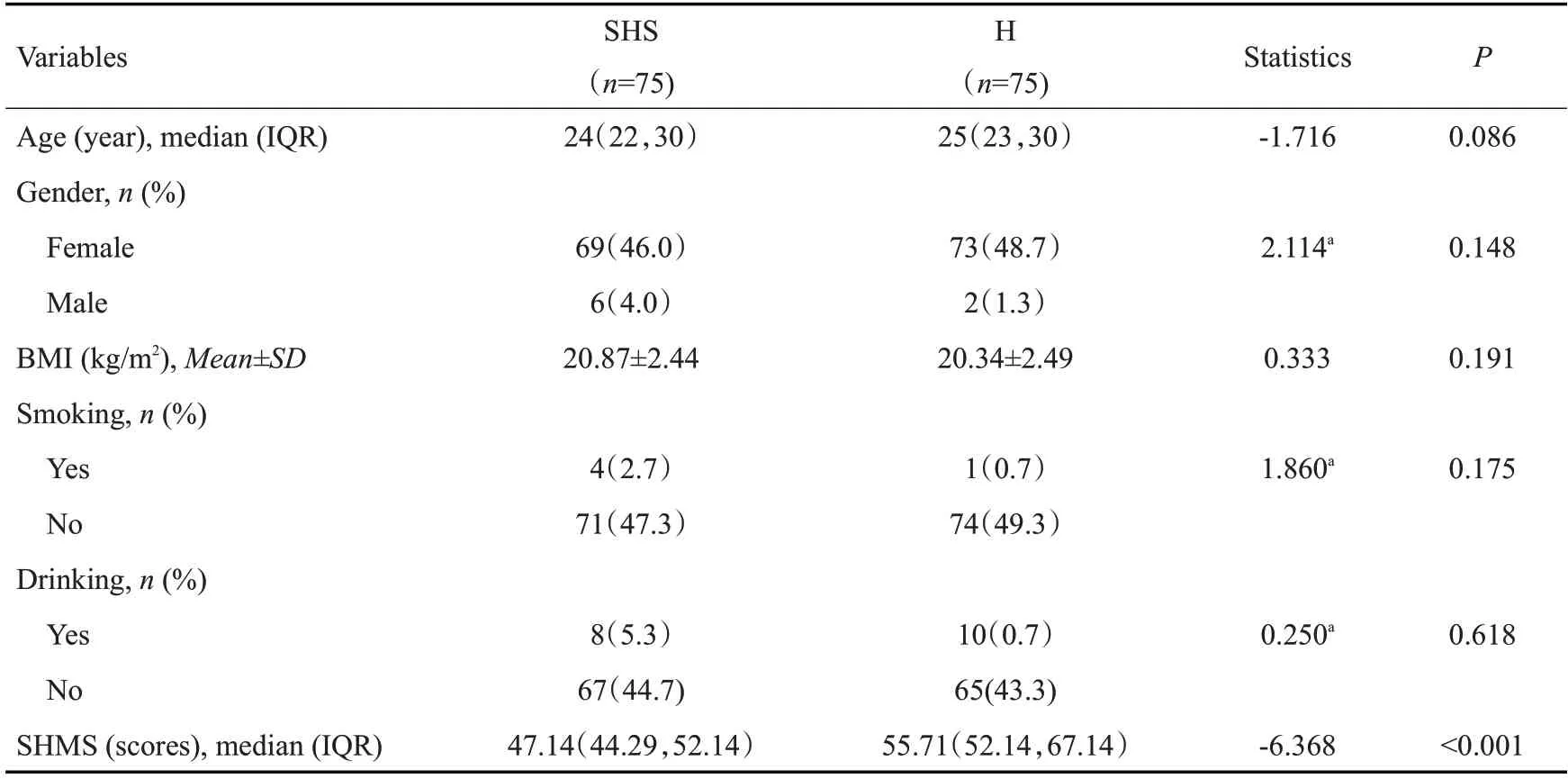
表1 亚健康组与健康组一般情况比较Tab.1 Demographic and clinical characteristics of sub-health status group and control group
2.2 亚健康组与健康组肠道菌群微生物多样性分析
2.2.1 测序数据 2组150个样本共获得平均每样品测得96 391 条tags。以97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units),共得到3616 个OTUs。SHS组独有494 个OTU,H组独有1784 个OTU,两组共有1333个OTU(图1)。
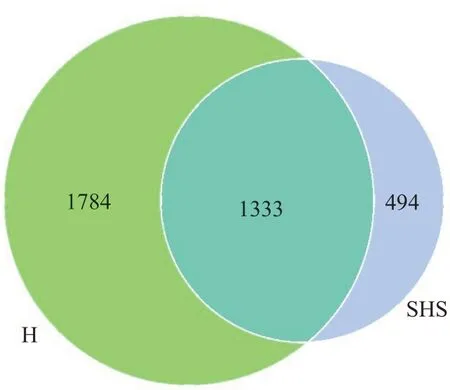
图1 SHS组与H组Ⅴenn图Fig.1 Venn diagram of OTU in the two groups.H:Healthy group;SHS:Sub-health status group.
2.2.2 α多样性比较 等级聚类曲线(Rank Abundance曲线)结果表明2组肠道菌群的群落丰度较高,均匀度较好(图2)。物种累积箱形结果显示箱形图位置趋于平缓(图3),当前样本量足够,现有的测序数据量可以反映样本中菌群的多样性信息。本研究中菌群丰度用Chao1指数来衡量;菌群多样性用Shannon 指数来衡量,Shannon指数越大,样品中的物种多样性越高。结果显示,SHS组的Chao1指数与H组之间差异无统计学意义(P=0.619,图4),SHS组的Shannon指数升高且2组之间差异有统计学意义(P<0.001,图5)。

图2 等级聚类曲线Fig.2 Rank abundance curves of the two groups.
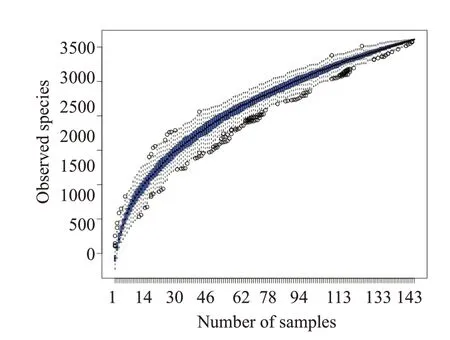
图3 物种累积箱型图Fig.3 Species accumulation boxplots.

图4 Chao1指数组间差异箱形图Fig.4 Boxplot of Chao1 index in the two groups.
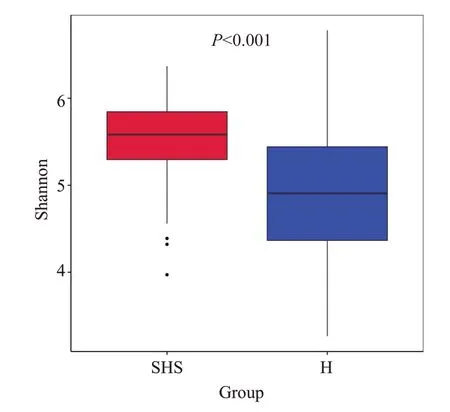
图5 Shannon指数组间差异箱形图Fig.5 Boxplot of Shannon index in the two groups.
2.2.3 β多样性比较 主坐标分析PCoA 图显示,除个别样本存在偏差,亚健康组和健康组基本呈现在不同区域(图6)。经过Anosim相似性分析发现,2组间群落结构呈现显著区别(R=0.227,P=0.001)。
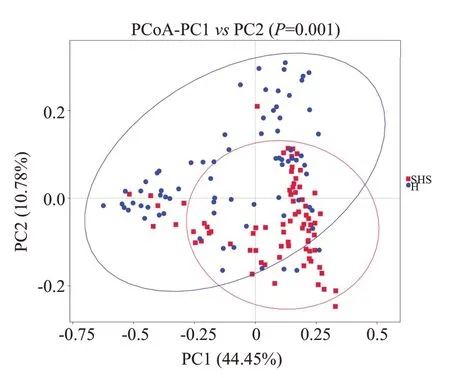
图6 基于Unweighted Unifrac距离的PCoA分析Fig.6 PCoA analysis based on Unweighted Unifrac distance.
2.2.4 肠道菌群结构分析 在门水平,SHS组中丰度最高的4 个门依次为:Firmicutes(59.5%)、Bacteroidota(31.9%)、Actinobacteriota(4.4%),变形菌门占2.5%。而HS组中,Bacteroidota(48.4%)、Firmicutes(41.1%)、变形菌门占5.3%、Actinobacteriota(2.5%)(图7)。
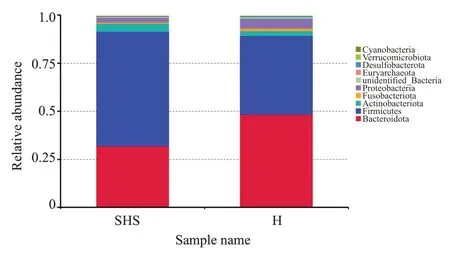
图7 门水平上2组的相对丰度Fig.7 Relative abundance of bacterial phyla in the two groups.
在属水平上,H组中丰度最高的依次是:Prevotella(25.6%)、Bacteroides(19.5%)、Faecalibacterium(12.2%)、Blautia(3.3%)、Megamonas(2.1%)、Lachnospira(1.8%)、Bifidobacterium(1.8% )、Alloprevotella(1.3% )、Fusobacterium(1.3%)、Romboutsia(0.9%)。而在SHS组中丰度最高的依次是:Bacteroides(16.4%)、Prevotella(13.5%)、Blautia(11.8%)、Faecalibacterium(10.8%)、Bifidobacterium(3.6%)、Romboutsia(1.4%)、Lachnospira(1.3%)、Megamonas(0.6%)、Fusobacterium(0.5%)、Alloprevotella(0.3%)(图8)。
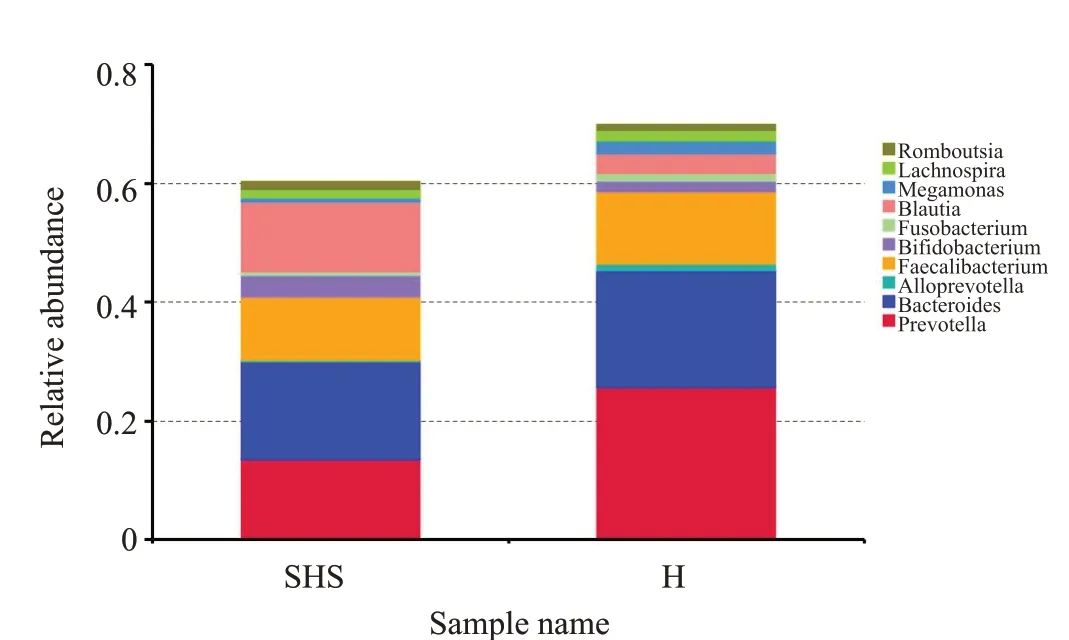
图8 属水平上2组的相对丰度Fig.8 Relative abundance of bacterial genera in the two groups.
2.2.5 肠道菌群差异分析 在LDA值分布柱状图中可以看出,SHS组的优势物种为厚壁菌门,H组的优势物种为拟杆菌门。通过LEfSe分析得出两组在4个门3个纲3个目3个科3个属的相对丰度差异有统计学意义(P<0.05,图9)。
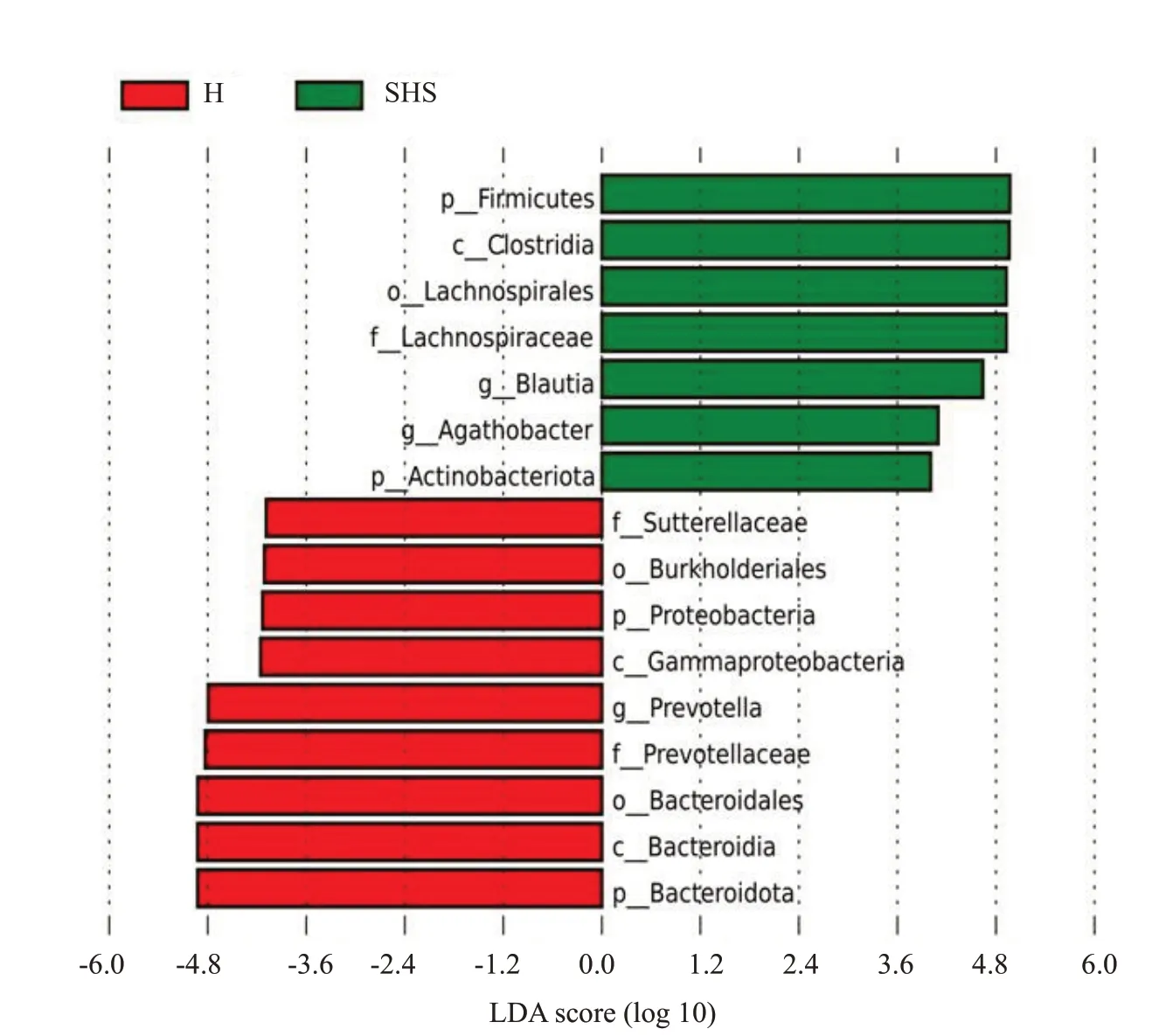
图9 LDA分布柱状图Fig.9 Histogram of LDA score distribution.
3 讨论
本研究运用16S rRNA测序技术,对比亚健康组与健康组之间的肠道菌群,发现了亚健康组人群肠道菌群的变化特点,与健康组相比,亚健康组人群的肠道菌群组成结构和多样性上均存在显著差异。结果显示,在α多样性分析的Shannon指数上,SHS组较H组明显升高,且β多样性分析也进一步显示2组间肠道菌群组成结构上存在差异,表明亚健康人群肠道菌群多样性增加,与健康人群相比结构失衡。
本研究发现SHS组的Shannon指数较H组明显升高,这一结果与Armstrong[16]的研究结果相反,后者通过CFS组和健康组的肠道菌群对比分析,发现CFS组的物种多样性减少。研究结果差异的原因可能为:(1)与样本来源的人种、地域等因素造成的差异有关[17];(2)使用了不同的微生物鉴定技术[18]。
在门水平,2组的优势菌门均为拟杆菌门、厚壁菌门、放线菌门,在属水平,2 组的优势菌属均为Prevotella、Bacteroides。这与人类肠道微生物群研究的先前报告一致[19],人类肠道主要由厚壁菌门或拟杆菌门组成,厚壁菌门的优势属为Ruminococc、Blautia、Eubacterium、Faecalibacterium,拟杆菌门的优势属为Bacteroides、Prevotella。
为了进一步确定关键菌群,本研究采用LEfSe方法,结果发现,亚健康组的厚壁菌门、放线菌门显著高于健康组,变形菌门、拟杆菌门显著低于健康组。这与Giloteaux等[20]的部分研究结果相似。Giloteaux等对一人患有CFS和另一人健康的单卵双胞胎,进行为期两天的心肺运动测试,并对运动前和运动后的粪便标本进行了16S rRNA测序分析。在人类肠道微生物中,厚壁菌门与拟杆菌门(F/B)比率升高被广泛认为是肠道失调的标志,并与肥胖[21]、糖尿病[22]和心血管[23]等疾病有关。我们在本次研究中也得到亚健康组的F/B比率的比值高于健康组,这可能与亚健康状态的发生发展有密切联系。
本研究还发现,在属水平,亚健康组的Blautia、Agathobacter显著高于健康组,Prevotella显著低于健康组,Giloteaux等[20]也发现CFS组的Prevotella显著低于健康组。Prevotella分解蛋白质和碳水化合物,发酵膳食纤维,产生短链脂肪酸,与葡萄糖稳态和宿主代谢有关[24],在自闭症儿童中也发现Prevotella的减少[25]。值得注意的是在既往研究中并未发现Blautia的变化。Blautia属于毛螺菌科,可导致人体血浆IL-1β水平升高,睡眠障碍已被证明与IL-1β升高有关[26],Smith[27]发现Blautia的丰度与睡眠质量呈负相关。李媛媛等[28]也提出,Blautia是区分慢性失眠患者与健康人的特征细菌。睡眠障碍是亚健康状态发生发展的危险因素,也是亚健康状态的重要表现之一[29],肠道菌群的改变与亚健康状态人群的睡眠障碍及疲惫症状相关[30],提示我们之后的研究可以从这一方面进行深入研究。
综上所述,我们发现亚健康状态人群的肠道菌群具有整体结构失衡的特征,厚壁菌门与拟杆菌门比率升高,并明确了差异物种,亚健康人群的Blautia、Agathobacter显著增加,Prevotella显著减少。目前,亚健康状态的病因和发病机制至今尚未清楚,但菌群稳态失调可能在亚健康状态的发生发展中发挥重要的作用。本研究通过运用高通量测序技术,将亚健康人群与健康人群进行比较研究,不仅发现二者呈现明显的不同,验证了亚健康状态影响肠道菌群多样性以及结构的组成,而且还将差异物种进一步鉴定至菌属,有望为治疗亚健康状态提供思路。本研究的不足之处在于,仅初步分析亚健康人群肠道菌群的分布情况,随着多组学技术的发展,下一步研究将结合代谢组学、蛋白质组学等方法确定具有核心功能的亚健康人群肠道菌群种类。