浸润性导管癌合并导管原位癌的临床病理特点分析
郑媛 陈波
临床上我们发现,乳腺癌标本中浸润性癌与原位癌同时出现,发生率约占所有乳腺癌20%~80%[1]。目前一致认为,导管原位癌经过一系列的细胞分子改变,会发展为浸润癌。发生时间需要数年乃至数十年。但原位癌并非浸润癌的发生必经阶段[2],部分病人标本中并未发现原位癌成分。虽然我们在分期和分型时仅需考虑浸润癌的生物学特性,但原位癌的存在对乳腺癌的临床分期、分子分型,复发风险是否有影响,与不合并原位癌的病人相比,两组间的病理特征是否有差异,目前尚无定论。我们查阅近5年本中心乳腺癌病人的病历资料。选取发病率最高的浸润性导管癌(IDC),及浸润性导管癌合并导管原位癌(IDC+DCIS)病人,分析两组间临床病理的差异。
对象与方法
一、对象
选取2016年1月~2020年5月我科收治的乳腺癌病人335例。由于浸润性导管癌发病率最高,且通常合并导管原位癌,极少合并小叶原位癌。所以本次仅选取IDC+DCIS病人123例对比IDC病人212例。排除年龄大于60岁的老年期乳腺癌病人。收集一般资料及标本的组织学分级、免疫组化、腋窝淋巴结转移个数等病理资料。
二、方法
分析两组病人分子分型、病理分期的差异。其中组织学分级及免疫组化资料只将浸润性癌纳入统计。雌激素受体(ER)及孕激素受体(PR)以>1%即为阳性。免疫组化人类表皮生长因子受体2(HER-2)(2+)进一步行FISH检测明确。细胞增殖核抗原(Ki-67)以<10%为低表达,≥30%为高表达,余为中表达。
三、统计学方法
应用SPSS 23.0 软件进行统计分析。两组计量资料采取t检验,计数资料比较采用χ2检验或Fisher 精确概率法;多组计数资料比较采用χ2分割。P<0.05为差异有统计学意义。
结果
1.IDC+DCIS组即浸润性导管癌合并原位癌组。IDC组即单纯浸润性导管癌组。表1显示,两组的T分期有差异。进一步χ2检验发现,两组间T1及T2期差异显著(P<0.016 7)。两组手术方式差异明显,由于分组较多可能降低统计效能,遂合并分析,发现两组间保乳及全切率有差异,DCIS+IDC组全切率更高(P=0.034)。而IDC组有更高的腋清率(75.0% vs 61.7%,P=0.011)。
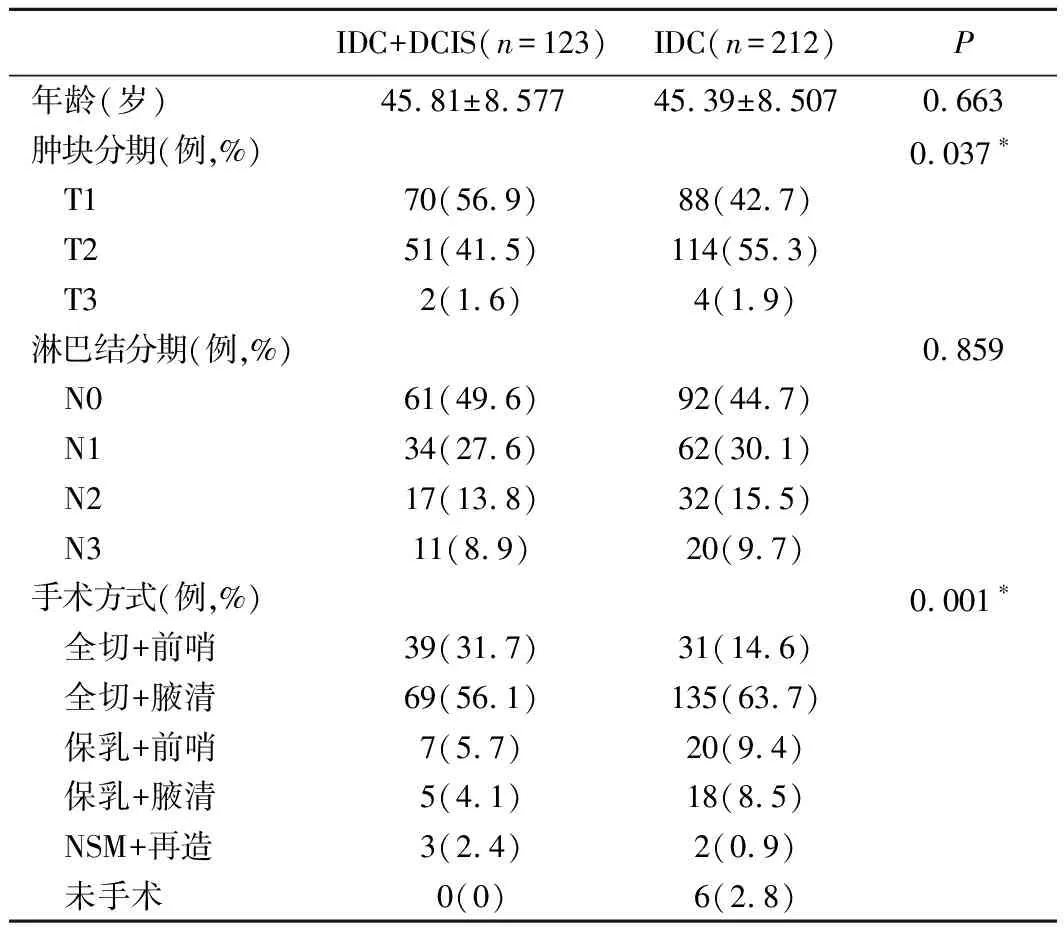
表1 两组临床特征描述
2.两组比较组织学分级及脉管浸润无差异,见表2。组织学分级按浸润性癌的分级标准,原位癌级别不纳入统计分析。癌灶是否伴有坏死,差异显著,IDC+DCIS组有更高的坏死率。

表2 两组间组织学差异(例,%)
3.比较两组免疫组化指标及分子分型发现,IDC+DCIS组HER-2表达率更高,p53、细胞角蛋白5/6(CK5/6)表达率更低。ER、PR、Ki-67%两组无差异。两组分子分型构成有差异,将多组数据合并分析,分为三阴型乳腺癌组及非三阴型乳腺癌组,发现IDC组三阴型乳腺癌占比更高,差异显著(P=0.02)。将两组的CK5/6表达率进行亚组分析,发现差异主要来自三阴型乳腺癌亚组。见表3、4。

表3 两组间免疫组化差异(例,%)
讨论
通过表一我们可以发现,两组间的T分期有差异。在IDC+DCIS组中,T1期病人所占比例最高,而IDC组中,T2期病人比例最高。根据我们的临床经验,单纯浸润性导管癌通常表现为孤立性肿块。而合并原位癌的病人,通常表现为肿块或片状增厚,通常病变范围较大,更易被病人触及,而早期就诊。此外,在T分期过程中,只计算浸润性癌灶的大小,也可能导致两组T分期不同。同时,我们还可以看到,两组的手术方式也不同,在IDC+DCIS组中有更高的全切率。与单纯的IDC相比,合并DCIS的病灶,切缘要求更宽[3],术中更难达到切缘阴性,这或许是临床医生选择不保乳的原因之一。

表4 两组间分子分型差异(例,%)
本次研究还发现,两组间分子分型的构成比有统计学差异,差异主要来自IDC组三阴型乳腺癌比例更高(23.1%vs9.8%,P=0.02)。既往文献报道,乳腺病人中三阴型病人约占16.9%~22.5%[4-5]。而本研究发现,合并DCIS的病人,三阴型乳腺癌比例下降。有文献报道,从正常细胞发展为乳腺癌可能有两种途径,途径一:正常细胞→原位癌→浸润癌;途径二:正常细胞→浸润癌[2]。合并原位癌的病人,可能与突变不断累积有关[6]。而IDC,可能更多与重要的癌基因或抑癌基因突变有关,如Tp53或BRCA基因。而上述基因突变的癌灶,免疫组化往往表现为三阴型。本次研究可以看到IDC组有更高的p53表达率(46% vs 37.5%),但差异无统计学意义(P=0.137)。
HER-2基因在正常乳腺细胞中几乎不表达,但是在原位癌及浸润性癌细胞中有表达,且DCIS中,HER-2阳性的比率远高于IDC,可能由于HER-2基因参与原位癌发展为浸润的过程。有文献报道,浸润癌合并原位癌的病人中,原位癌的分子分型通常与浸润癌大致相同[7]。其可能原因是,由原位癌进展成浸润癌,仅有小部分基因发生改变。还有一种可能是,在光镜能观察到浸润之前,DCIS的肿瘤细胞的某些基因已经发生改变。因此,我们能看到的原位癌细胞,其实已经发生基因的突变,或者基因表达的改变,从而过表达某些促浸润的分子,如HER基因的扩增。由此我们推断,IDC+DCIS组比IDC组有更高的HER-2阳性率。本文的研究结果证实了这一点。两组间HER-2阳性率差异显著(40.7%VS25%,P=0.003)。
此外,肿瘤周围微环境的变化,也是导致DICS进展的重要原因。CK5/6是一种基底细胞型角蛋白,临床由于标记肌上皮细胞。我们还可以看到两组间CK5/6表达差异显著(42.6%vs10.4%,P=0.00)。目前研究认为,原位癌向浸润癌进展的过程中,肌上皮细胞及基底膜遭到损伤,可能与肿瘤细胞及自身分泌的溶解酶有关[8]。也有可能是肌上皮细胞及免疫反应细胞多因素作用,释放溶解酶破坏基底膜。在上述的两种可能机制中,肌上皮细胞都参与其中。研究发现,与单纯DCIS病人相比,IDC+DCIS病人中CK5/6的表达率显著降低(30.6%vs11.3%,P=0.000 7),较低的细胞角蛋白表达可能预示着较高的间质浸润率[9]。本次研究也发现了合并原位癌组中,CK表达率仅10.4%。此外,我们进行亚组分析发现,两组间的CK5/6表达差异主要来自于三阴型乳腺癌(70%vs14.3%,P=0.011)。在三阴型乳腺癌中,基底样细胞型乳腺癌占较大比例,其免疫组化结果可表现为CK5/6阳性。而上文中提到,IDC组有更高的三阴型乳腺癌比例,这可能是导致其更高的CK5/6阳性率(42.6%)的原因。
通过上述分析,我们发现,两种病理类型同为浸润性导管癌,但其发生发展过程并不相同。目前针对IDC+DCIS的治疗方法及预后判断,仅参考浸润性癌成分的生物学特性。其合并的原位癌成分是否有指导治疗作用,合并原位癌的病人,是否有更好的预后,要回答以上问题,还需进一步研究。

