早期结直肠癌内镜黏膜下剥离术标本中PDCD4和自噬相关因子LC3Ⅱ、p62的表达及其意义*
何 双 温菲菲 许晓阳 李扬扬 崔忠泽 路丽祯 吴淑华
滨州医学院附属医院病理科(256603)
结直肠癌的发生是一个非常复杂的过程,目前公认的经典癌变途径是腺瘤-腺癌(正常肠黏膜-腺瘤-腺癌)序列[1]。本课题组的前期研究[2]结果显示,在腺瘤癌变过程中,细胞自噬发挥了重要作用。而另外一种重要的细胞内死亡方式——凋亡在早期结直肠癌演进过程中的变化规律尚不明确。程序性细胞死亡因子4(programmed cell death 4, PDCD4)在细胞凋亡过程中发挥重要的调控作用,然而,PDCD4对早期结直肠癌发生的作用及其与自噬的关系鲜见相关报道。本研究通过采用免疫组化法检测PDCD4、自噬相关因子LC3Ⅱ和p62在癌旁正常肠黏膜(paracancer normal intestinal mucous membranes, P-NIMM)、癌旁低级别上皮内瘤变(paracancer low-grade intraepithelial neoplasia, P-LGIN)、癌旁高级别上皮内瘤变(paracancer high-grade intraepithelial neoplasia, P-HGIN)和结直肠腺癌(colorectal adenocarcinoma)中的表达情况以及相关性,旨在探讨凋亡和自噬在早期结直肠癌发生中的相互作用及其临床意义。
对象与方法
一、研究对象
选取2015年1月—2020年11月在滨州医学院附属医院接受内镜黏膜下剥离术(ESD)切除且病理诊断为结直肠腺癌的标本54例。所有患者均首次确诊为结直肠腺癌,未进行任何治疗,基底切缘均为阴性,确保为T1期结直肠癌。HE切片由2位资深病理专家根据相关标准[3-4]重新阅片,紧密结合内镜下表现,同时注重细胞异型性与结构异型性。本研究方案由滨州医学院附属医院伦理委员会审批通过。
二、方法
1. 免疫组化法:全部标本经4%甲醛溶液固定,石蜡包埋后4 μm厚连续切片;经二甲苯、梯度乙醇脱蜡至水后,柠檬酸热修复2 min;滴加兔抗人PDCD4(Abcam公司,稀释浓度为1∶500)、兔抗人LC3Ⅱ(Abcam公司,稀释浓度为1∶200)、兔抗人p62(Abcam公司,稀释浓度为1∶200),4 ℃过夜;PBS洗涤后滴加通用型二抗(北京中杉金桥生物技术有限公司),37 ℃孵育30 min;DAB显色2 min,经苏木素复染后盐酸乙醇分化、脱水、中性树胶封片。PDCD4、LC3Ⅱ的阳性对照分别为扁桃体和正常脑组织,p62阳性对照为已知阳性的宫颈癌组织,采用PBS代替一抗作为阴性对照。
结果判断:PDCD4表达于细胞核或细胞质,LC3Ⅱ和p62表达于细胞质,均以细胞出现棕黄色颗粒为阳性标志。采用染色强度与阳性细胞率之积作为染色总分,染色强度:不着色,0分;淡黄色,1分;棕黄色,2分;黄褐色,3分。阳性细胞率:阳性细胞数<5%,0分;5%~30%,1分;31%~60%,2分;≥60%,3分。总分0~4分判断为阴性,6~9分为阳性。
2. UCSC数据库分析PDCD4在泛癌中的表达情况:通过UCSC数据库(https://xenabrowser.net/heatmap/)下载TCGA数据库中33种癌相关基因表达数据。使用Perl软件对数据进行整理,得到矩阵文件。应用R软件进行差异表达分析。
三、统计学分析
使用SPSS 20.0统计学软件,所得数据以率或百分比表示,组间比较采用χ2检验或Fisher精确检验;相关性分析采用Spearman相关性分析。P<0.05为差异有统计学意义。
结 果
一、结直肠腺癌患者的临床病理特征分析
54例接受ESD治疗的早期结直肠腺癌患者中,男性40例,女性14例,男女比为2.9∶1,男性早期结直肠腺癌的检出率高于女性;年龄39~83岁,中位年龄64岁;病变位于右半结肠者6例,左半结肠者48例,以直肠检出率最高;44例(81.5%)腺癌周边伴发腺瘤性病变,其余10例周边仅见正常肠黏膜。44例伴发腺瘤病变的患者中,25例仅伴发LGIN,9例仅伴发HGIN,10例同时伴发LGIN和HGIN;腺瘤类型多为管状-绒毛状腺瘤,占75.0%。
PDCD4表达与癌旁腺瘤长径相关(P<0.05),LC3Ⅱ和p62表达与腺癌长径、癌旁腺瘤长径相关(P<0.05),PDCD4、LC3Ⅱ和p62表达与结直肠腺癌患者性别、年龄、肿瘤部位、分化程度、浸润深度、癌旁腺瘤类型等无相关性(P>0.05;表1)。
二、不同病变组织中PDCD4、LC3Ⅱ、p62的表达情况
PDCD4在P-NIMM中的阳性表达主要位于细胞核,而在腺癌组织中主要位于细胞质(图1-3)。P-NIMM的PDCD4核/质表达比和表达强度均明显高于P-LGIN、P-HGIN和腺癌(P<0.05),P-LGIN、P-HGIN的核/质表达比明显高于腺癌(P<0.05),而P-LGIN与P-HGIN无明显差异(P>0.05;表2)。在10例癌旁仅正常肠黏膜的病例中,正常肠黏膜与腺癌的PDCD4核/质表达比差异无统计学意义(P>0.05;表3)。
LC3Ⅱ和p62在腺癌中的阳性表达率明显高于P-NIMM和P-LGIN(P<0.05),而与P-HGIN无明显差异(P>0.05),且P-LGIN中LC3Ⅱ和p62阳性表达率明显高于P-NIMM(P<0.05;表2)。在10例癌旁仅正常肠黏膜的病例中,p62在腺癌的阳性表达率高于正常黏膜,差异有统计学意义(P<0.05),而LC3Ⅱ在正常黏膜与腺癌的阳性表达率差异无统计学意义(P>0.05;表3)。

表1 早期结直肠腺癌患者PDCD4、LC3Ⅱ和p62表达与临床病理特征的相关性(n)
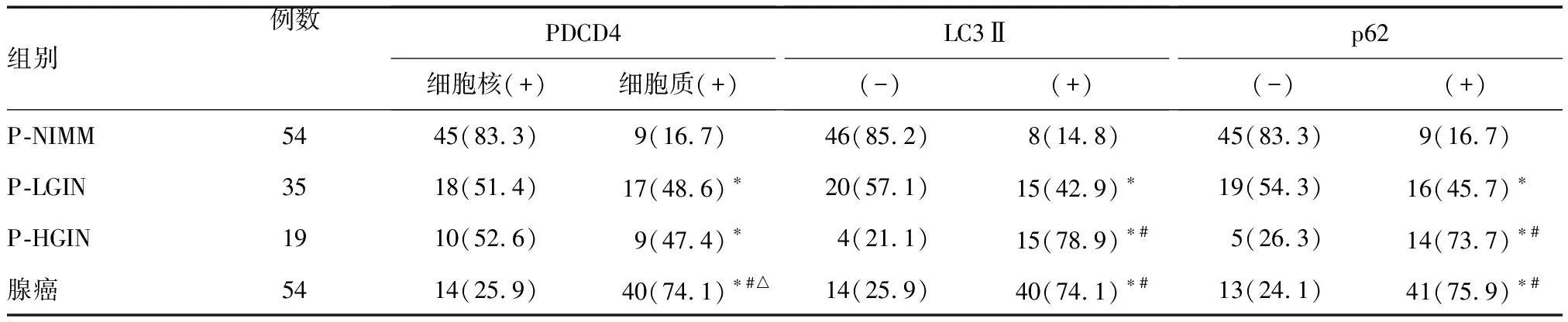
表2 PDCD4、LC3Ⅱ和p62在不同组织中的表达情况n(%)

表3 腺瘤-腺癌组与正常黏膜-腺癌组中PDCD4、LC3Ⅱ和p62表达情况(n)
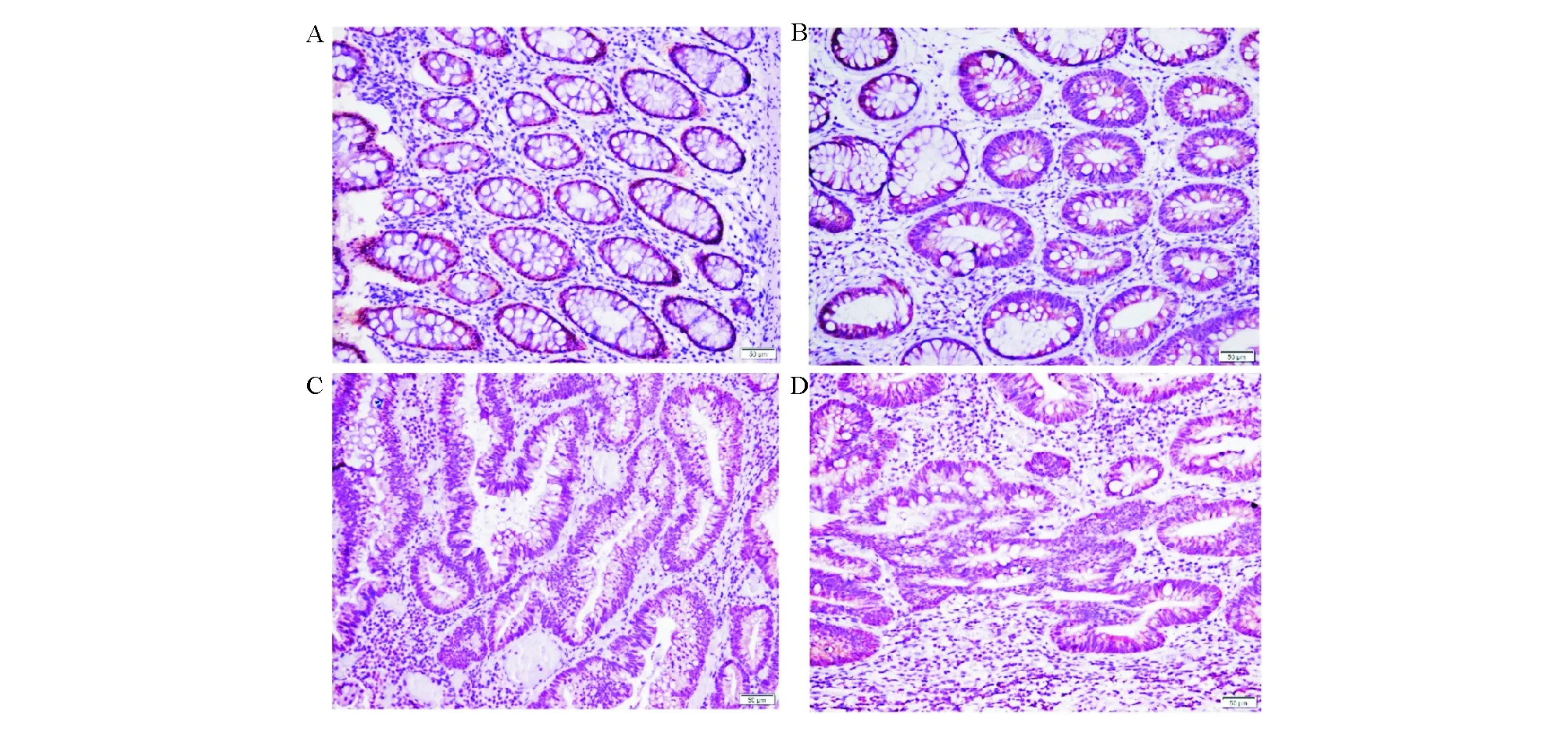
A:P-NIMM细胞核中阳性表达;B:P-LGIN中阳性表达;C:P-HGIN中阳性表达;D:腺癌中阳性表达
三、不同病变组织中PDCD4与LC3Ⅱ、p62表达的相关性
在P-LGIN、P-HGIN和腺癌中,PDCD4表达与LC3Ⅱ、p62表达均呈负相关,差异有统计学意义(P<0.05;表4)。
四、PDCD4在泛癌中的差异表达
通过UCSC数据库进行PDCD4差异表达分析,结果显示PDCD4在结直肠癌、膀胱尿路上皮癌、食管癌、头颈鳞状细胞癌、肾乳头状细胞癌等多种肿瘤中的表达均低于对应正常组织,而在嗜铬细胞瘤和副神经节瘤中呈高表达,差异均有统计学意义(P<0.05;图4)。
讨 论
早期结直肠癌是指局限于黏膜和黏膜下层的结直肠癌,而不论肿瘤大小以及有无淋巴结转移。在内镜技术发展前,早期结直肠癌只能选择外科手术进行治疗,手术创伤大且破坏正常解剖结构,影响患者生理功能。随着内镜技术的发展,ESD治疗具有创伤小、恢复快、对患者生理功能影响小等优点,能有效阻断消化道癌前病变的进一步发展,目前已成为消化道早癌的常规治疗方法[5-6]。ESD切除标本需进行详尽的病理学检查[7],因固定及时、充分,可保持各种生物因子在体内的真实状态,降低标本离体后因组织缺血、缺氧等外因而产生的各种化学反应,提高研究的准确性。本研究对54例早期结直肠腺癌的ESD标本进行临床病理特征分析发现,男性早期结直肠腺癌的检出率明显高于女性(2.9∶1),检出部位以左半结肠为主(88.9%),因此,行结肠镜检查时应仔细检查肠道各部位,重点关注乙状结肠和直肠的黏膜变化,尤其是男性患者,尽量避免漏诊病灶。本研究筛选出44例结直肠腺癌周边伴发腺瘤患者,这部分患者可能是通过腺瘤-腺癌序列演进而来的,其中3/4的腺瘤类型为管状-绒毛状腺瘤。管状-绒毛状腺瘤发生恶变的概率高于单纯管状腺瘤,因此,对于结肠镜活检病理诊断为管状-绒毛状腺瘤的患者,无论是LGIN还是HGIN,均应加强随访,定期复诊,及早发现、治疗肠道肿瘤。本研究还纳入了10例无腺瘤病变的结直肠腺癌患者,可能是通过其他癌变途径直接由正常肠黏膜恶变而来。总之,结直肠癌的发病机制复杂,深入研究其发病机制对于结直肠癌的防治具有重要的临床意义。

A:P-NIMM中阴性表达;B:P-LGIN中阳性表达;C:P-HGIN中阳性表达;D:腺癌中阳性表达

A:P-NIMM中阴性表达;B:P-LGIN中阳性表达;C:P-HGIN中阳性表达;D:腺癌中阳性表达

表4 P-LGIN、P-HGIN和腺癌中PDCD4表达与LC3Ⅱ和p62表达的相关性(n)

图4 PDCD4在33种泛癌中的差异表达情况
肿瘤的发生过程涉及肿瘤抑癌基因的失活、癌基因的激活以及多种细胞信号通路的异常,最终导致肿瘤细胞的无限增殖和凋亡受抑。凋亡是活体内细胞在基因调控下发生的主动死亡过程,若肿瘤发生、发展过程中凋亡受到抑制,将会促进肿瘤进展。新近研究发现,PDCD4对细胞凋亡过程具有调控作用,可通过抑制基因的转录、翻译过程而抑制肿瘤细胞增殖,因此认为PDCD4是一种潜在的抑癌因子[8-10]。研究表明,正常组织中PDCD4蛋白主要在细胞核中发挥作用,在发生营养缺乏或恶性增殖等外在条件改变时,PDCD4可通过核输出信号转移至细胞质中。本研究通过UCSC数据库分析发现PDCD4在包括结直肠癌内的多种肿瘤中表达下调或缺失。在44例腺瘤-腺癌患者中,免疫组化结果显示,PDCD4在P-NIMM的细胞核中阳性表达,而在腺癌中主要表达于细胞质中,且表达强度减弱,P-LGIN、P-HGIN的核/质表达比明显高于腺癌。推测在正常肠黏膜向LGIN转变以及HGIN向腺癌转变的过程中,PDCD4从细胞核转运至细胞质的过程可能发挥了重要作用。即当PDCD4由细胞核转移至细胞质时,失去了对细胞凋亡的诱导以及细胞周期的抑制作用,从而使细胞增殖失控,导致肿瘤的发生。因此,深入研究PDCD4发生细胞内转位的机制,对预防结直肠腺瘤癌变的发生具有重要意义。此外,在正常-腺癌患者中,PDCD4在正常肠黏膜与腺癌之间的核/质表达比无明显差异,提示正常肠黏膜-腺癌途径的激活与PDCD4的细胞内表达转位相关性不大,可能是通过其他途径诱导结直肠腺癌的发生。
自噬是指由双层膜囊泡结构包裹、吞噬受损的胞内物质形成自噬体,然后其外膜与溶酶体融合,形成自噬溶酶体后被溶酶体水解酶所降解的过程[11]。自噬过程中涉及多种自噬相关蛋白参与,其中LC3Ⅱ始终定位于前自噬体和自噬体膜,其含量代表了自噬体数目,可作为自噬的标志物[12-13]。p62既可诱导自噬发生,又是自噬调节蛋白和选择性降解底物,最终作为底物通过自噬途径被降解,故p62蛋白水平变化可反映自噬降解水平,又可作为自噬活性的标志物[12,14-15]。正常细胞的自噬通常呈低水平,这种适度的基础自噬至关重要,通过降解、再利用细胞内受损物质发挥抗凋亡和促进细胞修复的作用[11,16]。自噬在肿瘤中存在促进与抑制肿瘤进展的双重作用[17-18]。本课题组的前期研究[2]结果显示,自噬与结直肠腺瘤癌变的过程密切相关。本研究结果显示,LC3Ⅱ和p62在P-NIMM、P-LGIN、P-HGIN和腺癌中的阳性表达率逐渐升高,腺癌的阳性表达率明显高于P-LGIN和P-NIMM(P<0.05),而与P-HGIN无明显差异(P>0.05)。随着癌旁腺瘤长径和腺癌长径的增加,LC3Ⅱ和p62的阳性表达率逐渐增高,提示自噬在结直肠腺瘤癌变过程中发挥重要作用。推测随着肿瘤体积的增大,使部分细胞缺氧、饥饿,通过提高自噬水平降解肿瘤细胞内受损的蛋白质和细胞器,为其生长提供营养和能量,增强了肿瘤细胞抵御不利生存因素影响的能力,从而促进肿瘤生长,推动正常肠黏膜向低级别上皮内瘤变和高级别上皮内瘤变的转化,直至发生癌变。
凋亡与自噬在肿瘤发生、发展中发挥重要作用,自噬和凋亡有共同的调节因子和信号调控交汇点[19]。有关研究表明PDCD4在多种肿瘤细胞和免疫细胞中均能抑制自噬的发生,PDCD4的MA-3功能域通过eIF4A依赖的方式抑制自噬关键蛋白ATG5的翻译,抑制ATG12-ATG5复合体的形成,进而抑制自噬[20-22]。Manirujjaman等[23]发现,肝细胞癌细胞株中PDCD4蛋白在p62的引导下与自噬体上的LC3Ⅱ结合,从而被自噬系统降解,而抑制p62和自噬活性则会抑制PDCD4的降解。本研究发现,在P-LGIN、P-HGIN和腺癌中PDCD4表达与LC3Ⅱ、p62表达均呈负相关。推测在正常肠上皮发生瘤变的过程中,PDCD4首先由细胞核转运至细胞质中,其对凋亡的诱导和自噬的抑制作用减弱,共同促进了肿瘤的发生。而在腺瘤癌变的进展过程中,自噬活性的增强进一步促进了PDCD4的降解,从而导致癌变。通过p62引导PDCD4与LC3Ⅱ相结合,降解PDCD4,从而抑制肿瘤细胞发生凋亡,可能是自噬导致肿瘤发生的机制之一。
综上所述,细胞凋亡的抑制和自噬的激活共同作用促进了正常肠上皮向腺瘤甚至腺癌的转变。其机制可能为PDCD4的细胞内转位可抑制细胞凋亡,并增强自噬作用,而自噬激活后又可通过降解PDCD4进一步减弱其抑癌作用。在结直肠腺瘤-腺癌发展的早期阶段,阐明PDCD4由细胞核转运至细胞质的分子机制,并通过阻断这一过程增强细胞凋亡、降低细胞自噬,可有助于揭示肿瘤发生的规律,并能指导肿瘤的临床诊治。然而,本实验的研究方法比较单一,且样本量较少,故具体的致病机制仍有待于行大样本研究以及基因、分子等层面的研究进一步深入探讨证实。

