叉头框Q1基因在消化道肿瘤中的研究进展
江 汉 张 炜
江苏大学附属医院消化内科(212001)
叉头框(FOX)基因家族是一个庞大且功能广泛的转录因子大家族,其成员在结构上有一个共同的特征,即具有一个高度保守的叉头DNA结构域(Forkhead结构域)[1-2]。目前已发现100余个转录因子FOX家族成员,分为19个子家族,涉及细胞分化、增殖和凋亡、胚胎发育、衰老、糖脂代谢、免疫调节等过程。其中FOXQ1、FOXA1、FOXC1、FOXC2、FOXG1、FOXM1、FOXO等是致癌转录因子[3]。近年发现FOXQ1参与不同肿瘤的发生、发展,尤其在消化道肿瘤中的作用已成为研究的热点。通过研究FOXQ1在消化道肿瘤中的作用,有望为消化道肿瘤的基因治疗提供新靶标[4]。本文就FOXQ1在消化道肿瘤中的研究进展作一简要综述。
一、FOXQ1的结构和生理功能
FOXQ1基因位于人染色体6p23~25,全长2 319 bp,含有一个外显子。转录因子FOXQ1是一种调节细胞周期的脱氧核糖核酸结合蛋白。FOXQ1蛋白分为三个区域:丙氨酸和甘氨酸富集区、含有96个氨基酸的叉头盒区(FHD)和脯氨酸富集区。FHD即DNA结合区,其核心部分由3个α螺旋依次排列组成,两侧通过β折叠连接2个“翼”的环状结构,从而有机结合形成螺旋-转角-螺旋的结构域,故又称翼状螺旋蛋白。丙氨酸/甘氨酸富集区和脯氨酸富集区与转录激活因子、转录抑制因子或DNA修复复合物相关[5]。
FOXQ1在胃、气管、膀胱和唾液腺中强表达,在十二指肠、前列腺和胎儿肝组织中显著表达,在肾中极少表达[6]。FOXQ1能促进上皮分化、抑制平滑肌分化、激活T细胞和自身免疫、控制胃表面黏液细胞中黏蛋白基因表达和颗粒含量。此外,FOXQ1可调节毛发分化[3]。
二、FOXQ1的生物学功能
1. FOXQ1促进细胞增殖:Zhang等[7]的研究证实无论在体内还是体外,敲低FOXQ1基因可显著抑制肝癌细胞增殖。Kaneda等[8]发现FOXQ1在结直肠癌中过表达,并可能通过血管生成和抗凋亡作用增强肿瘤的致瘤性和生长。此外,在宫颈癌[9]、脑神经胶质瘤[10]和卵巢癌[11]中,FOXQ1基因高表达对肿瘤细胞增殖均有一定的促进作用。
2. FOXQ1促进肿瘤侵袭与转移
①FOXQ1诱导上皮-间质转化(EMT):Zhang等[12]的研究发现,FOXQ1在胃癌MKN-45细胞中的表达最高,在胃癌BGC-823细胞中的表达最低。敲低MKN-45细胞中FOXQ1基因可抑制EMT并降低胃癌细胞的侵袭性,而BGC-823细胞中过表达FOXQ1可导致EMT并促进胃癌细胞侵袭性。进一步分子机制的研究发现,FOXQ1表达与EMT相关转录因子Snail的表达呈正相关。此外,FOXQ1可通过调节E-cadherin和vimentin表达来促进非小细胞肺癌[13]、乳腺癌[14]、膀胱癌[15]的EMT。
②FOXQ1参与Wnt信号通路:Peng等[16]发现FOXQ1在结直肠癌组织中过表达,并与结直肠癌分期和淋巴结转移密切相关。敲低FOXQ1表达可减少结直肠癌SW480细胞血管的生成和侵袭,并降低对化疗的耐药性。FOXQ1敲低可通过阻止β-catenin的核转移来降低Wnt信号的活性。此外,TGF-β1可诱导FOXQ1基因表达,并促进SW480细胞的迁移和侵袭。说明FOXQ1可能通过Wnt信号通路促进结直肠癌细胞的EMT、侵袭和转移。
③FOXQ1诱导肿瘤微环境和血管生成:有研究[17]发现,FOXQ1通过直接结合ZEB2启动子激活ZEB2的表达,从而诱导EMT。VersicanV1是FOXQ1的直接转录靶点,可诱导肝癌细胞分泌趋化因子CCL2,从而促进肝癌转移并招募巨噬细胞。动物实验表明肝癌细胞中FOXQ1过表达可促进肝癌转移和肿瘤相关巨噬细胞浸润。推测FOXQ1通过激活ZEB2和VersicanV1表达来促进肝癌的转移,从而诱导EMT并招募巨噬细胞浸润。Tang等[18]证实FOXQ1通过激活血管生成因子的表达来降低血管生成抑制剂的表达,从而促进结直肠癌细胞的血管生成。此外,FOXQ1可通过激活Twist1/CCL2轴促进巨噬细胞的募集。
总之,FOXQ1对消化道肿瘤细胞侵袭和转移的调控机制复杂多样(图1),有待进一步研究证实。
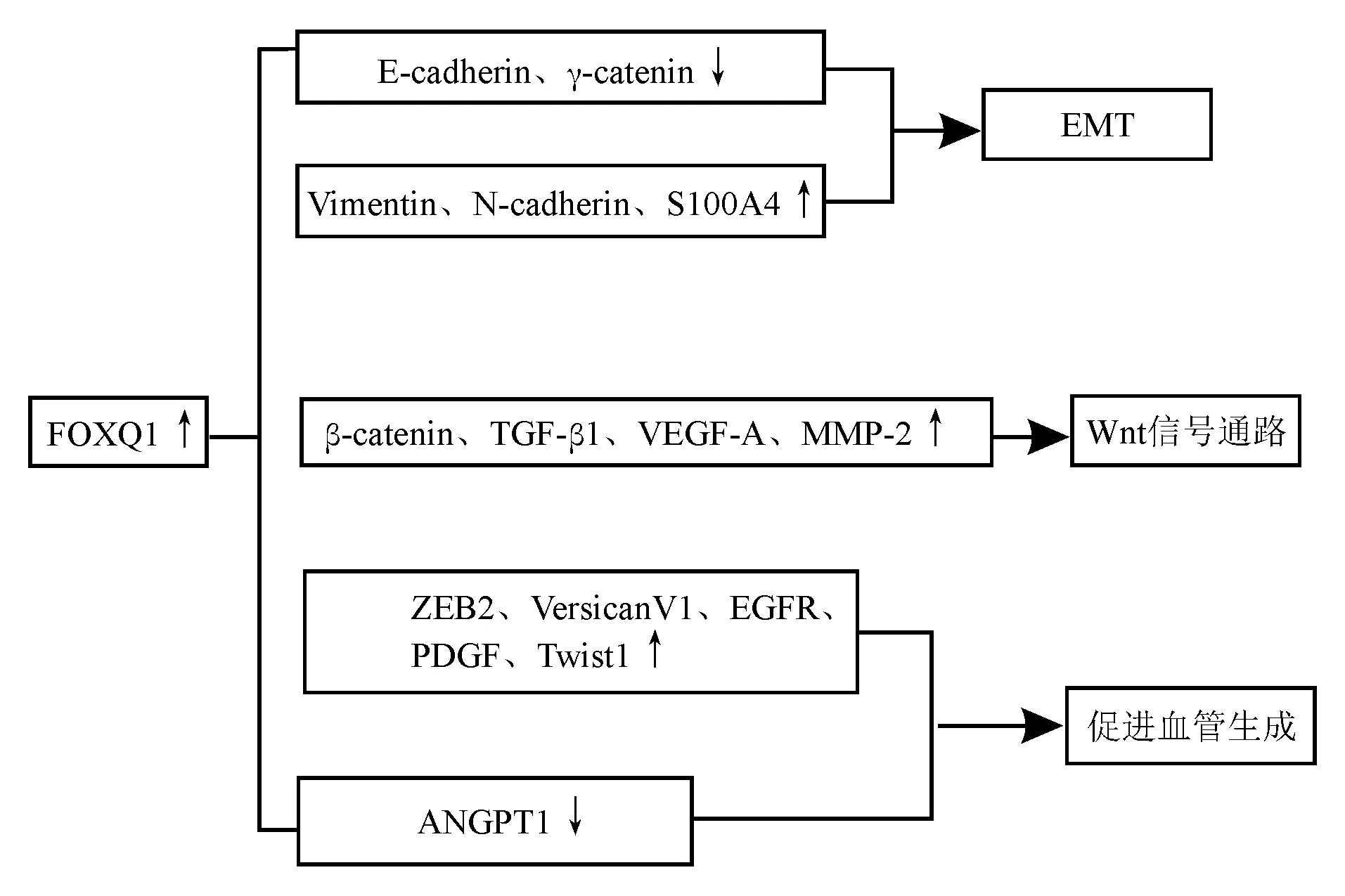
图1 FOXQ1参与消化道肿瘤侵袭和转移的可能作用机制
3. FOXQ1对肿瘤干细胞特性的维持:Bao等[19]通过分析人胰腺癌细胞中具有肿瘤干细胞样细胞特性的CD44+/CD133+/EpCAM+细胞群的基因表达谱发现,其可促进胰腺癌细胞生长、迁移、克隆和自我更新能力。转染FOXQ1 siRNA后,FOXQ1 mRNA和蛋白表达下降,并可抑制肿瘤生长以及肿瘤干细胞标志物在异种移植肿瘤中的表达。因此,FOXQ1在维持胰腺癌来源的肿瘤干细胞样细胞的肿瘤干细胞特性中具有重要的调控意义。
此外,FOXQ1基因在细胞周期调节、促进细胞信号转导方面发挥一定的生物学功能[11,20]。
三、FOXQ1基因与消化道肿瘤的研究进展
1. 食管癌:在食管鳞状细胞癌(ESCC)组织中,FOXQ1 mRNA和蛋白表达均显著高于相应癌旁组织。FOXQ1过表达可促进ESCC肿瘤细胞增殖,而沉默FOXQ1可抑制细胞增殖;FOXQ1还可作为转录阻遏物结合CDH1的启动子并阻断其转录。提示FOXQ1是一个致癌基因,可通过负调控细胞内CDH1来促进ESCC肿瘤细胞的增殖和转移[21]。于海峰等[22]亦发现ESCC患者中FOXQ1表达显著高于相应癌旁组织,且其过表达与淋巴结转移和TNM分期相关,FOXQ1高表达的5年生存率显著低于低表达者。FOXQ1高表达是判断ESCC患者临床预后的独立危险因素。
Wang等[23]证实,人食管癌细胞EC1、EC109、EC9706、TE1和TE13中FOXQ1表达显著高于正常人食管上皮细胞HET-1A。在EC109和EC9706细胞中,使用慢病毒沉默FOXQ1的表达可导致细胞生长迟缓,表明FOXQ1可能有助于食管癌的进展。
2. 结直肠癌:有研究[24]发现,FOXQ1过表达导致结直肠癌细胞迁移和侵袭增加,而沉默FOXQ1表达可抑制结直肠癌细胞迁移和侵袭。体内鸡绒毛尿囊膜转移试验发现FOXQ1对结直肠癌细胞的增殖作用不明显,但可通过调控Twist1的转录表达来显著增强细胞侵袭和转移。在结直肠癌细胞和组织中,FOXQ1过表达可明显增强Twist1 mRNA和蛋白表达,沉默FOXQ1表达可抑制Twist1 mRNA和蛋白表达。进一步机制研究发现FOXQ1可增强Twist1活性,并与其启动子直接相互作用,提示Twist1可能是FOXQ1的直接靶点,两者表达呈正相关。
Liu等[25]的研究发现,结直肠癌组织和肿瘤细胞中FOXQ1表达均明显高于正常结直肠组织和细胞。在FOXQ1 siRNA处理的HCT116和LOVO细胞中,CD44、细胞外调节蛋白激酶1/2(ERK1/2)和雷帕霉素哺乳动物靶标(mTOR)表达显著降低,而FOXQ1高表达可增加CD44、ERK1/2和mTOR表达,提示FOXQ1可促进结直肠癌细胞增殖。小鼠移植实验发现FOXQ1表达降低可显著抑制体内肿瘤细胞生长,过表达显著增加了体内肿瘤的生长。此外,FOXQ1可通过抑制FAK、PI3K磷酸化、AKT磷酸化和MMP-2/9表达抑制结直肠癌细胞迁移和侵袭。由此推测FOXQ1可通过PI3K/AKT信号通路促进结直肠癌转移。
Tang等[18]发现FOXQ1诱导的血管生成和巨噬细胞募集在结直肠癌中起有重要作用。FOXQ1过表达促进人脐静脉内皮细胞募集并增加微血管长度和完整微血管数,而抑制FOXQ1表达导致肿瘤血管生成和肿瘤内巨噬细胞浸润减少。PDGF、PDGFRB、PLAUR、VEGF、EGFR、HB-EGF和Twist1的蛋白表达与FOXQ1表达呈正相关,而ANGPT1蛋白表达与FOXQ1表达呈负相关,表明FOXQ1通过激活血管生成因子的表达同时减少血管生成抑制剂的表达来促进结直肠癌细胞中的血管生成。ELISA法结果显示抑制FOXQ1表达可阻止CCL2的自分泌,且FOXQ1介导的CCL2分泌依赖于Twist1表达。结直肠癌组织中FOXQ1表达与Twist1和CCL2表达呈正相关,三者的阳性共表达与较低的8年生存率相关。由此可见,FOXQ1可能为抑制血管生成和减少巨噬细胞募集的治疗靶点,同时有可能成为晚期或失去手术机会的结直肠癌患者治疗的新突破口,并为结直肠癌化疗药物的研发提供理论基础。
3. 肝癌:Qin等[26]通过构建表达FOXQ1基因的RNA干扰(RNAi)的慢病毒载体并转染肝癌7721细胞,发现FOXQ1表达显著下降,肝癌7721细胞的迁移能力、浸润能力和生存能力明显受到抑制,且细胞凋亡率增加。由此可见,FOXQ1慢病毒RNAi载体能有效抑制7721细胞中FOXQ1表达,降低FOXQ1的表达可抑制7721细胞的迁移、浸润和存活,增加细胞凋亡。
还有研究[27]发现,肝癌组织和肝癌细胞中miR-1271表达均降低,可促进细胞生长并抑制细胞凋亡,过表达可抑制细胞生长并诱导细胞凋亡。FOXQ1是miR-1271的靶基因,miR-1271过表达可抑制HepG-2细胞中FOXQ1蛋白表达,两者表达呈负相关,推测miR-1271是一种新的肿瘤抑制剂,通过直接抑制FOXQ1基因的表达而抑制肝癌细胞增殖和诱导细胞凋亡。
Han等[28]发现与相应的邻近非肿瘤组织和正常肝细胞相比,miR-4319在肝癌组织标本和细胞中的表达显著降低,并与肿瘤大小、组织学分级和静脉侵袭相关,miR-4319低表达的肝癌患者的总生存率和无病生存率明显低于高表达者;miR-4319可抑制肝癌细胞增殖并加速细胞凋亡;体内肿瘤实验发现miR-4319低表达可诱导EMT并赋予癌干细胞特性。FOXQ1是miR-4319的直接靶点,FOXQ1高表达可部分逆转miR-4319诱导的肝癌的生物学效应,提示在肝癌细胞中miR-4319与FOXQ1基因的表达呈负相关。由此可见,miR-4319通过直接抑制FOXQ1表达而抑制肝癌细胞增殖、加速细胞凋亡、抑制EMT来预防肝癌的发生。
综上所述,miR-1271、miR-4319在抑制肝癌恶性进展中起有重要作用,miR-1271/FOXQ1、miR-4319/FOXQ1级联可能作为治疗肝癌的潜在靶点。
4. 胃癌:Soleimani等[29]检测了31例胃腺癌和相应正常胃组织中FOXQ1的表达。结果显示FOXQ1在胃腺癌组织中的表达显著高于正常组织,FOXQ1在高级别肿瘤中的表达高于低级别组织,推测FOXQ1过表达可能参与了胃腺癌的发生、发展。
Guo等[30]采用THP-1作为肿瘤相关巨噬细胞,与胃癌细胞共培养并阐明肿瘤相关巨噬细胞作用于胃癌细胞的潜在机制。结果显示,与肿瘤相关巨噬细胞共培养可促进胃癌细胞的侵袭和迁移,并诱导胃癌细胞EMT的发生。与THP-1共培养可显著增加FOXQ1 mRNA和蛋白表达;将shRNA转染MKN45和MKN74细胞后,FOXQ1 mRNA和蛋白表达显著降低。表明FOXQ1参与了与肿瘤相关巨噬细胞共培养胃癌细胞的EMT。而沉默FOXQ1可阻断肿瘤相关巨噬细胞诱导的EMT和胃癌细胞迁移。此外,胃癌组织中肿瘤相关巨噬细胞标志物CD68高表达与FOXQ1表达相关。由此可见,FOXQ1对肿瘤相关巨噬细胞诱导的EMT和胃癌细胞迁移过程至关重要,FOXQ1过表达可加速肿瘤巨噬细胞浸润,有利于肿瘤微环境的形成,而肿瘤相关巨噬细胞/FOXQ1轴有可能成为治疗胃癌的新靶点。
Feng等[31]的研究发现,胃癌组织和细胞中miR-345表达均显著低于邻近正常组织和正常胃上皮细胞;且miR-345表达降低与胃癌患者淋巴结转移和TNM分期有关,miR-345低表达者的总体存活率和无病存活率降低。体外实验表明miR-345能抑制胃癌细胞迁移和侵袭,体内实验表明miR-345敲低可促进裸鼠胃癌细胞的肺转移,提示miR-345在体外和体内均可抑制胃癌细胞的迁移和侵袭。此外,miR-345可通过抑制胃癌细胞的EMT来防止细胞转移。FOXQ1为胃癌细胞中miR-345的下游靶点。MiR-345过表达显著降低了FOXQ1 mRNA和蛋白表达,表明胃癌细胞中miR-345与FOXQ1表达呈负相关。由此可见,miR-345可能通过直接抑制FOXQ1表达而抑制胃癌转移和EMT。
杨欣怡等[32]的研究结果显示,胃癌组织中miR-96-5p表达明显低于癌旁组织,胃癌细胞BGC-823中miR-96-5p表达明显低于正常胃上皮细胞,miR-96-5p过表达可显著降低胃癌细胞的增殖和侵袭能力。胃癌组织中FOXQ1蛋白的阳性表达率明显高于癌旁组织。MiR-96-5p过表达降低了FOXQ1蛋白表达,且E-cadherin表达升高,vimentin表达降低,提示FOXQ1表达与miR-96-5p表达呈负相关。因此miR-96-5p可能通过降低FOXQ1表达抑制胃癌细胞的增殖、迁移和EMT。
Xu等[33]发现FOXQ1在胃癌细胞和肿瘤组织中高表达。将FOXQ1 siRNA转染AGS细胞后,细胞侵袭和迁移能力明显受到抑制,上皮标志物E-cadherin表达显著升高,而间质细胞标志物N-cadherin和vimentin表达降低,表明FOXQ1可促进胃癌细胞的增殖、迁移、侵袭和EMT。MiR-519在胃癌组织和胃癌细胞中的表达均降低,miR-519过表达可抑制胃癌细胞的增殖、迁移、侵袭和EMT,而转染miR-519抑制剂后,AGS细胞的增殖、迁移和侵袭能力显著增加。此外,将miR-519模拟物转染AGS细胞后,FOXQ1表达显著降低,而转染miR-519抑制剂可使FOXQ1表达升高,证实FOXQ1是miR-519的靶基因,两者表达呈负相关。上述结果表明 miR-519和FOXQ1异常表达与胃癌的发生、发展密切相关,miR-519可能通过抑制FOXQ1表达在胃癌的增殖、侵袭和转移中发挥重要作用。
5. 胰腺癌:Zhan等[34]的研究发现,与正常胰腺组织和胰腺上皮细胞相比,FOXQ1基因在肿瘤组织和癌细胞中的表达均升高。单因素和多因素生存分析显示高FOXQ1表达和晚期TNM分期的患者预后较差,FOXQ1高表达与胰腺癌患者的总生存期呈负相关,推测FOXQ1可能是胰腺癌的新分子靶点和新的预后标志物。
此外,FOXQ1在非小细胞肺癌[35-36]、乳腺癌[37-38]、膀胱癌[15,39]、子宫颈癌[9]、胶质瘤[10]中的表达均升高,可能促进了肿瘤的发生、发展、侵袭与转移。
四、展望
总之,FOXQ1高表达与消化道肿瘤的进展密切相关。鉴于FOXQ1基因在不同消化道肿瘤中的表达和生物学作用并不完全相同,其具体的作用机制仍需进一步探讨。目前对FOXQ1与消化道肿瘤关系的认识尚处于初步阶段,FOXQ1对相关基因调控、转录激活机制、信号通路等尚缺乏深入的研究,将成为今后研究的重点。对于晚期消化道肿瘤患者,目前尚未开展针对以FOXQ1为直接或间接作用靶点的化疗药物的研究,未来仍需研发有效针对FOXQ1或FOXQ1级联反应相关靶点的抗肿瘤药物。FOXQ1已成为消化道肿瘤研究的一个新的突破点,随着研究的推进,FOXQ1可能成为消化道肿瘤诊断和治疗的关键靶点,并为消化道肿瘤高危人群筛查和晚期肿瘤患者的基因治疗提供新思路。

