硫酸−方铅矿体系高效浸出电解锰渣
孙俊,饶帅,王东兴,袁祥奕,曹洪杨,张皓东,段丽娟,刘志强
(1. 昆明理工大学环境科学与工程学院,云南昆明,650504;2. 广东省科学院稀有金属研究所,广东广州,510650;3. 广东省稀土开发及应用重点实验室,广东广州,510650;4. 稀有金属分离与综合利用国家重点实验室,广东广州,510650;5. 广东省有色金属废料资源化利用与无害化处置工程技术研究中心,广东广州,510650)
金属锰广泛用于钢铁生产、有色金属冶炼和电池制造等行业[1],是重要的战略资源之一。中国蕴藏量最多的锰矿石是菱锰矿(MnCO3),故主流的电解锰工艺是以菱锰矿作原料,软锰矿(MnO2)为氧化剂,在硫酸体系下制备硫酸锰电解液,经电沉积得到高纯度金属锰[2];而电解锰渣(electrolytic manganese residues,EMRs)是酸浸除杂工序得到的废渣,其中含有硫酸盐、二氧化硅和其他重金属(Mn,Pb,Ca,Fe 和Mg)[3]。很多学者研究了电解锰渣的资源化再利用,主要包括制成路面基层材料[4]、改性吸附剂[5]、透水砖[6]以及多孔陶瓷[7]等;但电解锰渣中大量重金属会对材料的性能产生负面影响。因此,在电解锰渣二次利用之前回收铅、锰等有价重金属具有十分重要的意义。
电解锰渣中的锰元素常以二氧化锰形态存在[8],为了实现锰的最大化浸出,需要将难溶性锰(Ⅳ)还原为可溶性锰(Ⅱ)[9]。近年来,研究的还原剂类型可概括为无机还原剂和有机还原剂。无机还原剂包括过氧化氢[10]、硫酸亚铁[11]和二氧化硫[12]等;有机还原剂包括生物质(废茶[13]和药渣[14])、碳水化合物(木质素[15]和乳糖[16])、有机化合物(草酸[17]、柠檬酸[18]和羟基苯[19])等。在实际生产中,采用过氧化氢作还原剂成本较高,硫酸亚铁作还原剂引入了新杂质,二氧化硫作还原剂容易腐蚀设备;虽然有机还原剂几乎没有上述缺点,但酸浸过程中生物质和碳水化合物产生有机小分子物质给后续锰的回收带来不利影响[20],因此,开发一种便宜且高效的还原剂对电解锰渣浸出锰具有现实意义。
通常电解锰渣中质量分数较高的有价金属是铅和锰,因此,本文提出一种硫酸体系下方铅矿作还原剂浸出锰的方法。方铅矿是一种价廉且分布较广泛的天然矿石,主要矿物成分是硫化铅;加入方铅矿可以使高价锰降价进入浸出液,同时硫酸体系中引入方铅矿增加了浸出渣中铅的产量,浸出过程中没有引入新的杂质,进一步高效分离锰和铅。本文旨在探讨方铅矿浸出锰的反应机理,优化方铅矿浸出锰的工艺参数,从动力学角度研究浸锰过程的控制步骤。
1 实验
1.1 实验原料
实验所用电解锰渣来自宁夏某电解锰厂,经烘干和研磨,过孔径为106 μm 的筛子密封保存备用,其主要化学成分由表1所示。由表1可知,电解锰渣主要含有锰、铅、钙和硫等元素。

表1 电解锰渣主要化学成分(质量分数)Table 1 Chemical composition of EMRs(mass fraction)%
图1 所示为电解锰渣XRD 图谱。由图1 可见:电解锰渣中铅的主要晶体物相是硫酸铅(PbSO4),钙的主要晶体物相是生石膏(CaSO4•2H2O);由于电解锰渣中的锰衍射峰较弱,因此,无法确定锰的物相。对电解锰渣进行扫描电镜及能谱(SEMEDS)分析,电解锰渣SEM像和EDS谱如图2所示。从图2 可见:Mn,Pb,Ca,Si 和S 都存在较强的特征衍射峰,其中点1 处矿物为石英(图2(b)),在硫酸铅和石膏表面附着有大量的锰化合物(图2(c)),而点3 处矿物为无其他物质附着的硫酸铅颗粒(图2(d))。
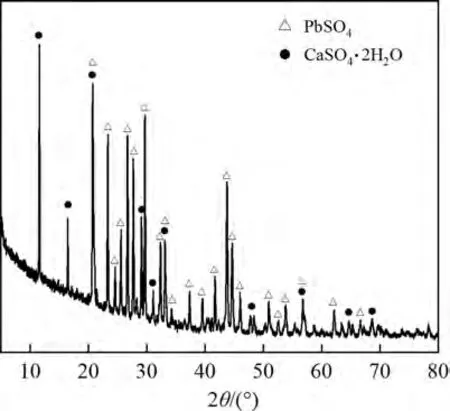
图1 电解锰渣XRD图谱Fig.1 XRD patterns of EMRs

图2 电解锰渣SEM像及EDS谱Fig.2 SEM image and EDS spectrum of EMRs
为了进一步确定锰的物相,对电解锰渣进行X射线光电子能谱(XPS)分析,通过XPSpeak41 软件对结果进行校正和分峰处理,结果如图3所示。由图3(a)可见:Mn 2p3/2和Mn 2p1/2分别在642.2 eV和653.9 eV处的能级峰是MnO2中Mn4+的特征峰[21],Mn 2p3/2 位于640.9 eV[22]和644.8 eV[23]的能级峰分别是MnO 和MnSO4中Mn2+的特征峰,说明电解锰渣中锰呈正二价和正四价,主要以氧化锰、硫酸锰和二氧化锰形态赋存。根据电解锰工艺,推测氧化锰和二氧化锰来自未完全反应的软锰矿,硫酸锰则是压滤过程中残留在电解锰渣表面的电解液[24]。由图3(b)可见:S 2p3/2 位于169.05 eV 附近的能级峰与MeSO4的特征峰吻合[25],说明电解锰渣中硫主要以硫酸盐形态存在,与XRD 图谱所示结果一致;此外,S 2p3/2 在164.1 eV 处出现能级峰[26],表明电解锰渣中有少量硫磺;能级峰在162.2 eV附近有Me—S键存在[27],电解锰渣中含有微量金属硫化物。

图3 电解锰渣XPS图Fig.3 XPS spectrum of EMRs
实验所用的方铅矿产自广西梧州,经烘干和研磨,过孔径为106 μm的筛子,经密封保存备用。通过定量分析可知,方铅矿主要由质量分数为81.16%的铅和12.8%的硫组成,含有少量杂质铁、钙、锌、锡和硅,其质量分数分别为1.00%,0.62%,0.55%,0.48%和1.47%。图4 所示为方铅矿XRD 图谱。由图4 可见,方铅矿主要晶体物相为硫化铅,且几乎无其他杂质的衍射峰。综上可见,方铅矿为高品位的铅精矿。
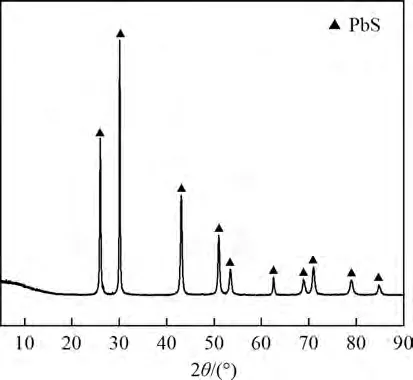
图4 方铅矿XRD图谱Fig.4 XRD patterns of Galena
1.2 分析方法
采用Rigaku Smart Lab SE X 射线衍射光谱仪(XRD)确定固体试样的物相组成;采用Zeiss Sigma 300 扫描电镜及能谱仪(SEM-EDS)分析固体试样形貌和化学成分;采用PE PHI-5400 X射线光电子能谱仪(XPS)分析固体试样中锰和硫的价态;采用Agilent 725 电感耦合等离子体发射光谱仪(ICP-OES)测定液体试样的金属含量。
1.3 实验方法
1.3.1 单因素浸出实验
称取10 g 电解锰渣在设定参数下进行浸出实验。待到实验终点,趁热对样品进行抽滤,洗涤烘干浸出渣。通过ICP-OES 确定浸出液中锰的质量浓度,按式(1)计算浸出率。在聚四氟乙烯烧杯中加入硝酸和氢氟酸,高温溶解浸出渣,待溶液冷却后定容,用ICP-OES 测定溶液中锰和铅质量浓度,按式(2)分别计算浸出渣中金属的质量分数。

式中:x是锰的浸出率,%;ρi是浸出液中的锰质量浓度,g/L;Vi为浸出液的体积,L;w是电解锰渣中金属的质量分数,%;mi为实验所用电解锰渣的质量,g。

式中:M是浸出渣中金属的质量分数,%;ρj为溶液中金属的质量浓度,g/L;Vj为溶液体积,L;mj为预处理所称取浸出渣的质量,g。
1.3.2 动力学实验
在2 L三颈烧瓶中进行动力学实验。瓶口装有冷凝回流管以保证浸出过程中无质量损失,使用机械搅拌器控制搅拌速度为500 r/min,加入1 L最佳浓度的硫酸溶液,待水浴升温到实验温度,投加10 g粒径为75~100 μm的电解锰渣和最佳质量的方铅矿混合样,定时取样2 mL,浸出过程持续90 min。浸出液用ICP-OES测定其锰质量浓度,按式(3)计算锰浸出率。
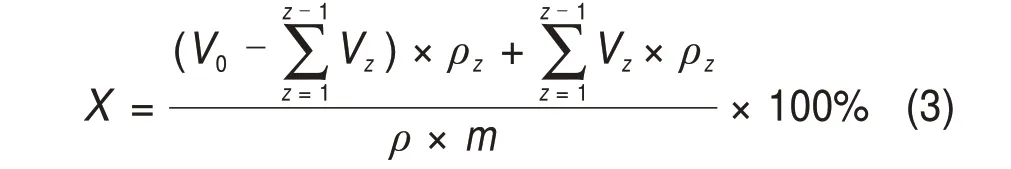
式中:X为锰的浸出率,%;V0为浸出液的总体积,L;Vz为每z次间隔时间取出溶液的体积,L;ρz为每次取出溶液中的锰质量浓度,g/L;m为电解锰渣的质量,g。
2 浸出机理
电解锰渣中锰的物相主要是氧化锰、二氧化锰和硫酸锰;90 ℃下Mn-Pb-S-H2O 体系下Eh−pH优势区图如图5所示。由图5可见:当系统电位处于高位时,二氧化锰在酸性溶液中稳定存在,故反应体系的电位需适当降低,以还原体系中的Mn4+,进而溶解溶液中的二氧化锰。
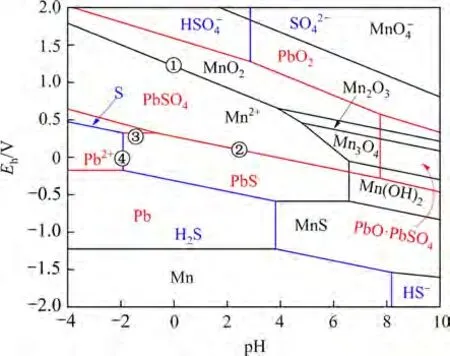
图5 90 ℃下Mn-Pb-S-H2O系Eh−pH图Fig.5 Eh−pH dominant area map of Mn-Pb-S-H2O system at 90 ℃
酸性溶液中方铅矿对二氧化锰的还原行为可以用原电池反应解释[28]。图5可见:二氧化锰的氧化还原电位明显高于方铅矿,因此,前者成为阴极发生还原反应(图5 中①),Mn4+还原为Mn2+形成硫酸锰溶液,反应如式(4)所示。
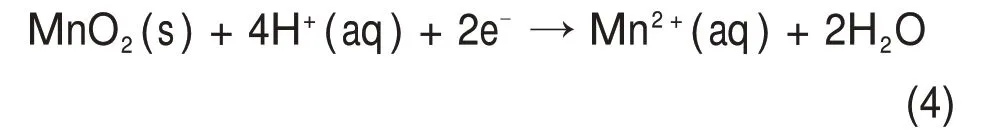
方铅矿为阳极发生氧化反应,且生成产物随着pH变化而改变;当溶液pH在−0.67~7.00范围内时,PbS 中的S2−被氧化为(图5 中②),反应如式(5)所示。
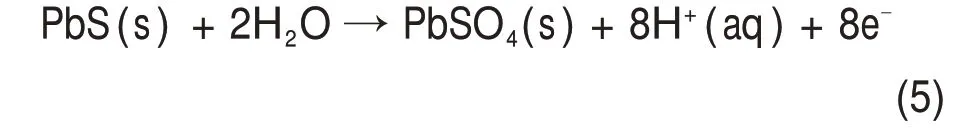
当溶液pH 在−1.9~−0.67 区间时,反应产物为硫磺(图5中③)[29],反应如式(6)所示。
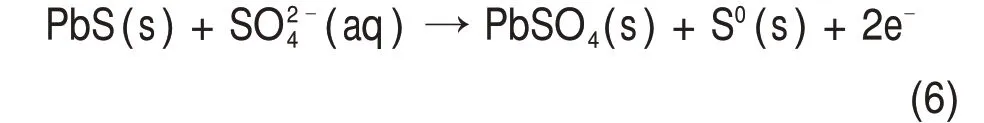
随着pH 继续降低,方铅矿与氢离子发生非氧化反应生成硫化氢(图5 中④)(式(7))[30];虽然硫化氢与二氧化锰反应(式(8))可以得到相同浸出效果,但高浓度的氢离子促进Pb2+进入溶液,不利于铅和锰的分离。
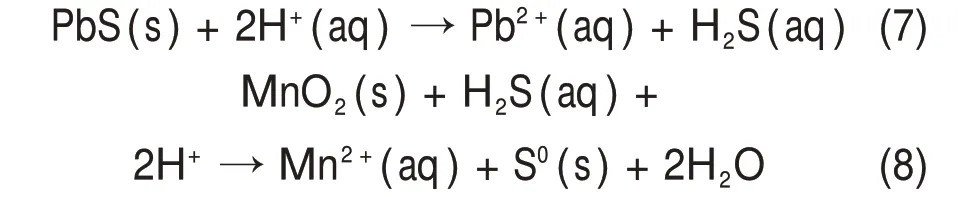
3 工艺参数对电解锰渣中浸出锰的影响
3.1 浸出时间
在电解锰渣与方铅矿质量比为10.0∶0.4、液固比为7.5 mL/g、硫酸浓度为1 mol/L 和浸出温度为65 ℃的条件下,考察浸出时间对反应进程的影响情况,结果如图6(a)所示。由图6(a)可见:当浸出时间为15 min时,锰的浸出率达到56.9%,短时间内锰浸出率较高的原因是硫酸锰和氧化锰的溶解;之后,随着反应时间延长,锰浸出率缓慢上升;当反应时间超过120 min时,浸出率趋于稳定,此时,锰的浸出率为70.67%,浸出渣还残留质量分数为2.04%的锰。设定后续实验浸出时间为2 h。
3.2 浸出温度
在电解锰渣与方铅矿质量比为10.0∶0.4、液固比为7.5 mL/g、硫酸浓度为1 mol/L 和浸出时间为120 min 的条件下,考察浸出温度由30 ℃升至100 ℃对浸出锰和富集铅的影响,结果如图6(b)所示。从图6(b)可见:随着浸出温度升高,锰的浸出率由60.37%增加到85.92%;浸出渣中的锰质量分数由2.67%降为1.04%。说明浸出温度对浸出效果影响显著,升高浸出温度激活了未活化分子,降低溶液黏度,有助于浸出反应的进行[31]。综上所述设定100 ℃为最佳浸出温度。
3.3 硫酸浓度
在电解锰渣与方铅矿质量比为10.0∶0.4、液固比为7.5 mL/g、浸出温度为100 ℃和浸出时间为120 min 的条件下,考察硫酸浓度对浸锰和富集铅影响,结果如图6(c)所示。从图6(c)可见:当硫酸浓度从0 mol/L增加到2 mol/L,锰浸出率也随之从45.42%升高到92.36%,浸出渣中铅质量分数由37.45%升高到50.49%;伴随硫酸浓度增加,硫酸电离产生氢离子浓度增大;氢离子浓度增大不仅提高了二氧化锰的氧化能力[32],同时有利于可溶性锰化物释放正二价锰离子[33]。考虑到过大硫酸浓度会产生硫化氢,带来环境污染风险和安全问题,也不利于硫酸铅富集在渣中,选择1.5 mol/L 为最佳硫酸浓度,此时,浸出液pH为−0.77左右。
3.4 方铅矿用量
在硫酸浓度为1.5 mol/L、液固比为7.5 mL/g、浸出温度为100 ℃和浸出时间为120 min 的条件下,考察电解锰渣与方铅矿质量比对浸出锰和铅富集的影响,结果如图6(d)所示。由图6(d)可知:相比单一的硫酸体系浸出,加入方铅矿后锰浸出率从68.59%升至98.39%,表明方铅矿的存在有效将MnO2还原为Mn2+;反应平衡后方铅矿转化为硫酸铅富集在浸出渣中,使渣中的铅质量分数从44.53%增长为56.75%。针对电解锰渣与方铅矿质量比分别为10.0∶0.5 和10.0∶2.0 的浸出渣进行XRD分析,结果如图7所示。在电解锰渣与方铅矿质量比为10.0∶2.0 的浸出渣中可见PbS 的衍射峰,说明较大电解锰渣与方铅矿质量比提高铅产量,同时出现部分PbS没有被氧化为PbSO4的现象。为了避免硫化铅残留在浸出渣中,选择电解锰渣与方铅矿质量比为10∶1为最优工艺参数。
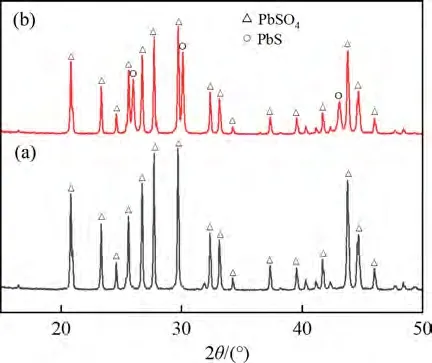
图7 不同电解锰渣与方铅矿质量比的浸出渣XRD图Fig.7 XRD patterns of leaching residue with different mass ratio of EMRs to galena
3.5 液固比
在硫酸浓度为1.5 mol/L、电解锰渣与方铅矿质量比为10∶1、浸出温度为100 ℃和浸出时间为120 min 的条件下,考察液固比对浸锰和铅富集的影响,结果如图6(e)所示。由图6(e)可见:液固比从5 mL/g 增加到15 mL/g 对锰的浸出率影响不大;但浸出渣中铅质量分数随液固比增大逐渐升高。产生这种现象的主要原因是H+增加促进SO2-4质子化,加剧了电解锰渣中硫酸钙溶解[34]。尽管此现象有利于铅富集,但过大的液固比将消耗大量硫酸并增加搅拌能耗。经综合考虑,选择7.5 mL/g为最佳液固比。

图6 不同工艺参数对锰浸出和铅富集的影响Fig.6 Effect of different process parameters on manganese leaching rate and lead enrichment
4 浸出液和浸出渣表征
通过单因素实验确定最佳工艺参数如下:电解锰渣与方铅矿质量比为10∶1,硫酸浓度为1.5 mol/L,液固比为7.5 mL/g,浸出温度为100 ℃,浸出时间为120 min。
浸出液主要金属成分如表2所示。由表2可见浸出液中锰质量浓度为5.86 g/L,铅质量浓度低于0.01 g/L,实现了锰和铅的有效分离。通常从浸出液提取锰的常用方法是碳酸盐沉淀法[8],采用此法的前提是溶液中无其他与碳酸根离子反应生成沉淀的金属离子。尽管碳酸锰溶度积常数(Ksp=2.24×10−11)远小于碳酸镁的溶度积常数(Ksp=6.82×10−6)和碳酸钙的溶度积常数(Ksp=3.36×10−9),但与碳酸亚铁的溶度积常数(Ksp=3.13×10−11)相近;同时浸出液pH 极低,碳酸根容易质子化,不利于生成碳酸锰沉淀。与碳酸盐沉淀法相比,将浸出液用于酸浸菱锰矿可解决上述问题,回收稀散锰的同时可减少产生废液,简化工艺流程。
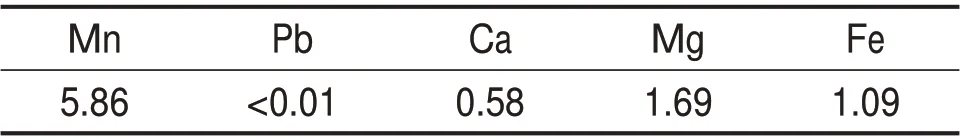
表2 浸出液的主要金属成分(质量浓度)Table 2 Main metal composition of leaching solution(mass concentration)g/L
浸出渣主要化学成分如表3 所示。由表3 可知:浸出后渣中锰质量分数为0.18%,浸出前锰质量分数为4.45%,浸出率为98.02%;铅质量分数由浸出前的25.5%富集至60%以上,且铜、锌、砷和硅等杂质质量分数均小于2%,符合YS/T319—2013“中国有色金属行业一级铅精矿的标准”的要求。

表3 浸出渣主要化学成分(质量分数)Table 3 Chemical composition of leaching residues(mass fraction)%
为了进一步考察浸出渣的矿物组成,对浸出渣进行XRD 分析,结果如图8 所示。从图8 可见:硫酸铅和熟石膏的衍射峰说明浸出过程中硫化铅基本全部转化为硫酸铅;生石膏在硫酸溶液中溶解,再结晶生成了熟石膏(CaSO4•0.5H2O)[35]。

图8 浸出渣XRD图Fig.8 XRD patterns of leaching residues
对浸出渣进行SEM-EDS 分析,结果如图9 所示。由图9 可见:Pb,Ca,Si 和S 存在较强特征峰,与浸出前的电解锰渣(图2)相比,Mn特征峰消失,说明锰的浸出效果明显;浸出后渣中仍可见石英(图9(b));硫酸铅和石膏互相包裹共生(图9(c));对比电解锰渣(图2(d))和浸出渣(图9(d))的点3发现二者化学组成相似,但前者形状是表面较光滑的块状,后者是表面布满孔隙的颗粒,说明后者是方铅矿反应生成的硫酸铅颗粒;这些后生成的微粒聚集在方铅矿的表面,最终形成更大的硫酸铅颗粒,说明铅和锰分离效果显著,浸出过程符合未反收缩核模型的假设。

图9 浸出渣SEM像及EDS图谱Fig.9 SEM image and EDS spectrums of leaching residues
对浸出渣进行XPS 分析,结果如图10 所示。通常Mn 2p轨道因自旋−轨道耦合作用会出现2个能级峰[36]。对比图10(a)中电解锰渣和浸出渣的Mn 2p轨道XPS 谱图,浸出渣中Mn 2p3/2和Mn 2p1/2在642.2 eV和653.9 eV附近并未出现双峰,说明方铅矿有效地将四价锰还原为二价锰,实现了铅和锰的分离。由图10(b)可见浸出渣中硫的形态与浸出前的形态基本相同,但峰面积比发生了变化;浸出前电解锰渣中SO2-4,S与S2-的峰面积比为111∶11∶7,浸出后渣中峰面积比变为30∶6∶5,表明负二价硫离子被氧化成单质硫,与理论分析结果一致。

图10 电解锰渣与浸出渣的XPS图Fig.10 XPS spectrums of EMRs and leaching residues
5 浸出动力学研究
5.1 动力学模型
电解锰渣中的锰在硫酸−方铅矿体系下浸出是复杂的液−固多相反应过程,浸出反应在二氧化锰和方铅矿表面发生,随着反应进行,反应面向颗粒中心收缩,因此,方铅矿还原二氧化锰的过程可以用未反应收缩核模型描述。浸出过程通常由外扩散、固体产物层内扩散和界面化学反应控制。由于浸出在电子搅拌下以恒定速度进行,外扩散阻力对浸出反应速率的影响可以忽略[37],因此,浸出速率由固体产物层内扩散、界面化学反应或者二者混合所控制。未反应收缩核模型速率方程如下[38−39]:
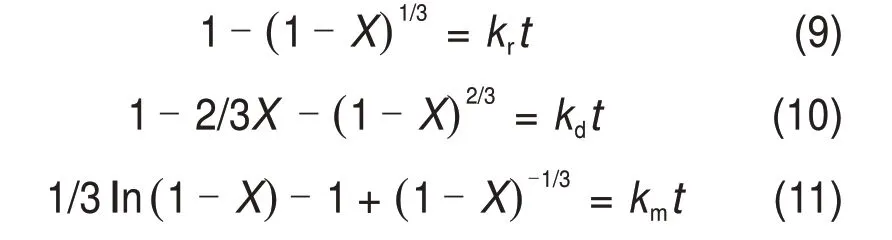
式中:kr,kd和km分别为界面化学反应、固体产物层内扩散和二者混合控制的反应速率常数,min−1;t为浸出时间,min;X为锰浸出率。反应过程中方铅矿表面会生成硫酸铅和单质硫,故浸锰过程大致符合上述3个方程中的至少1个。
5.2 拟合动力学方程
为了确定浸锰的控制步骤,在不同浸出温度分别进行浸出实验,实验结果如图11 所示。用式(9)~(11)拟合图11中的实验结果,其中,界面化学反应控制的速率方程的拟合度最高。以时间t为横坐标对1−(1−X)1/3作图,结果如图12所示。由图12可知:1−(1−X)1/3对时间t具有显著线性关系,不同温度对应的相关系数R2均大于0.95。图12 中直线斜率即为反应速率常数k。反应速率常数k与温度的关系满足阿仑尼乌斯(Arrhenius)方程:

图11 时间对锰浸出率的影响Fig.11 Effect of leaching time on manganese leaching rate

图12 不同温度下1−(1−X)1/3与时间t的关系Fig.12 Relationship between 1−(1−X)1/3 and time at different temperatures
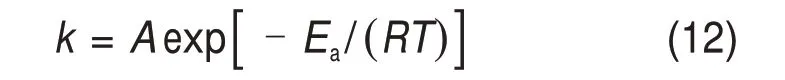
对阿伦尼乌斯方程两边同时取对数可得
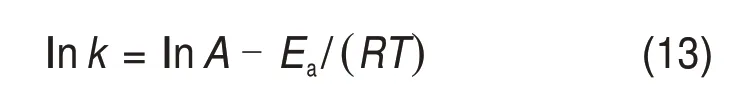
式中:A为频率因子;Ea为表观活化能,kJ/mol;R为摩尔气体常数,取8.314 J/(mol•K);T为浸出温度,K。以1/T为橫坐标对lnk作图,结果如图13所示。由图13确定表观活化能Ea为37.396 kJ/mol,频率因子A为1.988。
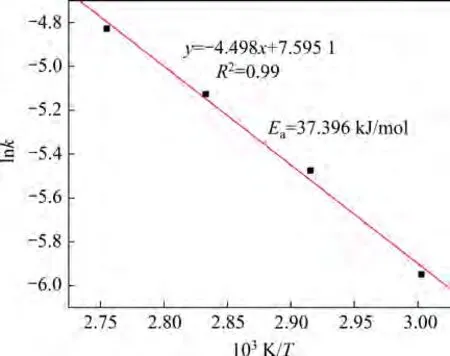
图13 lnk与1/T的关系Fig.13 Relationship between lnk and 1/T
综上表明:电解锰渣中的锰在硫酸−方铅矿体系中的浸出过程可以用未反应收缩核模型描述;表观活化能Ea为37.396 kJ/mol[40],SUN等[41]提出锰矿浸出活化能在12~42 kJ/mol范围内属于化学反应控制,因此,硫酸−方铅矿体系浸锰过程由界面化学反应控制,即高温条件下有利于活化分子的形成,提高反应速率;同时也说明反应生成的硫酸铅和单质硫固体产物层结构疏松,对浸出过程阻碍较小,这与AYDOĞAN 等[42]的研究结果一致。方铅矿浸出锰的宏观动力学方程如下:

6 结论
1)电解锰渣中主要有价金属是锰和铅,其中锰的物相是MnSO4,MnO 和MnO2,铅的物相是PbSO4,此外,电解锰渣还含有CaSO4•2H2O 和SiO2。浸出渣中主要物相是PbSO4,CaSO4•0.5H2O,S和SiO2;浸出反应过程中方铅矿中S2−被氧化为单质硫;生石膏水热反应后脱水形成熟石膏。
2) 在电解锰渣与方铅矿质量比为10∶1,硫酸浓度为1.5 mol/L,液固比7.5 mL/g,浸出温度为100 ℃,浸出时间为120 min 条件下,锰浸出率达到98.02%,浸出渣中的锰质量分数从4.45%降为0.18%;铅质量分数高于60%,达到一级铅精矿标准,实现铅和锰的高效富集。
3)硫酸−方铅矿体系浸出锰的反应过程符合未反应收缩核模型;浸出过程主要受界面化学反应控制,表明硫酸铅和单质硫产物层结构疏松,对锰浸出速率阻碍较小;由界面化学反应控制的表观活化能为37.396 kJ/mol;宏观动力学方程为1−(1−X)1/3=1.988exp[−37.396/(RT)]。

