Hsa_circ_0001946/miR-7/KLF4轴调控乳腺癌进展的研究
薛迪新 吴伟力 陈积贤 梁美珍 陈澄亮 贺新伟 余铭 林道浙
乳腺癌是我国女性常见的恶性肿瘤之一,其发病率及死亡率呈明显上升趋势。近年来,新的乳腺癌靶向药物层出不穷,明显改善了早期乳腺癌患者的预后,但是,局部晚期或者有转移的乳腺癌患者预后仍然较差。目前乳腺癌侵袭和转移的分子机制仍旧不明,寻找新的生物靶点对于改善乳腺癌患者的预后意义重大。miR-7是一种小分子miRNA,研究显示其在乳腺癌中表达异常,可抑制乳腺癌干细胞发生转移[1-2];研究还发现另一类非编码环状RNA(circular RNA,circRNA)可调控miRNA的表达,进而参与肿瘤的侵袭和转移[3]。为了寻找新的调控miR-7的circRNA,笔者利用starBase数据库(http://starbase.sysu.edu.cn/)进行检索,结果显示 hsa_circ_0001946与miR-7的结合位点最多,共有45个,因此,笔者预测hsa_circ_0001946可调控miR-7的表达。进一步检索文献发现,hsa_circ_0001946表达与非小细胞肺癌的侵袭和转移有关[4],而在乳腺癌中,hsa_circ_0001946表达与癌细胞侵袭和转移的机制尚未被阐明。研究显示肿瘤上皮细胞获得侵袭和转移能力往往伴随着上皮-间质转化(epithelial-mesenchymal transition,EMT),还伴随着E-钙黏蛋白(E-cadherin)和N-钙黏蛋白(N-cadherin)表达的变化[5]。因此,本研究探讨hsa_circ_0001946表达与乳腺癌细胞侵袭和转移的关系,并阐述癌细胞获得侵袭和转移的能力与EMT的关系,为乳腺癌治疗提供新的靶点。
1 材料和方法
1.1 组织标本的收集 收集2018年6月至2019年8月在温州医科大学附属第三医院切除的乳腺癌组织标本及其癌旁正常乳腺组织标本91例,将标本用液氮速冻,保存在-80℃冰箱中。所有患者均为女性,术前均未进行放化疗,乳腺癌分期根据2017年美国癌症联合委员会(AJCC)提出的第8版分期。其中乳腺导管原位癌9例,乳腺浸润性导管癌82例。在乳腺浸润性导管癌中,无淋巴结转移41例,有淋巴结转移41例(N1为22例,N2为8例,N3为11例)。本研究经医院医学伦理委员会审批通过。
1.2 主要试剂和仪器 乳腺癌细胞株MCF-7(中国自北纳生物公司);RPMI1640细胞培养基(美国Gibco公司);sh-hsa_circ_0001946及其阴性对照核苷酸、miR-7 mimics及其阴性对照寡核苷酸、Kruppel样因子 4(Kruppel-like factor 4,KLF4)小干扰 RNA(small interfering RNA,siRNA)及其阴性对照核苷酸(中国上海吉玛制药技术有限公司);Lipofectamine 2000、TRIzol试剂(美国Invitrogen公司);PrimeScriptTMRT reagent Kit、SYBRPremix Ex TaqTMⅡ(日本 TaKaRa公司);Matrigel(美国BD Bioscience公司);PVDF膜(美国Millipore公司);E-cadherin及N-cadherin一抗(美国Abcam公司);200倍显微镜(日本Olympus公司);RT-PCR仪(德国Biometra公司);7500实时荧光定量PCR仪(美国Applied Biosystems公司)。
1.3 细胞转染和分组 乳腺癌细胞株MCF-7接种于含10% FBS的RPMI1640培养基中,置于37℃,5% CO2培养箱中培养。采用Lipofectamine 2000进行细胞转染,转染前1 d将细胞接种至六孔板内,每孔1×106个细胞,转染时细胞长至90%融合。分别将Lipofectamine 2000和核苷酸加入到250 μl OPTI-MEM培养基中稀释,将稀释液混合,轻轻混匀,室温静置20 min,转染4~6 h后,细胞换液,转染24 h后,收集细胞检测miR-7、KLF4、E-cadherin、N-cadherin mRNA 表达及E-cadherin、N-cadherin 蛋白表达。细胞分组:(1)转染sh-hsa_circ_0001946组及阴性对照组:指转染sh-hsa_circ_0001946的乳腺癌MCF-7细胞组及转染阴性对照核苷酸的乳腺癌MCF-7细胞组,此组细胞分别采用实时荧光定量PCR法检测miR-7、KLF4 mRNA表达水平及采用Transwell侵袭实验检测侵袭细胞数。(2)转染miR-7 mimics组及其阴性对照组:指转染miR-7 mimics的乳腺癌MCF-7细胞组及转染阴性对照核苷酸的乳腺癌MCF-7细胞组,此组细胞采用实时荧光定量PCR法检测KLF4 mRNA的表达水平。(3)转染KLF4 siRNA组及其阴性对照组:指转染KLF4 siRNA的乳腺癌MCF-7细胞组及转染阴性对照核苷酸的乳腺癌MCF-7细胞组,此组细胞分别采用实时荧光定量PCR法和Western blot法检测E-cadherin、N-cadherin mRNA和蛋白表达水平。
1.4 hsa_circ_0001946、miR-7、KLF4、E-cadherin、N-cadherin mRNA表达水平检测 采用实时荧光定量PCR法。总RNA提取采用TRIzol试剂,乳腺组织用液氮研磨,细胞直接用TRIzol试剂进行裂解,提取的总RNA保存在4℃冰箱供后续的逆转录及实时荧光定量PCR使用。采用PrimeScriptTMRT reagent Kit进行逆转录,反应条件如下:37℃ 15 min,85℃ 5 s,4℃保存;实时荧光定量PCR采用SYBRPremix Ex TaqTMⅡ,20 μl体系参照说明书,反应条件如下:95 ℃ 30 s,95 ℃5 s,60℃ 34 s,共40个循环,所有实验重复 3次,以β-actin为内参。RT-PCR的引物如下:miR-7茎环引物:5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACAACAAAAT-3',正向引物:5'-ACACTCCAGCTGGGTGGAAGACTAGTGAT-3',反向引物:5'-TGGTGTCGTGGAGTCG-3';hsa_circ_0001946 正向引物:5'-GAAAATCCACATCTTCCAGACAA-3',反 向 引物:5'-GAAGACATGGATATTGAGCCAGT-3';KLF4 正向引物:5'-TTCCCATCTCAAGGCACACC-3', 反 向 引 物 :5'-CATGTGTAAGGCGAGGTGGT-3';E-cadherin 正 向 引物:5'-CCTTCACAGCAGAACTAACA-3',反向引物:5'-CGCTTTCAGATTTTCATCAA-3';N-cadherin 正向引物:5'-ATTGGACCATCACTCGGCTTA-3', 反 向 引 物:5'-CACACTGGCAAACCTTCACG-3';β-actin 正向引物:5'-TAGTTGCGTTACACCCTTTCTTG-3',反向引物:5'-TCACCTTCACCGTTCCAGTTT-3'。 采 用 2-ΔΔCt法 计 算RNA的相对表达量。
1.5 细胞侵袭能力检测 采用Transwell侵袭实验。使用Matrigel包被Transwell小室底部膜的上室面,置37℃ 30 min使Matrigel聚合成凝胶,撤血清让细胞饥饿12 h,制备细胞悬浊液。取细胞悬液100 μl加入Transwell小室,24孔板下室加入500 μl含10%FBS的培养基,培养细胞24 h,取出Transwell小室,弃掉孔中培养液,用无钙的PBS洗2遍,甲醛固定30 min,将小室适当风干,在200倍显微镜下随机选取3个视野对侵袭的细胞进行计数。
1.6 E-cadherin及N-cadherin蛋白表达水平检测采用Western blot法。使用RIPA裂解液裂解细胞,收集完蛋白样品后,使用BCA蛋白浓度测定试剂盒进行蛋白质浓度测定,用SDS-PAGE电泳分离总蛋白,转染到PVDF膜上,转膜完毕后,立即把蛋白膜放置到预先准备好的Western洗涤液中,漂洗1~2 min,以洗去膜上的转膜液,加入Western封闭液,在摇床上缓慢摇动,室温封闭 60 min。然后用 E-cadherin(1∶1 000)及N-cadherin(1∶3 000)一抗孵育,4 ℃过夜,加入洗涤液,在摇床上缓慢摇动洗涤5~10 min,吸尽洗涤液后,再加入洗涤液,洗涤5~10 min,共洗涤3次,二抗孵育,显影,用胶片进行拍照。Western blot条带的灰度值采用Image J软件进行分析。
1.7 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,组间比较采用两独立样本t检验,乳腺癌组织及癌旁正常乳腺组织比较采用配对t检验。采用Pearson相关分析乳腺癌组织中hsa_circ_0001946、miR-7、KLF4 mRNA表达水平的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织及癌旁正常乳腺组织中hsa_circ_0001 946、miR-7、KLF4 mRNA表达水平比较 与癌旁正常乳腺组织比较,乳腺癌组织中hsa_circ_0001946和KLF4 mRNA表达水平均升高,miR-7表达水平下降,差异均有统计学意义(均P<0.05),见表1。

表1 乳腺癌组织及癌旁正常乳腺组织中hsa_circ_0001946、miR-7、KLF4 mRNA表达水平比较
2.2 乳腺癌组织中hsa_circ_0001946的表达与乳腺癌浸润和转移的关系 正常乳腺组织、乳腺导管原位癌组织、乳腺浸润性导管癌组织中hsa_circ_0001946 mRNA 表达水平分别为 0.686±0.458、0.628±0.216、1.256±0.614。与正常乳腺组织、乳腺导管原位癌组织比较,乳腺浸润性导管癌组织中hsa_circ_0001946 mRNA表达水平升高,差异均有统计学意义(t=7.126和6.348,均P<0.05);而正常乳腺组织和乳腺导管原位癌组织中hsa_circ_0001946 mRNA表达水平比较差异无统计学意义(t=0.668,P>0.05),提示hsa_circ_0001946表达的升高与乳腺癌细胞的癌变无关,而与乳腺癌细胞发生浸润有关,见图1a。
进一步分析82例乳腺浸润性导管癌患者,结果发现有淋巴结转移者hsa_circ_0001946 mRNA表达水平为1.425±0.732,高于无淋巴结转移者的1.087±0.411,差异有统计学意义(t=-2.575,P<0.05),提示 hsa_circ_0001946表达升高与乳腺癌转移有关,见图1b。
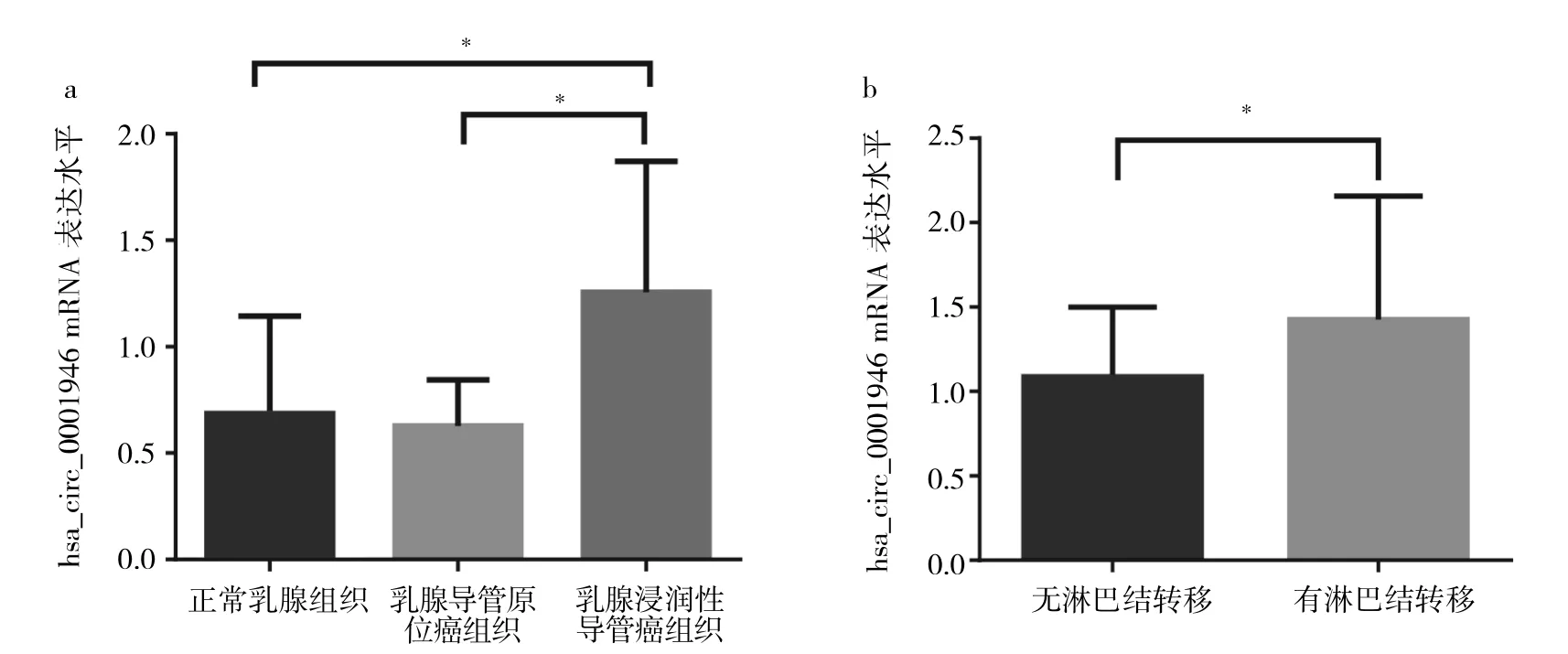
图1 乳腺癌组织中hsa_circ_0001946的表达与乳腺癌浸润和转移的关系(a:正常乳腺组织、乳腺导管原位癌组织、乳腺浸润性导管癌组织中hsa_circ_0001946 mRNA表达水平比较;b:有无淋巴结转移的乳腺浸润性导管癌组织中hsa_circ_0001946 mRNA表达水平比较;*P<0.05)
2.3 乳腺癌组织中 hsa_circ_0001946、miR-7、KLF4 mRNA表达的相关性分析 Pearson相关显示,乳腺癌组织中hsa_circ_0001946 mRNA的表达与miR-7的表达呈负相关(r=-0.418,P<0.05),miR-7 的表达与 KLF4 mRNA mRNA 的表达呈负相关(r=-0.340,P<0.05),提示在乳腺癌组织中,存在hsa_circ_0001946/miR-7/KLF4的调控轴,见图2。
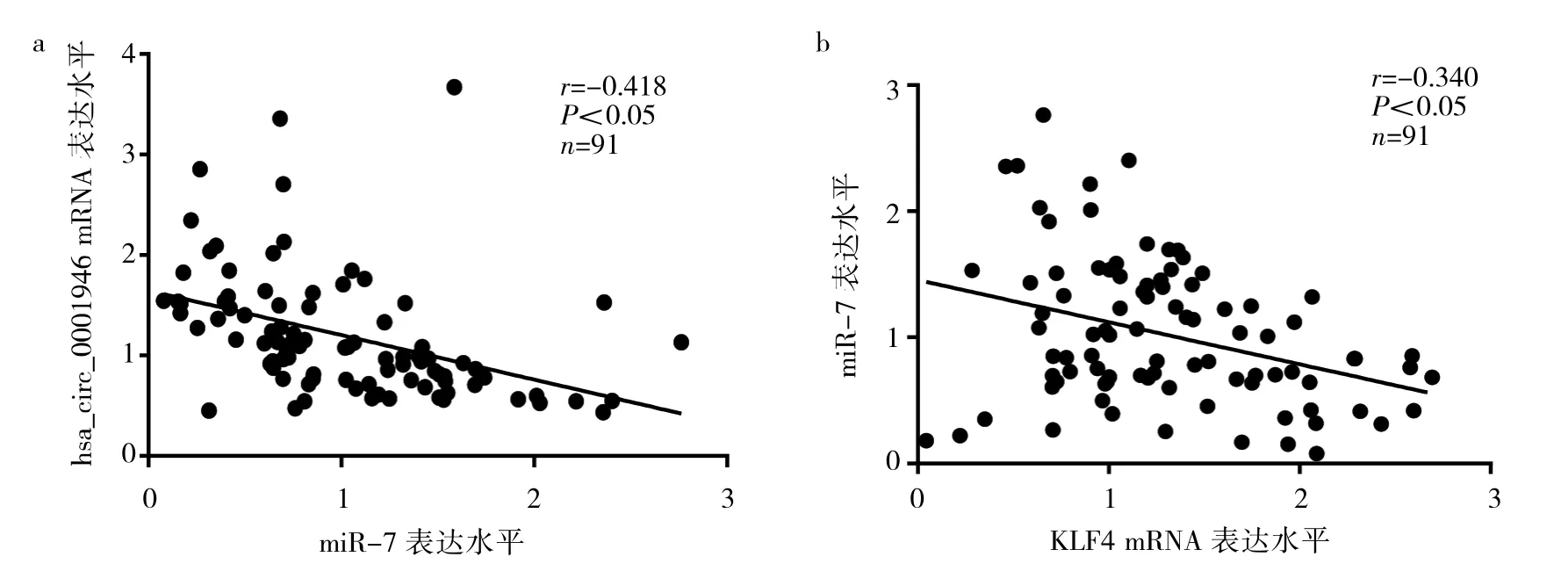
图2 乳腺癌组织中hsa_circ_0001946、miR-7、Kruppel样因子4(KLF4)mRNA表达的散点图(a:乳腺癌组织中hsa_circ_0001946与miR-7表达的散点图;b:乳腺癌组织中miR-7与KLF4 mRNA表达的散点图)
2.4 转染sh-hsa_circ_0001946组及其阴性对照组中miR-7、KLF4 mRNA表达水平比较以及转染miR-7 mimics组及其阴性对照组中KLF4 mRNA表达水平比较 转染sh-hsa_circ_0001946组miR-7表达水平为2.119±0.135,高于阴性对照组的 0.675±0.139,差异有统计学意义(t=-22.351,P<0.05);而转染 sh-hsa_circ_0001946组 KLF4 mRNA表达水平为 0.752±0.088,低于阴性对照组的1.694±0.141,差异有统计学意义(t=16.965,P<0.05)。转染 miR-7 mimics组 KLF4 mRNA表达水平为0.532±0.151,低于阴性对照组的1.619±0.138,差异有统计学意义(t=15.966,P<0.05)。上述结果提示在乳腺癌细胞株MCF-7中,存在hsa_circ_0001946/miR-7/KLF4的调控轴。
2.5 转染sh-hsa_circ_0001946组及其阴性对照组侵袭细胞数比较 转染sh-hsa_circ_0001946组侵袭细胞数为54.220±12.686,少于阴性对照组的153.986±16.733,差异有统计学意义(t=14.255,P<0.05),表明在乳腺癌细胞中,通过抑制hsa_circ_0001946的表达,可抑制癌细胞发生侵袭,见图3(插页)。

图3 转染sh-hsa_circ_0001946组及其阴性对照组侵袭细胞数比较(a:转染sh-hsa_circ_0001946组;b:阴性对照组)
2.6 转染KLF4 siRNA组及其阴性对照组中E-cadherin、N-cadherin mRNA和蛋白表达水平比较 转染KLF4 siRNA组E-cadherin mRNA和蛋白表达水平均高于阴性对照组,N-cadherin mRNA和蛋白表达水平均低于阴性对照组,差异均有统计学意义(均P<0.05),提示转染KLF4 siRNA组中癌细胞的EMT受到抑制,见表2和图4。

图4 转染Kruppel样因子4(KLF4)小干扰RNA(siRNA)组及其阴性对照组中E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)蛋白表达的电泳图(a:E-cadherin;b:N-cadherin)
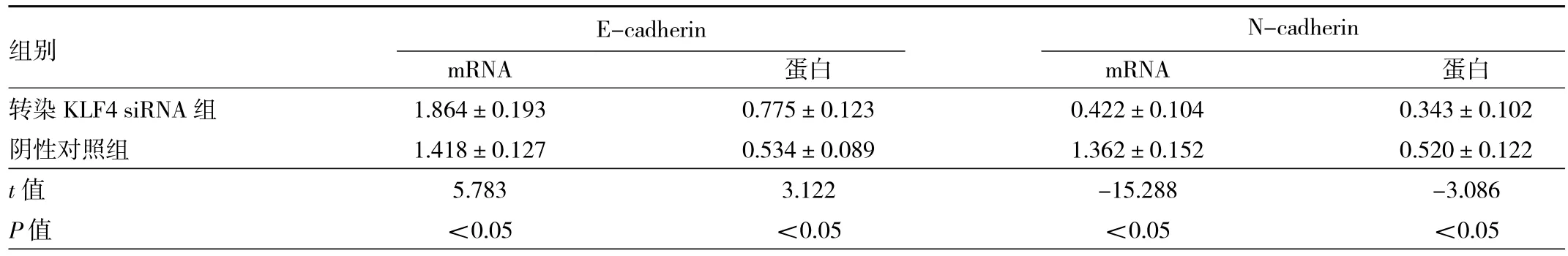
表2 转染KLF4 siRNA组及其阴性对照组中E-cadherin、N-cadherin mRNA和蛋白表达水平
3 讨论
circRNA是一种非编码RNA,缺乏5'和3'末端,曾被认为没有生物学功能。而近年来,越来越多的circRNA的生物学功能被发现,研究显示,许多circRNA在肿瘤中出现异常表达[6-7],并参与肿瘤的发生和发展,包括细胞的增殖、侵袭和转移[8]。进一步研究显示,circRNA是通过海绵作用,抑制miRNA的功能,进而调节癌基因或者抑癌基因的表达来发挥生物学效应。Liu等[9]研究显示,乳腺癌细胞及组织中hsa_circ_001783表达升高,通过沉默hsa_circ_001783的表达,可抑制乳腺癌细胞的增殖和侵袭,进一步研究发现hsa_circ_001783是通过海绵吸附miR-200c-3p来发挥作用的。
近年研究显示,miR-7通过抑制ESAM的表达来抑制乳腺癌干细胞发生转移[2];研究还显示许多circRNA可调控miR-7的表达,例如hsa_circRNA_0006528[10]、circ-TPGS2[11]、Circ-TFCP2L1[12],那么,是否还存在其他circRNA来调控miR-7的表达呢?为了寻找新的具有调控miR-7的circRNA,笔者利用starBase数据库(http://starbase.sysu.edu.cn/)进行检索,结果显示,在5大miRNA靶基因预测数据库中(targetScan、picTar、RNA22、PITA、miRanda) 共有 784 条 circRNA,其中hsa_circ_0001946与miR-7的结合位点最多,共有45个可供结合的位点,表明hsa_circ_0001946与miR-7具有很高的结合效率,更为有效地调控miR-7的表达。因此笔者预测hsa_circ_0001946的靶点为miR-7。
miR-7是一种非编码小RNA,可负性调控靶基因的表达,来抑制肿瘤的侵袭和转移。Zhu等[13]研究显示miR-7-5p可通过负性调控METTL7B靶基因,来抑制甲状腺乳头状癌细胞的增殖和侵袭。Zheng等[14]研究显示miR-7-5p可通过抑制靶基因OGT的表达,来抑制结直肠癌癌细胞的侵袭和转移。Huang等[15]研究显示KLF4是miR-7的靶基因,miR-7通过负性调控KLF4的表达来调控食管鳞状细胞癌的侵袭和转移。同样,Dong等[16]在大肠癌中的研究也显示KLF4是miR-7的靶基因。而在乳腺癌细胞中,研究显示miR-7表达下降[1],KLF4表达升高[17],提示在乳腺癌细胞中,KLF4也可能是miR-7的靶基因,进一步检索相关文献发现,在乳腺癌干细胞中miR-7表达下降,通过负性调节靶基因KLF4,导致癌基因 KLF4表达升高,促进癌细胞向颅脑转移[18]。
众所周知,干细胞在乳腺癌组织中比例极低,上述提到miR-7在干细胞中表达下降使其具有转移潜能,而在乳腺癌组织中占绝大比例的普通癌细胞中,其miR-7表达下降,是否也可通过上调KLF4的表达,促进癌细胞的侵袭和转移呢?因此,本研究提出如下假设:在普通乳腺癌细胞中存在一条新的调控轴,即hsa_circ_0001946/miR-7/KLF4,上述的调控轴可调节乳腺癌细胞发生侵袭和转移。
本研究显示在91例乳腺癌组织中,hsa_circ_0001946表达升高,miR-7表达下降,KLF4 mRNA表达升高。本研究还显示hsa_circ_0001946在乳腺浸润性导管癌中表达明显高于乳腺正常组织,提示hsa_circ_0001946表达的升高可促进乳腺癌发生侵袭。本研究还发现在有淋巴结转移的乳腺癌组织中hsa_circ_0001946表达明显高于无淋巴结转移的乳腺癌组织,提示hsa_circ_0001946表达升高可促进乳腺癌发生转移。进一步研究发现,在乳腺癌组织中miR-7的表达与hsa_circ_0001946、KLF4的表达均呈负相关,上述结果提示在乳腺癌组织中存在hsa_circ_00019 46/miR-7/KLF4调控轴,调控着乳腺癌细胞的侵袭和转移。
本研究继续在细胞水平验证hsa_circ_0001946、miR-7、KLF4的调控关系,通过转染实验发现在乳腺癌细胞株MCF-7中存在hsa_circ_0001946/miR-7/KLF4的调控轴。为了进一步验证hsa_circ_0001946表达与乳腺癌细胞侵袭的关系,本研究采用Transwell侵袭实验,通过抑制hsa_circ_0001946的表达,可抑制癌细胞发生侵袭,因此,在乳腺癌细胞水平中也存在hsa_circ_0001946/miR-7/KLF4的调控轴,此调控轴与癌细胞的侵袭有关。
KLF4是一种转录因子,有研究认为KLF4具有抑癌基因的功能[19]。在胃癌细胞中,KLF4的表达可促进胃癌细胞发生EMT,促进癌细胞发生转移[20]。在头颈部鳞状细胞癌中,KLF4表达也与肿瘤的EMT有关[21]。EMT指上皮细胞失去细胞之间的连接,获得间叶细胞的表型及侵袭、转移的能力,EMT期间伴随着上皮细胞标志物E-cadherin和细胞角化蛋白表达的下降,间叶细胞标志物波形蛋白和N-cadherin表达的升高[5],本研究探讨在乳腺癌细胞中KLF4的表达与EMT的关系,结果显示,与阴性对照组相比,转染KLF4 siRNA组MCF-7细胞中E-cadherin mRNA及蛋白表达水平均升高,而N-cadherin mRNA及蛋白表达水平均下降,提示KLF4的表达可促进乳腺癌细胞发生EMT,从而引起乳腺癌细胞发生侵袭和转移。
综上所述,在乳腺癌细胞中存在hsa_circ_0001946/miR-7/KLF4调控轴,激活上述调控轴,可使癌细胞中hsa_circ_0001946表达升高,使癌细胞发生EMT,进而促进乳腺癌细胞发生侵袭和转移。

