模拟酸雨作用下红壤中铁铝形态变化机制研究
田文杰, 王小庆, 刘红茹, 师界平, 金于涛, 杨东霞
(1.洛阳理工学院 环境工程与化学学院, 河南 洛阳 471023; 2.濮阳市环境保护科学研究所, 河南 濮阳 457000; 3.河南倚淼环保科技有限公司, 河南 洛阳 471002; 4.洛阳市质量计量检测中心, 河南 洛阳 471003)
铝和铁是土壤中最丰富的金属元素,它们在土壤中的存在形态主要有交换态、有机络合态、无定形态和结晶态等[1-3]。土壤中铁铝的存在形态影响土壤的结构和性质,更重要的是不同形态铁铝的生物有效性及其对土壤中有机质及有机污染物吸附量也不同,进而影响人类和生物生存的生态环境[4-6]。酸雨是当今世界面临的最重要的生态环境问题之一,我国已成为继欧美之后的第三大酸雨区,以湖南和江西为代表的华中酸雨区目前是我国酸雨污染最严重的区域之一[7-9]。湖南土壤大部分是红壤,含有大量粘粒,高岭石、铁铝氧化物含量也较高,pH较低,缓冲容量小,对酸雨较敏感[10,11]。长期酸沉降导致红壤酸化和红壤中铁铝的释放,进而对红壤微结构产生重要影响[12-15]。目前,国内外学者的研究主要集中在酸雨作用下活性铝铁的溶出及其生物有效性,对酸雨作用下红壤中铁铝形态变化机制研究较少[16-19]。本文采用模拟酸雨浸泡实验,探讨了酸雨作用下红壤中铁铝形态的变化机制,有助于理解酸雨对土壤微结构变化及土壤中污染物释放机制的影响。
1 材料与方法
1.1 供试土壤
供试土壤采自湖南某焦化厂炼焦车间附近(27°52.965′N,113°05.265′E)0~20 cm表层土,当地年平均气温18 ℃,年平均降雨量1 250 mm。样品采用多点混合取样法,采集后经自然风干,去除植物残体、砾石,研磨,全部通过2 mm筛孔后待用。供试样品部分理化性质如表1所示。

表1 供试土壤样品部分理化性质
1.2 模拟酸雨(SAR)的制备
湖南省是我国酸雨污染最严重的区域之一,部分地区年降酸雨频率高达90%以上,几乎到了逢雨必酸的程度[20]。我国酸雨pH值低、离子浓度高,硫酸根(SO42-)、氨(NH4+)、钙离子(Ca2+)浓度高于欧美国家,而硝酸根(NO3-)浓度则低于欧美国家,属硫酸型酸雨。吴甫成等对湖南省降水的离子组成进行分析,H+、NH4+、Ca2+和SO42-是降水中的主要离子[21]。为了模拟湖南地区降雨,本研究控制酸雨中SO42-与NO3-物质的量浓度比为4∶1,按CaSO4∶(NH4)2SO4∶MgSO4∶NaNO3∶NH4Cl∶NaCl∶KF物质的量比为33∶22∶5∶15∶15∶6∶8,配制稀盐混合溶液,用硫酸与硝酸物质的量之比4∶1的酸溶液和去离子水(pH约为6.64)调节溶液pH值为2.5、3.5、4.5和5.6,配制4个不同酸度的模拟酸雨液,模拟酸雨溶液中各离子浓度如表2所示。
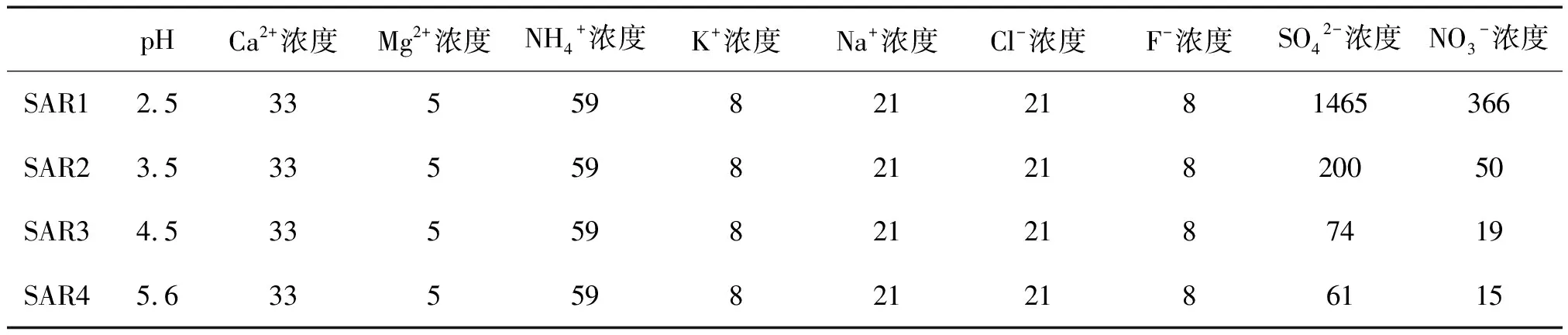
表2 模拟酸雨离子浓度表 单位:μmol/L
1.3 模拟酸雨浸泡实验
称取50.0 g供试红壤放入锥形瓶中,分别加入一定体积不同pH值的模拟酸雨(模拟酸雨的pH值分别为2.5、3.5、4.5、5.6),设定液固比为5∶1,置于恒温振荡器(25 ℃,160 r·min-1)中连续浸泡3 d、6 d、9 d、12 d、15 d、18 d、21 d和24 d。浸泡后的土壤在离心机中进行固液分离,离心机转速为10 000 r·min-1,离心时间为5 min,离心后的土样经冷冻干燥后提取并分析其不同形态和总铁铝的浓度和总有机碳含量(TOC)。由于结晶态对土壤性质尤其是污染物的赋存分布影响较小,本研究中没有测定和分析结晶态铁铝,提到的各种形态也不包括结晶态。每一酸度设置3个平行样。
1.4 红壤中不同形态铁铝的提取与测定[22]
(1)交换态Fe/Al的提取
准确称取5.00 g土样于100 mL塑料离心管中,加入50 mL 1.0 mol·L- 1的KCl溶液(pH=5.8),在恒温振荡器中振荡30 min,然后在离心机中离心5 min,设置离心机转速为3 000 r·min-1,上清液倒入200 mL三角瓶中加塞待用。
1.0 mol·L- 1KCl溶液的配置:称取74.5 g KCl倒入1 L容量瓶中后用去离子水定容,后用1% HNO3调节pH为5.8。
(2)无定形态Fe/Al的提取
称取3.0 g土壤样品置于500 mL离心瓶中,加入0.2 mol·L-1草酸铵溶液(pH=3.0)150 mL,加塞。此时离心瓶中的土液比为1∶50,然后将离心瓶装入避光袋中,在恒温振荡器中振荡2 h后,再在离心机上进行离心分离。设置离心机的转速为3 000 r·min-1,时间为5 min,离心后将上清液倾入三角瓶中加塞备用。
草酸铵溶液配置:称取草酸(H2C2O4·2H2O)12.6 g和草酸铵[(NH4)2C2O4·H2O]24.87 g溶解于800 mL水中,用稀草酸和氨水调节pH至3.2,定容至1 L。
(3)络合态Fe/Al的提取
称取土壤样品3.0 g置于三角瓶中,按土液比为1∶20加入新鲜配制的0.1 mol·L-1焦磷酸钠溶液60 mL(内含1 mol·L-1Na2SO4,pH=8.5),于25 ℃ ± 1 ℃恒温下连续振荡2 h,然后放入100 mL离心管中2 500 r·min-1离心5 min,将清液倾入150 mL三角瓶中,加塞备用。
焦磷酸钠溶液配置:称取焦磷酸钠(Na4P2O7·10H2O)44.6 g溶解于40 g·L-1硫酸钠溶液并定容至1 L。用10%氢氧化钠和1∶4磷酸调节溶液pH至8.5,溶液应随配随用。
硫酸钠溶液:称取硫酸钠(Na2SO4·10H2O)40.0 g溶于水中,定容至1 L。
各形态铁铝提取液通过0.45 μm滤膜后用ICP-MS测定。
2 结果与讨论
2.1 酸雨对土壤pH的影响
土壤对酸沉降具有一定的缓冲作用[23],且缓冲作用包括初级缓冲体系和次级缓冲体系。初级缓冲体系表现为土壤阳离子,主要为盐基离子(K+、Na+、Ca2+和Mg2+)的交换反应。伴随着盐基离子的大量淋失,初级缓冲体系缓冲能力减弱或耗尽,土壤对输入质子的缓冲作用向次级缓冲体系过渡。初级缓冲体系的离子交换反应较快但缓冲能力小,次级缓冲体系的缓冲能力较大但其矿物风化的动力学反应较慢。土壤矿物风化过程主要表现为土壤中原生及次生铝硅酸盐的酸性水解,在该过程中除Al3+和Si(OH)4外,同时伴随有盐基离子的释放,补偿可溶态和交换态盐基的淋失。模拟酸雨作用下土壤溶液pH变化如图1所示。从图1可看出,当pH≥3.5时,在浸泡8个梯度的时间内溶液的pH维持在4.4左右,pH=2.5的浸泡液pH在3.8左右。由于最短的浸泡时间为72 h,可以认为浸泡时溶液处于完全平衡状态。浸泡液的pH先有一个小的上升,接着就下降,说明开始是初级缓冲体系起作用,平衡浸泡溶液的pH都比较低,认为酸已经破坏土壤的初级缓冲体系和次级缓冲体系,土壤已经丧失了抗酸化能力。本研究所用的模拟酸雨属于硫酸型酸雨,浸泡土壤时,由于酸雨中SO42-的专性吸附作用可以配位交换出羟基,导致土壤浸泡液pH值较高,这可能是浸泡液pH值保持一定水平的另一个原因。
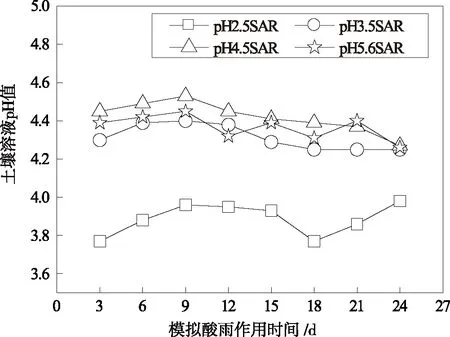
图1 模拟酸雨作用下土壤溶液pH变化
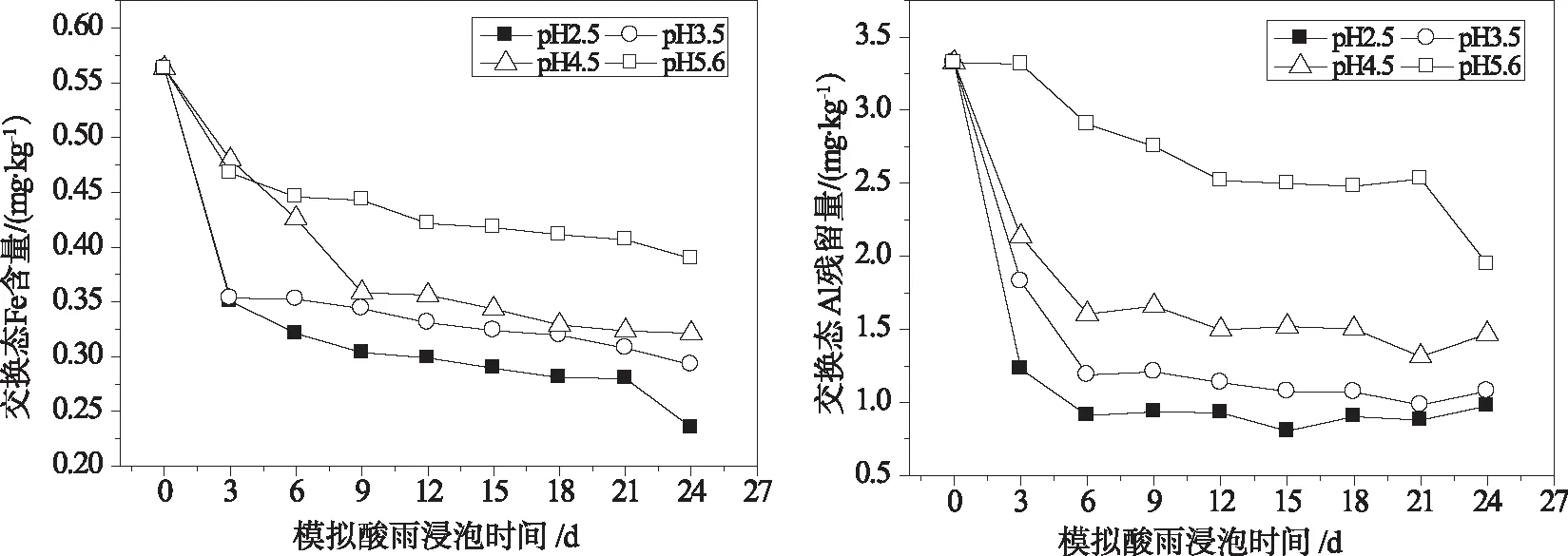
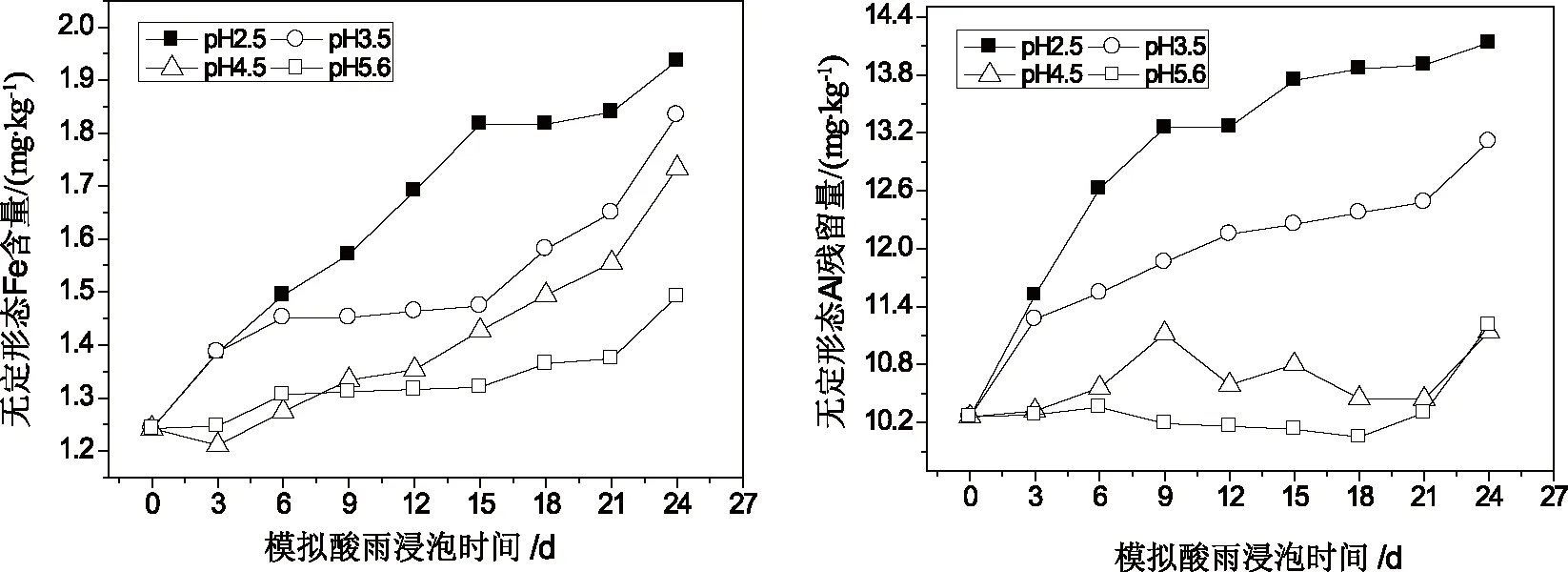
2.2 酸雨对红壤中铁铝形态变化的影响
红壤中不同形态的铝铁含量随模拟酸雨的酸度、作用时间的变化关系如图2~图4所示。由图2~图4可知,在酸雨作用下,红壤中交换态和络合态铁铝含量均较浸泡前有所降低,随模拟酸雨作用时间的增加,红壤中交换态和络合态铁铝含量不断下降,浸泡初期下降的速度较快,在浸泡后期,红壤中交换态和络合态铁铝含量随浸泡时间变化较为平缓,而无定形铁铝的含量却较酸雨作用前有所升高且随模拟酸雨作用时间的增加而不断增加,表明在酸雨作用下红壤中铁铝的形态发生相互转化。在酸雨作用下相当于向土壤中输入H+,交换态铁铝很难在土壤中保持残留,同时H+作用促使土壤有机质的释放,且在低pH条件下有机质与铁铝的络合能力较弱,表现为酸雨作用后交换态、络合态铁铝含量减低;而无定形态铁铝含量增加可能与土壤pH处在交换体缓冲体系(pH约4.2~5.0)和铁铝氧化物缓冲体系(pH约3.0~4.2)范围内有关[24]。在交换体缓冲体系中,H+通过与铝硅酸盐矿物晶格铝作用转化为交换性铝或羟基铝多聚物,而在铁铝氧化物缓冲体系中,H+与晶层间羟基铝聚合物进一步作用,形成较简单的羟基铝离子,所以酸雨作用下加入土壤中的H+主要转化为羟基铝离子并吸附在土壤表面或粘粒矿物的层间或边面,这种形态的铁铝不容易被1.0 mol/L的KCl所交换解析,只有在H+作用下破坏Al—OH—Al键,使多聚体解离才能被提取出来[25]。
(a)铁残留量的变化 (b)铝残留量的变化
(a)铁残留量的变化 (b)铝残留量的变化
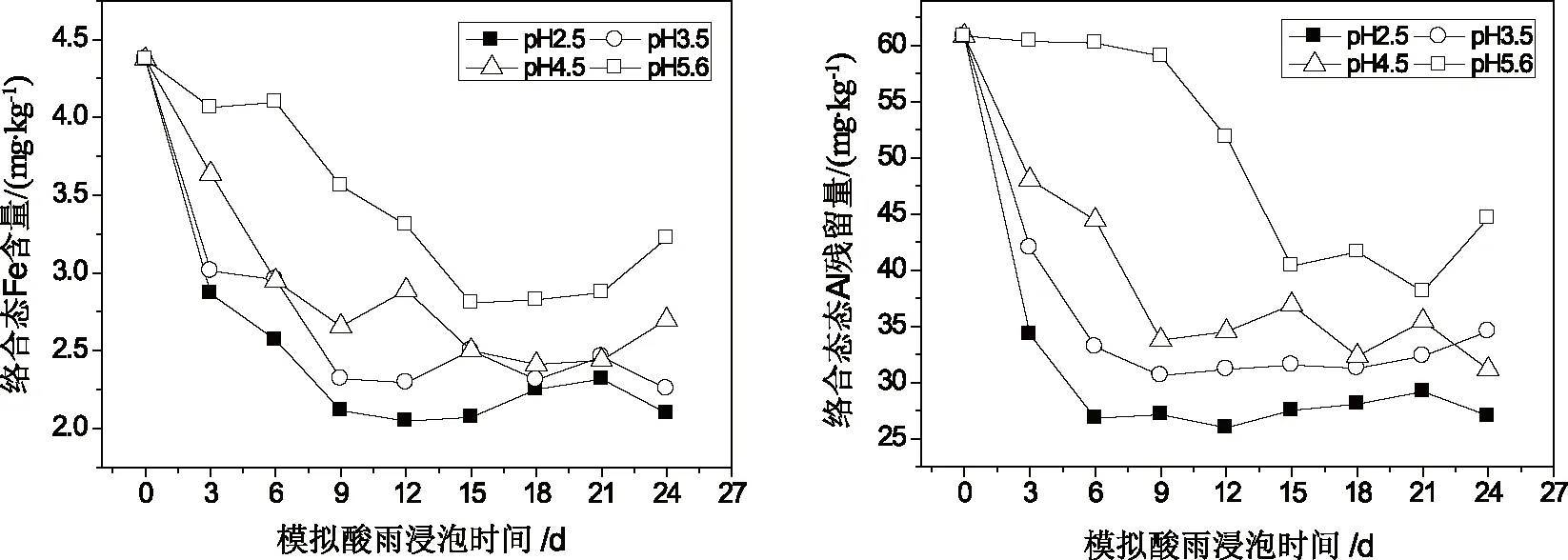
(a)铁残留量的变化 (b)铝残留量的变化
同时,酸雨酸度对土壤中铁铝形态变化也有一定影响,酸雨的酸度越大,红壤中各形态铁铝的变化也越明显,这是由土壤酸化不同阶段的化学反应决定的。当溶液pH高于4时,土壤中离子的释放主要是以离子交换反应为主,而当pH值低于4时,阴离子吸附、矿物风化和铁铝氧化物的溶解等均会对土壤中离子的释放产生影响。因为强酸不仅加剧了原生矿物的风化,同时也促进了次生矿物的溶解,当pH较低的酸溶液作用于红壤时,相当于向红壤中输入了大量的H+,致使红壤中交换性阳离子被迅速地释放出来;当红壤阳离子释放量大于其CEC值时,红壤中的粘土矿物(主要是1∶1型高岭石)开始溶蚀,土壤转化为以氧化物为主的质子缓冲范围,从而导致红壤中铁铝释放量的急剧增加。此外,酸雨作用下,土壤中铁铝氧化物的形态变化还与土壤中有机质含量的变化有关[26]。
2.3 红壤中有机质的残留与溶出
酸雨作用下,红壤中有机质的残留与溶出不仅与有机质本身的性质有关,还与红壤中粘粒矿物尤其是铁铝氧化物的性质有关。因为铁铝氧化物是红壤中有机质稳定保持的关键因素,红壤中铁铝氧化物性质的变化也可反映出土壤中有机质含量和性质的变化[27]。模拟酸雨浸泡后红壤中有机质含量随浸泡时间的变化趋势如图5所示。由图5可知,用不同pH值的模拟酸雨浸泡红壤,浸泡后红壤中有机质含量均较浸泡前有不同程度的减小,且随着浸泡时间的增加,红壤中有机质不断地被释放出来。也就是说,经过酸雨浸泡后,红壤中的有机质含量在不断降低;同样,经酸雨浸泡后红壤中铁铝含量总的趋势也在不断降低。分析酸雨作用下红壤中有机质和铁铝氧化物含量降低的原因,主要有以下几个方面:首先,在酸雨作用下,当红壤中有机质发生溶解的同时,部分结晶铁铝氧化物也转化为水溶性铁铝,这些水溶性铁铝再经水解转化成无定形的铁铝氢氧化物;其次,溶解有机质如富里酸较易吸附于水合氧化物的表面,阻碍了铁铝氧化物晶核的形成,抑制铁铝氧化物结晶的形成和转化,从而显著地提高了红壤中铁铝氧化物的活化度。尽管无定形铁铝的增加有助于有机质的保持,但红壤中无定形铁铝含量与交换态铁铝的含量相比较要低得多,它对红壤中有机质含量的调控能力非常有限,所以有机质含量总体呈降低的趋势;此外,在酸雨浸泡红壤时,不仅向红壤中输入了大量的H+,同时也向红壤中输入了大量的SO42-和NO3-,而SO42-、NO3-也会与红壤中有机质竞争,进而影响了铁铝氧化物对有机质的吸附,不利于有机质在土壤中的残留[28]。
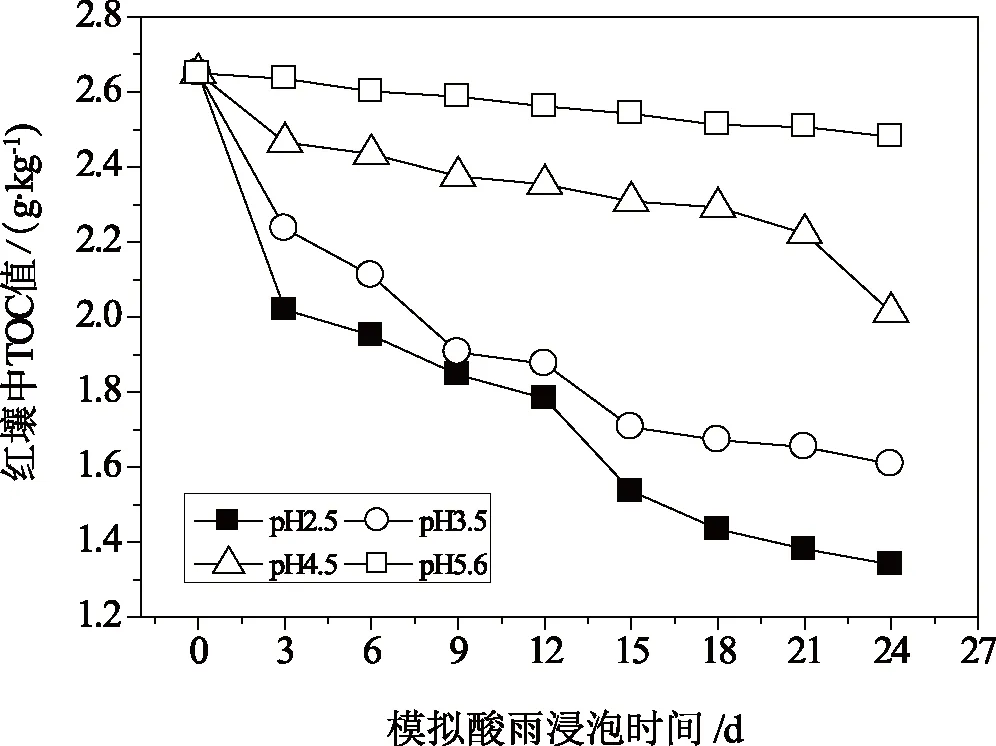
图5 红壤中TOC随模拟酸雨浸泡时间的变化
2.4 酸雨作用下土壤中铁铝形态变化与土壤有机质含量的关系
模拟酸雨作用下红壤中铁铝形态与土壤残留有机质相关性如图6所示。由图6可知,酸雨作用下,红壤中不同形态铁、铝含量与土壤中残留有机含量相关性相似,其中交换态、络合态铝铁与土壤有机质呈显著非线性相关(R2=0.994和0.968),络合态铝铁与土壤有机质也呈显著非线性相关(R2=0.975和0.932),而无定型态铝铁与土壤有机质呈显著线性相关(R2=0.962和0.962),表明在酸雨作用下土壤中铁铝的存在形态与土壤中残留有机质有关。随模拟酸雨平衡浸泡,酸雨中H+和其他阳离子与土壤中游离铝、铁和胶体表面可交换性铝铁在浸泡作用下通过离子交换作用与浸出液中铝铁保持动态平衡。土壤中固相铝铁在模拟酸雨作用下转化成活性铝铁,释放出来的活性态铝铁在酸性土壤中形成一系列带不同电荷、不同组成的铝铁羟基水合离子,使得激活的大部分铝离子、亚铁离子形成络合离子或吸附在土壤粘粒表面阳离子交换位置上,而土壤粘粒中含有大量土壤有机质,表现为无定型铝铁与土壤有机质呈显著线性相关[29]。同时,在土壤中,铁铝氧化物通常以胶膜状包覆在土壤颗粒的表面,当其由溶胶转变为凝胶时,便将土壤颗粒胶结在一起,实现了土壤颗粒的团聚,且这种团聚体具有相当的水稳定性[30]。
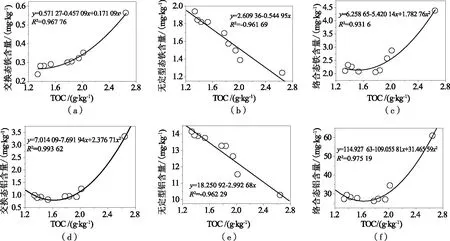
图6 模拟酸雨作用下土壤中铁铝形态与土壤有机质相关性
3 结 语
(1)酸雨作用引起红壤酸化,随着酸雨作用时间增加,土壤溶液pH保持在一定水平;
(2)酸雨作用下,红壤中交换态、络合态铝铁含量有所减少,无定型铝铁含量有所增加,酸雨酸度越大,变化趋势越明显;
(3)酸雨促进土壤有机质的淋失,酸雨酸度越大,有机质淋失量越大;
(4)酸雨作用后,红壤中交换态、络合态铝铁与土壤有机质呈显著非线性相关,无定型铝铁与土壤有机质呈显著线性相关。

