干旱胁迫对鼓节竹生理生化的影响1)
何天友 殷彪 赖金莉 张盟 任可 陈凌艳 荣俊冬 陈礼光 郑郁善
(福建农林大学,福州,350002)
在植物的生长过程中,当细胞吸水量大于耗水量时会出现水分亏缺的现象,植物出现缺水现象的适应性和耐受能力称为植物的抗旱性[1]。干旱作为一种多维的胁迫,引起植物从表型、生理、生化及分子水平的一系列变化。严重的干旱可能导致光合作用的终止和新陈代谢的紊乱,最终导致植物的死亡[2]。因此,对于植物的抗旱性研究显得尤为重要,探索植物的抗旱性对研究植物的耐旱机制及培育耐旱植物新品种具有重要的理论意义。
鼓节竹(Bambusatuldoides‘Swolleninternode’)是簕竹属(Bambusa)青竿竹(Bambusatuldoides)的栽培品种,其秆形奇特,是南方城市常见的园林绿化树种,具有较高的观赏价值。目前,鼓节竹的相关研究主要集中在抗寒性[3-5]、滞尘效应[6]、防风固沙[7]及土壤根际酶活[8]等方面;虽然对沿海沙地鼓节竹相关生长特性和自然干旱胁迫下的形态和生理指标也有研究[9-12],但对鼓节竹具有较强的抗旱潜力和干旱胁迫的研究较少。因此,研究不同干旱胁迫对鼓节竹各项生理指标的影响具有重要意义。
本研究以一年生鼓节竹分株苗为试验材料,对鼓节竹进行4个不同梯度的干旱胁迫处理,分析鼓节竹叶片生理生化指标的变化,以期了解鼓节竹对土壤水分的适应能力。
1 材料与方法
1.1 实验材料
供试材料为一年生鼓节竹分株苗,均来自福建省福州市南屿镇的福州青芳竹种园。该地区属于典型的海洋性亚热带季风气候,雨量充沛,年降水量900~2 100 mm,年平均气温18 ℃,无霜期326 d,年日照时间1 700~1 980 h,土壤类型主要表现为红壤,适合鼓节竹的生长[13-14]。2017年11月份将带土球的鼓节竹分株苗移栽到直径为55 cm,深35 cm的生长盆中,盆内基质为m(泥炭土)∶m(红壤)=1∶2的混合土,每盆装混合土30 kg,在实验前利用1∶1000(体积比)的多菌灵水溶液对土壤进行消毒,并在太阳光下暴晒2 d,自然风干后过筛装盆。实验苗种植在福建农林大学园林学院温室大棚内,在干旱胁迫处理前按常规大棚盆栽苗水分管理要求浇水,并定期进行除虫除草剂施肥,正常生长5个月后,对其进行土壤含水量的控制。
1.2 实验设计
根据应叶青等[15]对毛竹的研究方法,设置以下4个处理:对照组(CK)的土壤含水量为最大田间持水量的75%~80%;轻度干旱(LD)的土壤含水量为最大田间持水量的55%~60%;中度干旱(MD)的土壤含水量为最大田间持水量的40%~45%;重度干旱(SD)的土壤含水量为最大田间持水量的20%~25%[15]。每个处理3盆苗,每盆5株,计12盆(1盆苗1个重复,每个处理3盆3个重复)。实验处理前5天对实验苗停止浇水,开始进行干旱胁迫,根据土壤重量和含水量补充水分使土壤含水量保持在设定的范围内。实验期间每天18:00对盆栽进行称质量,结合TDR350便携式土壤水分速测仪测定土壤含水量,根据测定结果及土壤质量量向盆内补充水分,使土壤含水量在控制范围内,并在盆口套塑料袋防止水分蒸发。利用环刀法[16]测定最大田间持水量,通过公式计算土壤最大田间持水量为44%,因此,CK的土壤含水量为33%~35.2%,LD的土壤含水量为24.2%~26.4%,MD的土壤含水量为17.6%~19.8%,SD的土壤含水量为8.8%~11%。实验期间进行不定期的除草和除笋。
1.3 采样方法
分别于胁迫前及胁迫后的7、14、21、28、35、42、49、56 d进行采样,测定鼓节竹各项生理生化指标。样叶选择的规格为植株顶部往下第3~5片成熟的功能叶片,采样结束后把样品放入液氮桶内速冻,带回实验室进行相关指标的测定,进行实验之前去掉叶片中脉,当天没测完的样品储存于冰箱内-80 ℃保存。每个处理每个指标在每个时期进行3次生物学重复,测定结果取平均值。
1.4 生理生化指标的测定方法
光合色素采用直接浸提法[17]测定,并分别计算叶绿素a,叶绿素b,叶绿素(a+b)及类胡萝卜素等4种光合色素的质量分数。丙二醛(MDA)质量摩尔浓度采用硫代巴比妥酸(TBA)比色法测定[18];超氧化物歧化酶(SOD)活性采用黄嘌呤酶法测定[19];过氧化物酶(POD)活性的测定采用羟胺法测定,过氧化氢酶(CAT)活性采用可见光法测定[20];脯氨酸(PRO)质量分数利用酸性茚三酮法测定[21],可溶性糖(SS)质量分数采用蒽酮比色法[22];可溶性蛋白(SP)质量浓度采用考马斯亮蓝法[23]。
1.5 数据处理
利用Excel 2007对原始数据进行整理,SPSS 20.0对数据进行分析方差分析和多重比较,利用Origin 8.0进行数据图表绘制。
2 结果与分析
2.1 干旱胁迫下,鼓节竹叶片的形态变化
在干旱胁迫过程中,鼓节竹的叶片发生了失水、皱缩、黄化、长斑及脱落等现象。其中对照组保持正常的生长,叶色浓绿;轻度干旱胁迫下的叶片外形生长状况与对照组差异不显著,在胁迫结束后叶片依然保持绿色,只有少部分叶片失水干枯;中度干旱胁迫前期,鼓节竹生长较为正常,叶色变化不明显,叶缘部分失水,部分叶片背面出现斑点,在胁迫42 d后开始出现叶片萎蔫干枯的现象,至胁迫结束时依然有2/3的叶片保持绿色;在重度干旱胁迫过程中,胁迫35 d后,鼓节竹的生长开始受到抑制,叶片出现失水皱缩的现象,胁迫结束时有1/2的叶片枯萎脱落,其余生长状况不佳。
2.2 干旱胁迫下,鼓节竹生理生化指标的变化
由表1可知,随干旱程度的增强和时间的延长,鼓节竹叶片丙二醛(MAD)的质量摩尔浓度呈整体上升的趋势。在干旱胁迫前,鼓节竹叶片丙二醛的质量摩尔浓度,MD和SD处理与CK差异不显著(P>0.05),LD处理与CK相比差异显著(P<0.05),但各处理之间的差异不显著(P>0.05)。从胁迫35 d开始,各处理之间,丙二醛的质量摩尔浓度差异显著(P<0.05)。丙二醛的质量摩尔浓度在不同的干旱胁迫下,呈现不同幅度的上升趋势,且胁迫越严重,丙二醛积累越多。LD处理,丙二醛的质量摩尔浓度上升较缓慢且在整个胁迫过程中变化幅度最小,胁迫处理56 d之后与干旱胁迫前相比上升了59.79%;MD和SD处理,丙二醛的质量摩尔浓度急剧上升,胁迫56 d后与干旱胁迫前相比分别上升了269.21%和430.74%。
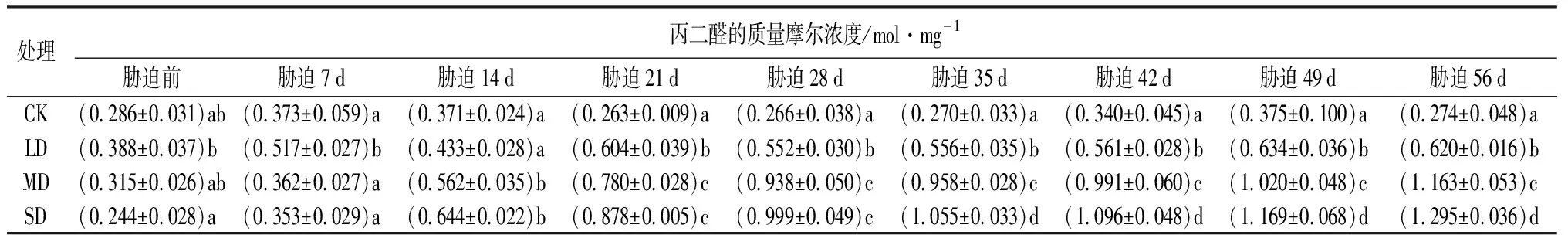
表1 干旱胁迫下鼓节竹丙二醛的质量摩尔浓度
由表2可知,随干旱程度的增强和时间的延长,鼓节竹叶片过氧化物酶(POD)活性整体呈先升后降的趋势。在干旱胁迫前,鼓节竹叶片过氧化物酶活性,SD处理与CK差异显著(P<0.05),LD和MD处理与CK差异不显著(P>0.05)。在整个胁迫过程中,鼓节竹的过氧化物酶活性呈现无明显规律的下降趋势。LD处理,随着时间的增加,过氧化物酶活性先增加后下降,胁迫21 d达到最大值;MD处理,在胁迫0~14 d的过程中,过氧化物酶活性呈现急剧上升的变化趋势,胁迫14 d过氧化物酶活性达到最大值,随着时间的增加曲折下降直到56 d达到最低值;SD处理过氧化物酶活性在胁迫0~7 d的过程中急剧上升达到峰值,随着时间的增加一直下降直到49 d达到最低值。
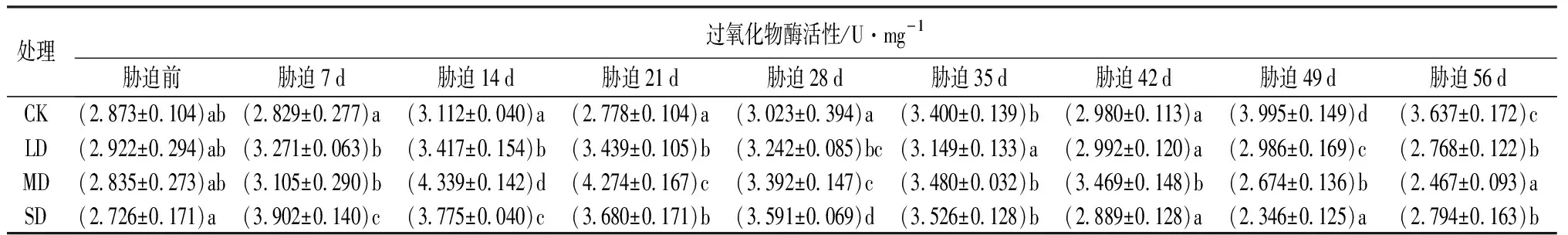
表2 干旱胁迫下鼓节竹过氧化物酶活性
由表3可知,在干旱胁迫前,各处理间的超氧化物歧化酶(SOD)活性差异不显著(P>0.05);干旱胁迫7 d,MD和SD处理与CK相比超氧化物歧化酶活性差异显著(P<0.05);干旱胁迫21 d,LD处理与CK相比超氧化物歧化酶活性存在显著差异(P<0.05);干旱胁迫7~21 d,3种处理的超氧化物歧化酶活性均无显著的差异(P>0.05),胁迫28~35 d,3种处理的超氧化物歧化酶活性均存在显著差异(P<0.05),之后从42 d开始到胁迫结束,MD和SD处理下的超氧化物歧化酶活性差异不显著(P>0.05)。LD处理,随着胁迫时间的增加,鼓节竹的超氧化物歧化酶活性一直上升,直到胁迫结束时达到峰值;而MD和SD处理,超氧化物歧化酶活性先升高后下降,MD和SD处理的最大值分别出现在胁迫42 d和35 d;干旱胁迫56 d,与干旱胁迫前相比,LD、MD和SD处理的超氧化物歧化酶活性分别增加了20.09%、28.53%、35.24%。
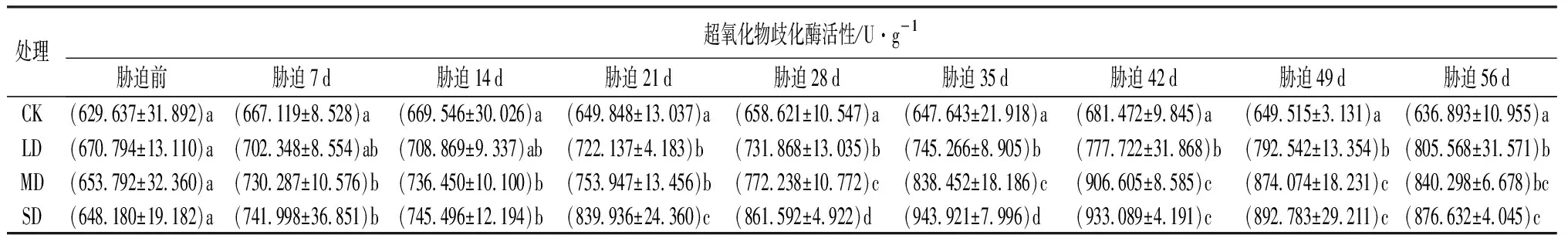
表3 干旱胁迫下鼓节竹超氧化物歧化酶活性的变化
由表4可知,干旱胁迫7 d之后,3种不同的干旱胁迫处理与CK相比,过氧化氢酶(CAT)活性均存在显著差异(P<0.05);从胁迫28 d开始,4个处理之间均存在显著差异(P<0.05)。LD处理,随着胁迫时间的增加过氧化氢酶活性呈快速增长的趋势,且在胁迫前期(胁迫21 d)急速上升,在胁迫结束(56 d)达到最大值;MD处理,过氧化氢酶活性在胁迫42 d达到最大值,之后出现略微下降的趋势;SD处理,随着胁迫时间的增加,过氧化氢酶活性先增强后减弱,在前28 d急速增长,在胁迫28 d时达到峰值,在胁迫28~35 d期间极速下降,35 d之后缓慢下降,直到胁迫56 d达到最低值。与干旱胁迫前相比,LD、MD和SD处理的过氧化氢酶活性分别上升了311.82%、636.50%和448.53%。
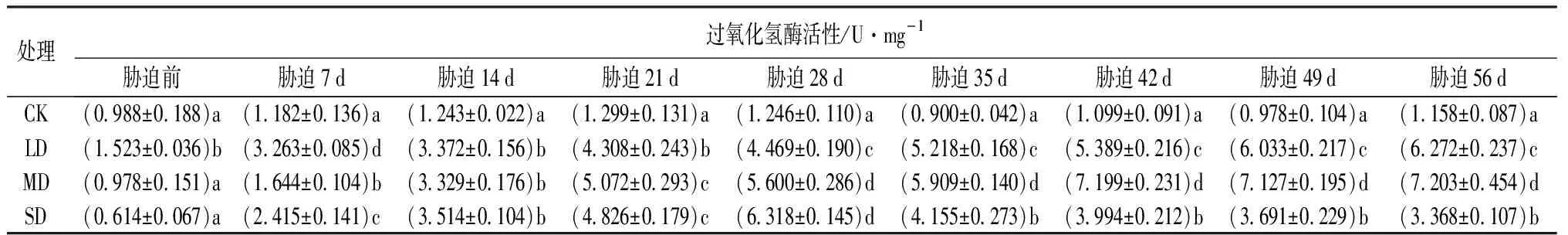
表4 干旱胁迫下鼓节竹过氧化氢酶活性的变化
由表5可知,随干旱程度的增强和时间的延长,脯氨酸(PRO)的质量分数呈整体上升的趋势。在干旱胁迫前,各处理之间的脯氨酸的质量分数差异不显著(P>0.05),胁迫49 d开始,LD处理的脯氨酸的质量分数与CK存在显著差异(P<0.05);胁迫7 d开始,MD和SD处理的脯氨酸的质量分数与CK存在显著差异(P<0.05)。在干旱胁迫下,鼓节竹叶片脯氨酸的质量分数随着胁迫时间及胁迫程度呈现上升的趋势,在胁迫结束(56 d)达到最大值。LD处理,脯氨酸的质量分数在胁迫前42 d与CK相差不大,之后急速上升,在胁迫56 d到达最大值;MD和SD处理,胁迫前7 d与CK相比差异不大,之后急速上升,直到胁迫结束达到最大值,MD和SD处理的脯氨酸的质量分数增加的幅度较大。
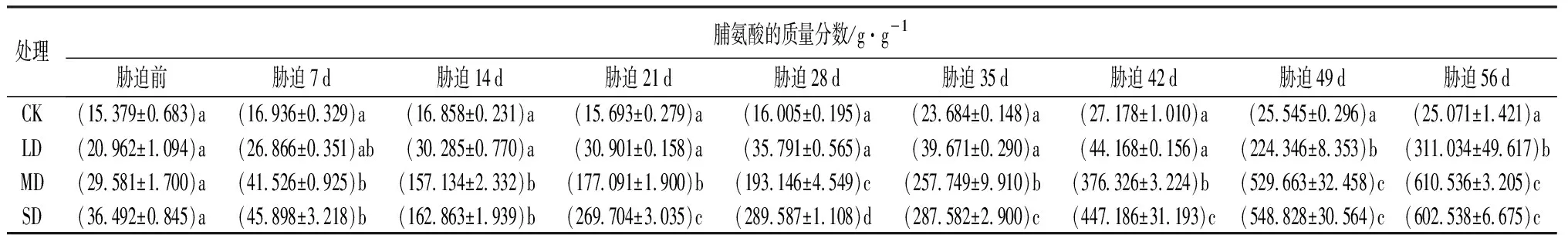
表5 干旱胁迫下鼓节竹脯氨酸的质量分数
由表6可知,随干旱程度的增强和时间的延长,可溶性糖(SS)质量分数呈整体上升的趋势。胁迫前28 d,LD处理与CK的可溶性糖质量分数无显著差异(P>0.05),胁迫28 d后,LD处理与CK的可溶性糖质量分数存在显著差异(P<0.05);MD和SD处理与CK的可溶性糖质量分数均存在显著差异(P<0.05),且随着胁迫时间的增加,鼓节竹体内的可溶性糖质量分数呈现快速上升的趋势,在胁迫56 d时达到峰值。胁迫结束(56 d)与胁迫前相比,LD、MD和SD处理的可溶性糖质量分数分别上升了229.67%、142.67%和224.39%。
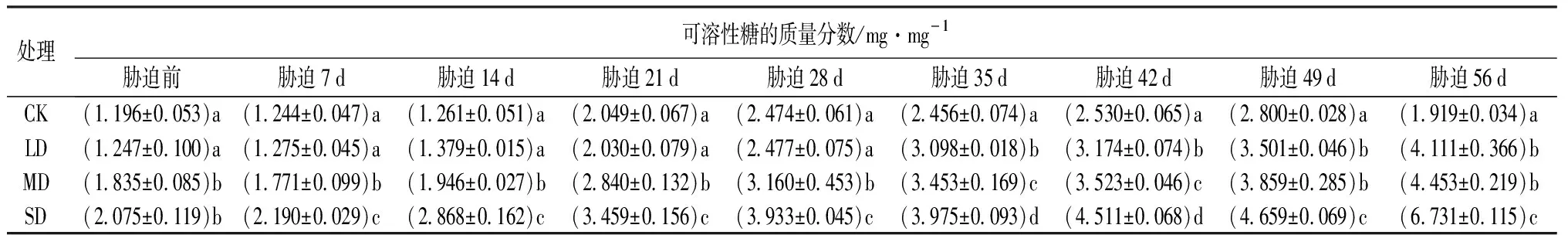
表6 干旱胁迫下鼓节竹可溶性糖的质量分数
由表7可知,随干旱程度的增强和时间的延长,可溶性蛋白(SP)质量浓度呈整体上升的趋势。在干旱胁迫前,各处理之间的可溶性蛋白质量浓度差异不显著(P>0.05),胁迫7 d后,SD处理与CK的可溶性蛋白浓度相比存在显著差异(P<0.05),胁迫21 d后,LD和MD处理与CK的可溶性蛋白质量浓度相比存在显著差异(P<0.05)。LD处理,鼓节竹的可溶性蛋白质量浓度在前7 d与干旱胁迫前相比呈下降的趋势,随后一直上升直到胁迫结束达到最大值;MD和SD处理的可溶性蛋白质量浓度则呈现出曲折上升的趋势,但在胁迫末期出现下降的趋势。在胁迫结束时,与干旱胁迫前相比,LD、MD和SD处理的可溶性蛋白质量浓度分别增加了96.63%、71.50%和62.39%。
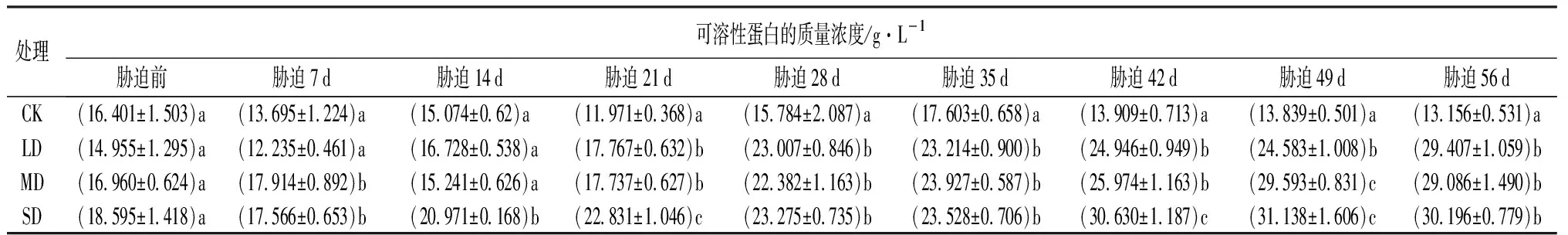
表7 干旱胁迫下鼓节竹可溶性蛋白的质量浓度的变化
由表8可知,随干旱程度的增强和时间的延长,鼓节竹叶片的光合色素的质量分数呈整体下降的趋势。
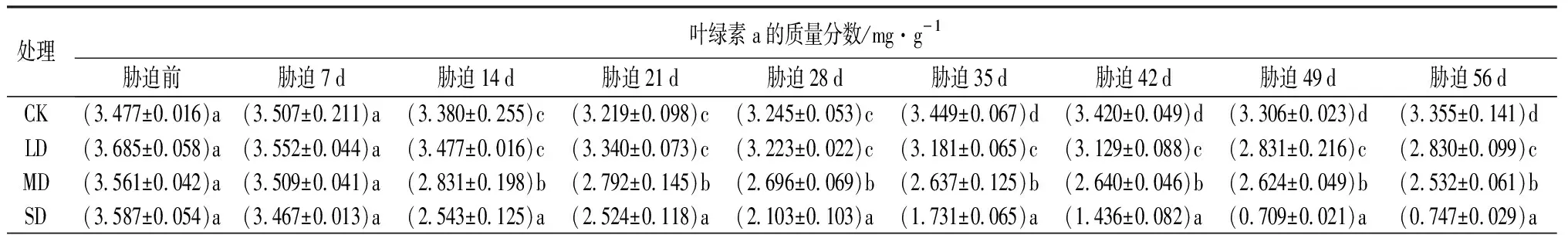
表8 干旱胁迫下鼓节竹光合色素的质量分数
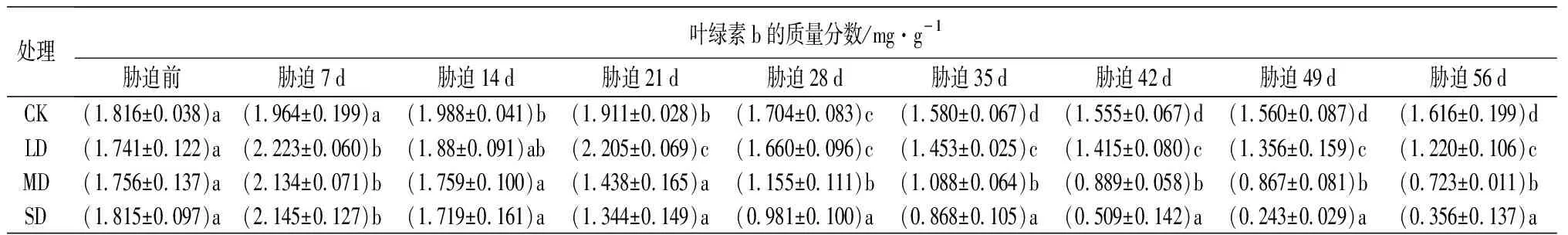
处理叶绿素b的质量分数/mg·g-1胁迫前胁迫7d胁迫14d胁迫21d胁迫28d胁迫35d胁迫42d胁迫49d胁迫56dCK(1.816±0.038)a(1.964±0.199)a(1.988±0.041)b(1.911±0.028)b(1.704±0.083)c(1.580±0.067)d(1.555±0.067)d(1.560±0.087)d(1.616±0.199)dLD(1.741±0.122)a(2.223±0.060)b(1.88±0.091)ab(2.205±0.069)c(1.660±0.096)c(1.453±0.025)c(1.415±0.080)c(1.356±0.159)c(1.220±0.106)cMD(1.756±0.137)a(2.134±0.071)b(1.759±0.100)a(1.438±0.165)a(1.155±0.111)b(1.088±0.064)b(0.889±0.058)b(0.867±0.081)b(0.723±0.011)bSD(1.815±0.097)a(2.145±0.127)b(1.719±0.161)a(1.344±0.149)a(0.981±0.100)a(0.868±0.105)a(0.509±0.142)a(0.243±0.029)a(0.356±0.137)a

处理叶绿素(a+b)的质量分数/mg·g-1胁迫前胁迫7d胁迫14d胁迫21d胁迫28d胁迫35d胁迫42d胁迫49d胁迫56dCK(5.293±0.025)a(5.471±0.216)a(5.368±0.256)b(5.130±0.108)b(4.949±0.062)c(5.029±0.055)d(4.975±0.108)d(4.867±0.110)d(4.971±0.073)dLD(5.426±0.166)a(5.775±0.022)a5.357±0.106)b(5.545±0.077)c(4.882±0.086)c(4.634±0.045)c(4.544±0.097)c(4.187±0.056)c(4.050±0.195)cMD(5.317±0.141)a(5.643±0.030)a4.59±0.270)a(4.230±0.176)a(3.850±0.179)b(3.725±0.143)b(3.529±0.020)b(3.491±0.032)b(3.255±0.061)bSD(5.402±0.086)a(5.613±0.114)a(4.262±0.077)a(3.868±0.188)a(3.084±0.005)a(2.599±0.043)a(1.945±0.176)a(0.952±0.031)a(1.103±0.158)a
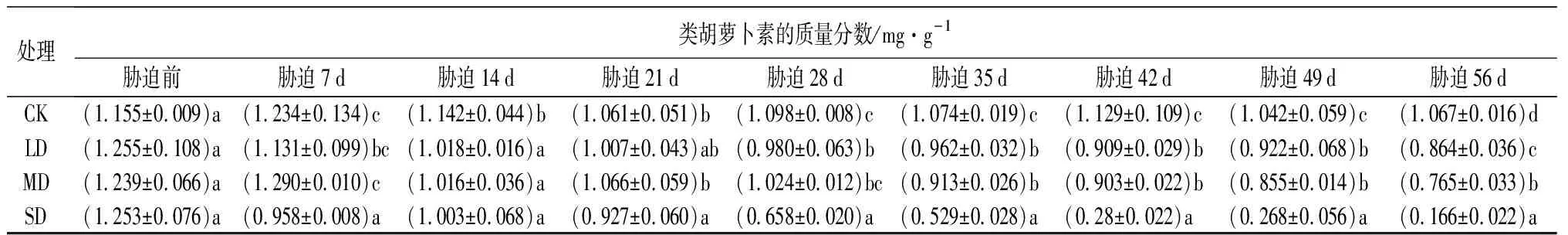
处理类胡萝卜素的质量分数/mg·g-1胁迫前胁迫7d胁迫14d胁迫21d胁迫28d胁迫35d胁迫42d胁迫49d胁迫56dCK(1.155±0.009)a(1.234±0.134)c(1.142±0.044)b(1.061±0.051)b(1.098±0.008)c(1.074±0.019)c(1.129±0.109)c(1.042±0.059)c(1.067±0.016)dLD(1.255±0.108)a(1.131±0.099)bc(1.018±0.016)a(1.007±0.043)ab(0.980±0.063)b(0.962±0.032)b(0.909±0.029)b(0.922±0.068)b(0.864±0.036)cMD(1.239±0.066)a(1.290±0.010)c(1.016±0.036)a(1.066±0.059)b(1.024±0.012)bc(0.913±0.026)b(0.903±0.022)b(0.855±0.014)b(0.765±0.033)bSD(1.253±0.076)a(0.958±0.008)a(1.003±0.068)a(0.927±0.060)a(0.658±0.020)a(0.529±0.028)a(0.28±0.022)a(0.268±0.056)a(0.166±0.022)a
各胁迫处理下的叶绿素a质量分数在胁迫前7 d均无显著差异(P>0.05),在胁迫35 d后,4个处理的叶绿素a的质量分数存在显著差异(P<0.05)。在干旱胁迫前28 d,LD处理与CK的叶绿素a的质量分数存在一定的差异,但差异不显著(P>0.05);在胁迫35 d之后,LD处理与CK的叶绿素a的质量分数差异显著(P<0.05)。MD和SD处理的叶绿素a的质量分数在胁迫前7 d与CK差异不显著(P>0.05);在干旱胁迫14 d后,MD和SD处理的叶绿素a的质量分数与CK存在显著差异(P<0.05)。
叶绿素b的质量分数在胁迫前7 d呈现略微上升的趋势,7 d之后便呈下降的趋势。在胁迫35 d后,LD处理与CK的叶绿素b的质量分数差异显著(P<0.05);在胁迫21 d后,MD和SD处理与CK的叶绿素b的质量分数有显著的差异(P<0.05);胁迫35 d,4个处理的叶绿素b的质量分数均存在显著差异(P<0.05)。
叶绿素(a+b)的质量分数在胁迫的前7 d呈现上升的趋势,在第7 d达到最大值,之后呈现下降的趋势。在胁迫35 d后,LD处理与CK的叶绿素(a+b)的质量分数差异显著(P<0.05);在胁迫14 d后,MD和SD处理与CK的叶绿素(a+b)的质量分数存在显著差异(P<0.05)。
各个处理处理下的类胡萝卜素质量分数仅在第56 d存在显著差异(P<0.05);在胁迫35~42 d,LD和MD处理与CK的类胡萝卜素质量分数差异显著(P<0.05),但LD和MD处理的差异不显著(P>0.05);从胁迫7 d开始,SD处理与CK的类胡萝卜素质量分数差异显著(P<0.05)。
3 讨论
3.1 干旱胁迫对鼓节竹叶片形态的影响
干旱胁迫下,由于叶片组织含水量的降低植物叶片形态会发生一系列的变化,如叶片失水萎蔫会影响正常的生理代谢,甚至死亡[24];同时植物通过提高根冠比,构建更发达的根系吸收土壤中的水分维持生长,从而提高植物的抗旱性[25]。本研究中,轻度干旱胁迫,鼓节竹叶片除了少数失水干枯外,其余均保持绿色;中度干旱胁迫,鼓节竹2/3的叶片保持绿色;重度干旱胁迫,鼓节竹有1/2叶片干枯脱落,其余生长不佳。因此,鼓节竹在轻度和中度干旱胁迫下依然有较多的绿色叶片,具有出较强的抗旱性;鼓节竹在重度干旱胁迫下生长不佳,对持续重度干旱胁迫的耐受性差。与赵兰等[26]的研究结果基本一致。
3.2 干旱胁迫对鼓节竹生理酶及渗透调节物质的影响
植物体内丙二醛(MDA)的质量分数与植物的抗旱性成反比,丙二醛的质量分数随着干旱胁迫程度的增加与胁迫时间的延长而持续增加[27-28];张玲[29]研究发现,在干旱胁迫下,引种地被竹叶片的丙二醛的质量分数随着胁迫时间的增加先降低后上升,并且丙二醛的质量分数的变化与竹种和实验条件等因素相关。本研究中,干旱胁迫使鼓节竹叶片的丙二醛的质量分数上升,轻度干旱胁迫下变化幅度小,而中度和重度干旱胁迫下则呈现持续上升的趋势,说明鼓节竹叶片在一定程度上遭受干旱环境所导致的氧化胁迫,且这种胁迫随着干旱的程度的加深而增大。与单长卷等[30]对乡土禾草的研究结果一致。此外,在中度和重度干旱胁迫7~28 d时,鼓节竹叶片丙二醛的质量分数增幅较大,随后增幅逐渐变小,表明鼓节竹遭受胁迫时具有自我调整的能力。靳月等[31]对闽楠的研究发现,闽楠幼苗叶片的丙二醛的质量分数在中度干旱胁迫中期通过自我调整,使丙二醛的质量分数达到峰值后趋于平稳,这与本研究结果相类似。
在干旱的环境中,植物积累更多的活性氧可以刺激抗氧化酶系统发挥其保护机制,增强保护酶(超氧化物歧化酶、过氧化物酶、过氧化氢酶)的活性以维持植物正常的氧化代谢,这是植物在干旱胁迫条件下的一种适应机制。试验结果显示,在轻度干旱胁迫过程中,鼓节竹叶片中的超氧化物歧化酶活性和过氧化氢酶活性同时上升,共同起协同作用,有效的减轻活性氧对鼓节竹的伤害;在中度干旱胁迫下,鼓节竹叶片的超氧化物歧化酶活性和过氧化物酶活性先升后降;而重度干旱胁迫下,过氧化物酶活性和过氧化氢酶活性的变化趋势一致,表现为先上升后下降。因为在轻度干旱胁迫全过程及中度和重度干旱胁迫的前期,鼓节竹可通过积累大量的保护酶来降低活性氧造成的伤害,以保护抗氧化酶系统,而在中度和重度干旱胁迫的后期,酶活性下降,导致鼓节竹细胞代谢失调,细胞内积累大量的自由基,保护酶系统受到破坏。因此,鼓节竹在轻度干旱胁迫全过程及中度和重度干旱胁迫前期可以调节自身的保护酶系统来维持植株的正常代谢,而长时间的中度和重度干旱胁迫在一定程度上影响鼓节竹的正常生长。该实验结果与桐花树[32]、甘蔗[33]、景天科等[34]植物在干旱胁迫下的研究结果类似,与顾大形等[35]对四季竹的研究在某种程度呈现相反的趋势,主要是由于试验竹种、试验时间及外界环境气候等不一致。
在干旱胁迫条件下,渗透调节物质的积累可以降低细胞渗透势,保证细胞内的水分平衡和细胞膨压,从而达到抵御干旱的效果[36]。本研究中,脯氨酸、可溶性糖总体上随着土壤水分的减少及胁迫时间的延长而持续上升。在轻度和中度干旱胁迫前期,可溶性糖上升的原因是光合系统在干旱胁迫下的转运机能受到影响,阻碍了鼓节竹体内的生物大分子的合成,而增加了蔗糖等低分子量物质的合成;而在轻度和中度干旱胁迫后期及重度干旱胁迫过程中可溶性糖升高的原因是鼓节竹内部的生长机能遭到破坏,使得植株生命活动减弱,对糖类的消耗能力降低,使得可溶性糖质量分数升高[37]。根据抗氧化酶的变化情况,鼓节竹可耐受轻度干旱胁迫及较长时间的中度干旱胁迫,而对重度干旱胁迫的耐受性较弱,因此,轻度和中度干旱胁迫使鼓节竹通过积累糖类等物质维持各项生理机能的正常运行,重度干旱胁迫使鼓节竹很多生理代谢过程受到阻碍,进而降低了对糖类的消耗。此外,在干旱胁迫条件下,植物积累脯氨酸和可溶糖的原因是一种为生长储存碳源或能量的方式[25],具体的原因有待后续进行进一步的研究。
为了适应干旱环境,植物内部调节系统会启动与逆境相关的基因,以合成胁迫相关的蛋白质来适应逆境。本试验中随着胁迫时间的增加及胁迫程度的加深,鼓节竹的可溶性蛋白质量浓度呈现上升的趋势,说明在本实验的干旱胁迫中,并没有达到鼓节竹干旱适应的临界状态,说明鼓节竹在遭受干旱胁迫时具有较强的自我调节能力和忍受能力。与班甜甜等[37]对草石蚕和季杨等[38]对鸭茅的研究结果相一致。
3.3 干旱胁迫对鼓节竹光合参数的影响
叶绿素等光合色素的质量分数越高,越有利于植物在低光照条件下有效吸收光能,有利于光合作用的进行,增加有机物的积累[39]。试验发现,在干旱胁迫过程中,鼓节竹叶片各光合色素质量分数总体呈下降趋势;但轻度干旱胁迫变化幅度较平稳,中度干旱胁迫其次,重度干旱胁迫下降幅度较大,表明鼓节竹叶片的光合色素对重度干旱胁迫较敏感。此外叶绿素b和总叶绿素的质量分数在胁迫初期(0~7 d)出现略微上升的趋势,因为鼓节竹在适当的干旱胁迫范围内可以正常生长,轻度胁迫初期可以有效促进叶绿素的合成,随着胁迫时间的增加,鼓节竹的生理代谢受到一定的影响,重度干旱胁迫使叶绿素合成受阻[40]。有研究表明干旱胁迫可以使叶绿素发生水解,同时也会抑制叶绿素的合成[35]。因此,干旱胁迫下鼓节竹叶绿素的质量分数下降的原因,是鼓节竹体内积累的活性氧破坏了细胞内质膜系统,导致以类囊体膜结构为主要结构的叶绿体受损,从而导致叶绿素合成缺乏载体,使得叶绿素的合成下降。轻度和中度干旱胁迫过程中鼓节竹类胡萝卜素下降较缓慢,而在重度干旱胁迫下呈现快速持续下降的趋势,因此在轻度和中度干旱胁迫过程中,类胡萝卜素对增强鼓节竹抗旱性具有一定的作用。
4 结论
本研究通过观测鼓节竹叶片形态,测定与干旱胁迫相关的生理生化指标,分析不同程度胁迫下的各项指标随时间的动态变化,探究了鼓节竹的耐旱性。轻度和中度干旱胁迫下,鼓节竹叶片形态出现失水、萎蔫、发黄、枯萎甚至脱落的现象,并通过积累抗氧化酶、增加渗透调节物质和增强光合作用等形式抵御干旱胁迫带来的伤害,维持植物的正常生理代谢。而重度干旱胁迫下,鼓节竹叶片光合色素的显著下降和酶活性的变化,说明鼓节竹对重度干旱胁迫的耐受性差。另外,在土壤含水量大于17.6%的环境中,鼓节竹的生长状态较好,说明只要不是极度缺水,将日常水分管理控制在这个范围内,鼓节竹均能较正常的生长。

