福州地区健康儿童甲状腺功能指标参考区间的建立
李亚东,马梅,程烽
(1.福建省儿童医院检验科;2.福建省妇幼保健院检验科,福建 福州 35000)
甲状腺功能指标的参考区间对甲状腺疾病的诊断、疗效的观察、预后判断及健康评估提供了重要的依据。 由于儿童在生长发育、营养状态等方面与成人有明显差异,所以其检测项目的参考区间可能与成人有一定的差异[1]。 目前,临床上常用监测甲状腺功能敏感的指标主要有促甲状腺激素(thyroid stimulating hormone,TSH)、 游离三碘甲状腺氨酸(free triiodothyronine,FT3)和游离甲状腺素(free thyroxine,FT4) 等等。 研究发现这些甲状腺功能筛查指标的参考区间在健康儿童中不仅因年龄而异,同时也受到性别、饮食习惯、族群和地理位置的影响[2]。 因此,建立适合于本地区儿童的甲状腺功能筛查指标的参考区间至关重要。
1 材料和方法
1.1 研究对象 2016年1月至2019年12月在福建省妇幼保健院儿童保健中心健康体检的1d~12岁的儿童。 纳入标准:⑴无早产史、甲状腺肥大、甲状腺病史或家族史;⑵无严重的心、肺、肝、肾、胃、肠等疾病; ⑶近期内无服用影响甲状腺功能的药物; ⑷甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)或甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)阴性。 最终符合筛选标准的有2121 例,其中男1097 例,女1024 例。 所有纳入者血、尿常规均正常,肝、肾功能均正常。 根据年龄分组分为5 组:第1 组(4d~<1月)482 例,其中男266 例,女216 例;第2 组(1~<12月)345 例,其中男193 例,女152 例;第3 组(1~<5岁)405 例,其中男239 例,女166 例; 第4 组(5~<10岁)443 例,其中男234 例,女209 例;第5 组(10~<12岁)446例,其中男165 例,女281 例。
1.2 仪器与试剂 仪器为ADVIA Centaur XP 型全自动化学发光免疫分析仪(美国西门子公司),由该公司提供原装进口配套试剂及校准品,质控品为美国伯乐公司,检测方法按仪器和试剂操作说明书进行。 所用试剂的批内变异系数(coefficient of variation,CV)均小于3%,批间CV 均小于5%。
1.3 方法
1.3.1 样本的采集及处理 所有受试的儿童采集静脉血2~3ml, 常温下3500r/min ( 离心半径5cm)离心10min。 离心后分离血清2h 内检测,样本无黄疸、无溶血、无脂血。
1.3.2 质量保证 仪器经校准后每日用双水平室内定值质控血清测定,要求质控样品的检测结果在给定范围内才能报告本批样品的检测结果。 室间质量评价:每年参加福建省临床检验中心和国家卫健委临床检验中心室间质量评价计划,保证各项目的正确度。
1.4 统计学方法
1.4.1 离群值 在参考值评估领域中,Dixon 提出了一种离群值测试方法,即D/R 比值[3],D 值是极大/或极小值与相邻值之间的绝对差值,而R 值是指所有观测值的全距,即极大值与极小值间的差值。当某个观测值的D 值≥1/3R 值时,该值应当作为离群值被剔除。
1.4.2 参考区间分组 采用Z 检验[3],根据性别或年龄进行分组,分别计算Z 值和Z* 值。
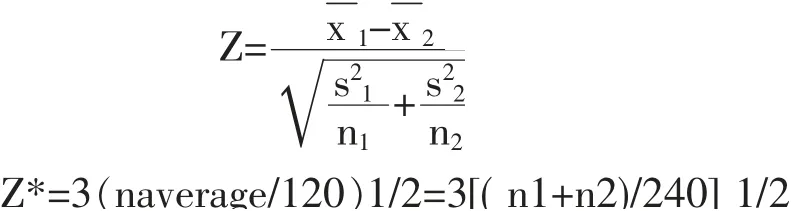
式中X1 和X 2 分别是2 个组的均值,S1 和S2 分别是2 个组的标准方差,n1 和n2 则是2 个组的参考样本含量。 如果Z 值>Z* 值,则2 个组的参考区间需要分组; 同时,如果标准差S2 较大,应检查它是否>1.5 倍的S1; 如果Z 值<Z* 值,不同的分组可以合并,计算总体样本的参考区间,2个分组共用一个参考区间。
1.4.3 参考区间的确定 采用SPSS26 软件进行统计学分析。 对每组数据计算2.5%~97.5%作为参考区间,不同性别组间TSH、FT3、FT4 水平比较比较采用独立样本t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 不同年龄组TSH 参考区间的比较 见表1。

表1 不同年龄组TSH(μIU/ mL)参考区间的比较
2.2 不同年龄组FT3 参考区间的比较 见表2。
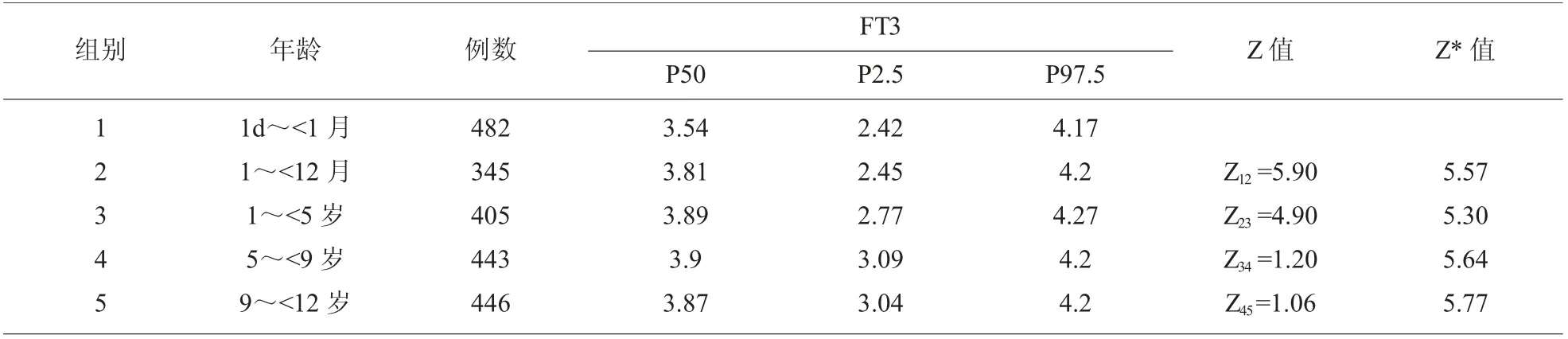
表2 不同年龄组FT3(pg/ mL)参考区间的比较
2.3 不同年龄组FT4 参考区间的比较 见表3。

表3 不同年龄组FT4(ng/dl)参考区间的比较
2.4 不同年龄组不同性别间甲状腺功能指标水平的比较 不同年龄组不同性别间TSH、FT3、FT4、水平比较,差异无统计学意义(P>0.05)。 见表4。
表4 不同年龄组不同性别间FT3、FT4、TSH 水平比较(±s)

表4 不同年龄组不同性别间FT3、FT4、TSH 水平比较(±s)
组别 例数男性/ 女性 FT3(pg/ml)男性女性FT4(ng/dl)男性 女性TSH(μIU/ml)男性 女性12345 266/216 193/152 239/166 234/209 165/281 3.46±4.99 3.65±0.51 3.82±0.39 3.86±0.29 3.82±0.28 3.44±0.52 3.68±0.46 3.81±0.32 3.83±0.31 3.82±0.32 1.31±0.86 1.26±0.14 1.30±0.17 1.37±0.09 1.32±0.16 1.34±0.19 1.25±0.13 1.28±0.18 1.39±0.08 1.26±0.17 2.86±1.18 2.60±1.16 2.55±1.20 2.60±1.19 2.36±1.12 2.77±1.11 2.36±1.18 2.55±1.22 2.50±1.17 2.08±1.00
3 讨论
甲状腺是人体内最大的内分泌腺。 但是,甲状腺疾病的发病率也处于上升阶段[4]。 对于儿童甲状腺疾病的诊断,实验室检测甲状腺激素的敏感性明显优于临床诊断。 TSH 受下丘脑分泌的促甲状腺激素释放激素(TRH) 的正反馈调节和血清甲状腺激素(thyroxine,T4)浓度的负反馈调节, 当血清T4,尤其是FT4 降低或升高时,可引起TSH 升高或降低, 故TSH 是甲状腺功能检测的一项重要指标[5]。但是,不适宜的TSH 参考区间会导致临床对患者甲状腺功能状态的错误评估[6]。 在甲状腺激素中,只有游离的甲状腺激素,才具有生物活性,作用体内靶细胞,影响机体组织的成熟、生长、和代谢活动。FT3 和FT4 测定不受甲状腺素结合球蛋白的干扰,能更准确的反应甲状腺激素状态[5]。 故目前临床医师主要选择TSH 、FT3、FT4 这三检测项目用于儿童甲状腺疾病的诊断与治疗。
本次研究发现TSH 在第1 组水平最高,这与国内学者李怀远[7]、李红娟[8]研究发现是一致的。其中国内学者认为新生儿出生后,下丘脑-垂体-甲状腺轴逐渐成熟, 负反馈机制发挥了重要作用[7]。Oron T 等[9]研究发现TSH 是随着年龄的增长而下降,并且趋于稳定。 但是本次研究却发现,福州地区新生儿的TSH 水平与其他相邻各年龄组差异无统计学意义(Z<Z*),是否与参考个体数量或身体质量指数有关? 其原因需要进一步的探讨。
本次研究数据显示FT3 在第1 组水平最低,并且与相邻组比较水平差异有统计学意义(Z>Z*),其他年龄组FT3 水平差异无统计学意义(Z<Z*)。 随着年龄的增长FT3 的水平逐渐增加,并趋于稳定。 第4 组FT4 水平与相邻两组比较差异有统计学意义(Z>Z*)。 本地区5~12岁FT3 的水平保持相对稳定,而FT4 的水平在此年龄段有所波动。这与李怀远等[7]研究报道有所不同。 国外研究报道[2]丹麦健康儿童FT3、FT4 水平随著年龄的增长逐渐下降,直到11~15岁时趋于稳定。 这表明制定儿童甲状腺激素参考区间时一定要考虑参考个体的年龄和地域。
此次研究也证实了TSH、FT3、FT4 水平在各个年龄段组性别间的差异无统计学意义。 这与陈志辉等[10]研究发现一致,证明在制定儿童TSH、FT3、FT4 参考区间时无须按性别分层。 但Kapelari K 等[11]研究发现欧洲中部的儿童FT3 水平分布男性中高于女性(P<0.001),而FT4、TSH 却无性别间的差异。 这说明在制定本地区参考个体的TSH、FT3、FT4 的参考区间时不可完全照搬国外的研究成果。目前,国内已经有个别地区儿童甲状腺指标参考范围的研究报道[12],但是其参考个体的年龄段并没有包括1d~19岁[13]。 杨昌伟、徐应波等[14,15]研究发现,不同地区、不同性别、不同年龄段建立相应的正常参考区间是很有必要的。 因此,各个临床实验室应该建立适用于本地区儿童的甲状腺参考区间。 这样才能更好的为儿童甲状腺疾病的预防、治疗、监测提供有力的帮助。

