血清CA125、HE4 联合超声GI- RADS 分类诊断卵巢恶性肿瘤的临床价值
郑章增,刘晓云,尚晓敏
(南阳市中心医院,河南 南阳 473000)
卵巢原发性恶性肿瘤是女性生殖系统疾病,俗称卵巢癌,发病率仅次于子宫颈癌和子宫体癌,卵巢处在盆腔较深处,并且体积也小,早期症状不明显,易与其他疾病混淆,大约有70%患者发病时已经是晚期,治愈率低,严重威胁女性的健康和生命安全[1]。 目前,临床对该病的病因还没有较明确的解释,早期采用对卵巢恶性肿瘤患者的鉴别诊断成为临床研究的热点[2]。 血清人附睾分泌蛋白4(Human Epididymis Protein 4,HE4)与糖类抗原125(carbohydrate antigen 125,CA125)是近些年新发现的肿瘤标志物,国内外研究表明HE4、CA125对卵巢良恶性肿瘤的准确诊断起到促进作用[3,4]。妇科影像报告与数据系统(Gynecologic imaging reporting and data,GI-RADS) 分类方法是卵巢肿块最高效的检查手段,通常对于多房或存在多房区域的卵巢囊实性肿块多提示恶性倾向,而对于单房肿块的诊断一直都较为困难,鉴别难度大[5]。 本研究旨在分析血清CA125、HE4 联合超声GIRADS 分类诊断卵巢恶性肿瘤的效能,以期为临床应用提供参考依据。
1 资料与方法
1.1 一般资料 2018年1月-2021年1月在本院确诊的卵巢恶性肿瘤患者86 例。 纳入标准:⑴符合《卵巢恶性肿瘤诊断与治疗指南》[6]诊断标准,均接受彩色多普勒超声检查声像图为附件区单房囊实性包块; ⑵均经超声引导下穿刺活检或手术治疗获得病理检查结果; ⑶经医院伦理委员会通过,患者及家属了解并知情同意。 排除标准:⑴有卵巢肿瘤手术史;⑵无法有效配合研究;⑶缺乏完整的病例资料。86 例卵巢恶性肿瘤患者年龄40~62岁,平均年龄51.22±6.75岁,共92 个附件肿块,其中2例为双侧发,且双发的病理性质相同。 病灶经体检偶然发现或因临床出现腹痛、下腹部肿块、月经紊乱、尿频尿急、腰骶部疼痛等症状就诊。
1.2 检测方法 于超声前抽取清晨空腹外周静脉血4ml,采用国产FUP PT18H 台式高速离心机进行离心,离心半径为10cm,以3000 r/min 离心15 min,取上层清液,置于-18℃超低温冰箱内储存,待检。 血清HE4 采用双抗体夹心ELISA 试剂盒(上海科华生物有限公司)进行检测,按照试剂盒说明书建立标准曲线,上酶标仪(KB-360 型,上海科华公司)测定样本吸光度值,计算血清中HE4 水平,HE4 临界值设为小于75 pmol/L。 血清CA125 采用电化学发光法进行检测,按照试剂盒(德国罗氏公司) 说明书操作,仪器选用德国罗氏公司生产的cobas e601 型电化学发光仪进行检测,CA125 正常参考范围为小于35 U/ml。
使用中国迈瑞医疗国际股份有限公司Resona7 彩色多普勒超声诊断仪对所有患者进行阴道超声评估,设置经腹部探头的频率为3.5~5.0 MHz,经阴道腔内探头的频率为7.5~12 MHz,依次检查所有患者的子宫、卵巢等组织的形态、回声等,甄别出卵巢单房囊实性肿物,观察并记录病灶的大小、数目、实质成分的形态、内部血流、毗邻、腹水、转移灶情况等,将具有显著盆腔淋巴结转移、成熟性畸胎瘤等声像图典型病变患者排除。
1.3 观察指标
1.3.1 血清肿瘤标记物指标 血清HE4 水平的正常值参考范围为0~140pmol/ml,当HE4 水平大于140pmol/ml 时则判定为阳性。 CA125 水平的正常值参考范围为0~35U/ml,当CA125 水平大于35U/ml 时则判定为阳性。
1.3.2 GI-RADS 分类GI-RADS 分类依据国际卵巢肿瘤分析组织(International Ovarian Tumor Analysis,IOTA)简易标准(simple rules,SR),按肿瘤的超声表现分为5 类,其中1~3 类归为阴性肿块,4~5 类归为阳性肿块。 阴性肿块标准[7]为:⑴单房囊性肿块; ⑵肿瘤最大直径<100mm,且边缘较光滑; ⑶肿块内实质性部分<7mm; ⑷经影像学分析,有声影存在; ⑸经影像学分析,内无血流信号出现。 阳性肿块标准为: ⑴不规则实质性肿瘤; ⑵肿瘤最大直径在>100mm; ⑶有4 个及以上乳头状结构; ⑷经影像学分析,内有较为丰富的血流信号出现; ⑸腹水。
1.4 统计学处理 采用SPSS 22.0 统计学软件进行数据分析,满足正态分布且方差齐的计量资料采用(±s)表示,采用两样本独立t 检验比较组间差异,计数资料用率表示,采用χ2检验,采用kappa一致性分析血清CA125、HE4 联合超声GI-RADS分类诊断卵巢恶性肿瘤的临床价值,CA125+ HE4联合诊断采用并联,两种方法检测阳性,则结果为阳性,P<0.05 为差异有统计学意义。
2 结果
2.1 血清CA125、HE4 诊断卵巢恶性肿瘤的效能分析 86 例患者,病理诊断显示66 例阴性,20 例阳性。 血清HE4、CA125、GI-RADS 分类检出情况,见表1。

表1 血清CA125、HE4 诊断卵巢恶性肿瘤的效能分析(n)
2.2 血清CA125、HE4 与GI-RADS 分类检测结果分析 针对不同病理结果,血清CA125、HE4 与GI-RADS 分类检测阳性及阴性结果,见表2。
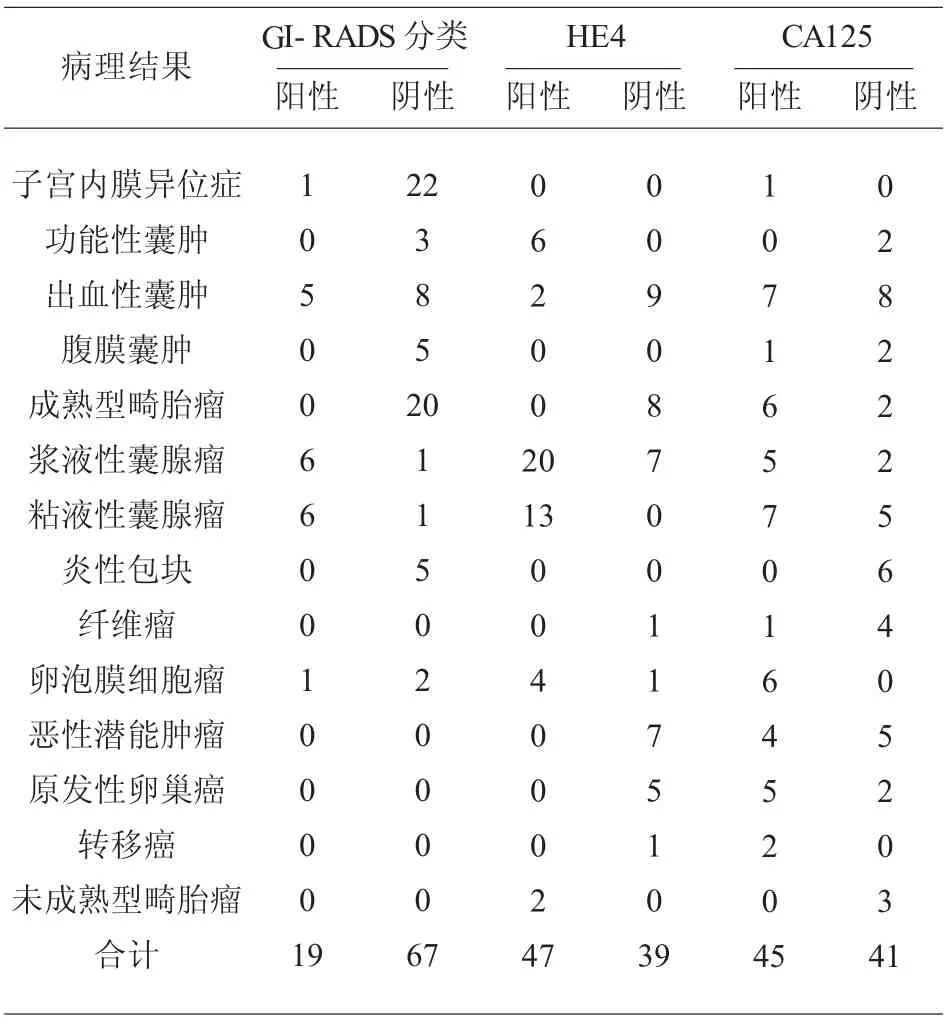
表2 血清CA125、HE4 与GI- RADS 分类检测结果分析
2.3 不同方法诊断卵巢恶性肿瘤的效能比较 血清HE4、CA125、CA125 +HE4、GI -RADS 分 类、HE4+ GI-RADS 分类、CA125+GI-RADS 分类及三者联合检测诊断卵巢恶性肿瘤的Kappa 值分别为0.313、0.296、0.422、0.768、0.797、0.797 和0.828,见表3。

表3 不同方法诊断卵巢恶性肿瘤的效能比较
3 讨论
卵巢恶性肿瘤是一种常见的女性生殖道恶性肿瘤,上皮癌最多见,其次是恶性生殖细胞肿瘤,其常见的症状包括局部呈现持续性的胀痛、月经不调、消瘦、乏力、倦怠等[8,9]。近几年,卵巢恶性肿瘤的发病率大幅度增高,该疾病的危害性及严重性已引起越来越多的注意[10]。 卵巢恶性肿瘤早期的特异性不明显,所以临床的早期诊断存在一定的困难,临床上如何快速且准确的诊断出卵巢恶性肿瘤的良恶性对该病的治疗具有重大的意义[11]。 随着临床各项研究工作的开展,已加相关血清类物质应用于卵巢肿瘤各项诊断鉴别中,但不同的血清标志物的诊断价值仍需要做进一步研究[12]。
本研究结果探讨了血清HE4、CA125 和GIRADS 分类对卵巢恶性肿瘤的诊断情况,发现血清HE4 和CA125 诊断的敏感度较高,特异性较低,而GI-RADS 分类检测特异度较高。 HE4 属于一种基因结构的物质,最初存在于人附睾上皮细胞,是WFDC2 基因的编码产物,其长度约为12Kb,编码的蛋白质是附睾所特有的。 一般在正常人体中,HE4 并不会表达,而在恶性肿瘤中由于异常的基因转录调控,会使血清中蛋白水平的HE4 显著上升[13]。 血清糖类抗原CA125 位于胚胎发育中的体腔上皮细胞,是由肿瘤细胞增殖过程所释放的细胞膜表面碎片,还能够结合糖蛋白加速肿瘤细胞的增殖,促进病情的发展[14]。 但实践中发现CA125水平在部分非卵巢肿瘤疾病中也会升高[15]。 分析本研究结果变化,可能是由于HE4 和CA125 在大部分卵巢良性肿瘤中也表现出异常升高,指标缺乏特异性,导致本研究中特异度较低。 目前,临床较多采用GI-RADS 分类评价系统进行诊断,其是基于IOTA 的研究成果,评估标准也根据SR 进行判定,可以根据肿瘤的影像学表现、血流信号肿瘤大小等综合评估肿块性质。 已有研究证明,单独使用GI-RADS 分类评价系统诊断恶性肿瘤已有较好的灵敏度和特异度[16]。 结合本研究结果说明,临床医师可以优先采用GI-RADS 分类诊断卵巢肿瘤的良恶性。
本研究结果显示,HE4+CA125 对卵巢恶性肿瘤的诊断价值高于单纯HE4、CA125 诊断,但其诊断价值仍较低。分析原因,可能是由于HE4、CA125在大部分患者中水平均异常升高,且其两者间表达较为一致,表现为共同升高和共同下降,导致联合检测诊断的价值仍旧有限,说明临床医师有必要联合检测其它指标来提高诊断准确度。 本研究中,血清HE4+GI-RADS 分类、CA125+GI-RADS分类、HE4+CA125+GI-RADS 分类诊断卵巢恶性肿瘤的一致性稍高于单纯GI-RADS 分类。 分析原因,这可能由于单纯GI-RADS 分类仍有漏诊和误诊现象,缺乏对其他检验效能的比较,临床医师可优先选择GI-RAD 分类诊断,但在临床条件许可的情况下,可联合HE4 和CA125 辅助诊断,以期进一步提高诊断的特异性。 李琴[17]等研究显示,把GI-RADS 分类结果与标记物检测结果结合,对卵巢4 类肿块进行相应的升降级后,病理结果准确率提升至88%,大大改善了该区域的诊断效能。 提示临床血清CA125、HE4 联合GI-RADS 分类对卵巢恶性肿瘤诊断效能更高。
综上所述,血清CA125+HE4+超声GI-RADS分类诊断卵巢恶性肿瘤,提高了诊断的灵敏度和特异度,提升了肿瘤良恶性鉴别能力,值得临床推广。

