宫腔镜下子宫内膜息肉切除术后宫腔粘连影响因素分析
朱弘宇 陈建玲 冯 祥 向 娟 罗幼珍
(三峡大学 第一临床医学院[宜昌市中心人民医院] 妇科, 湖北 宜昌 443003)
子宫内膜息肉(endometrial polyps,EPs)是妇科常见的疾病之一,主要由过度增生的子宫内膜堆积而导致息肉形成。临床上EPs主要以流血、流产和不孕等为主要症状[1]。部分EPs患者可发生恶变,导致子宫内膜癌的发生[2],对女性健康造成严重威胁。目前临床上以宫腔镜下EPs切除术作为EPs的首选治疗手段[3]。但其作为一种创伤性、侵入性方法,容易引起术后并发症发生,特别是宫腔粘连[4]。术后一旦发生宫腔粘连可导致月经紊乱、腹痛和不孕,可影响有生育要求的育龄期妇女再妊娠成功率。本研究通过比较EPs切除术后患者人口学和临床特征差异,分析术后宫腔粘连发生的影响因素,为临床上早期评估EPs患者术后宫腔粘连的发生风险、及时采取干预措施、防止不良预后提供科学理论依据。
1 资料与方法
1.1 研究对象
选取2019年1月-2020年12月我院收治的行宫腔镜下EPs切除术患者320例为研究对象,年龄18~40岁,平均年龄(29.36±5.12)岁,体质量指数(body mass index,BMI)为(22.85±1.63)kg/m2,合并糖尿病97例、高血压57例,刮宫史99例。纳入标准:年龄≥18岁,有性生活史,不孕症患者;宫腔镜下检查结果提示EPs;首次行息肉切除术,术后病理诊断为EPs;知情同意并自愿参与研究。排除标准:有手术禁忌症;心、肝、肾等严重器质性疾病;恶性肿瘤、免疫缺陷、凝血因子异常;精神紊乱或意识障碍;因男方原因不孕;信息资料不全。未发生宫腔粘连的222例作为对照组,发生宫腔粘连的98例作为观察组。本研究经过我院医学伦理委员会审核批准。
1.2 研究方法
1.2.1 手术指征
①超声检查显示子宫内膜不均或宫腔内有异常回声;②子宫输卵管造影显示子宫宫壁欠光滑或充盈缺损;③经期过长或阴道发生不规则流血。
1.2.2 诊断标准
病理学诊断标准参照《妇产科病理学》中关于EPs诊断标准[5]:由间质腺体及内膜组成,外表呈细长的卵圆形或圆锥形,表面光滑,常有血管在表面,大小不等,可为多发或单发肿块,出现蒂向宫腔的突出。
1.2.3 手术方法
所有患者月经干净3~7天后在宫腔镜引导下行EPs切除术,常规使用抗生素预防感染和炎症反应。术前采用硬膜外局部麻醉,宫颈经扩张器扩张后,在宫腔镜下观察和记录息肉个数、直径(cm)和部位等。采用环形电极切除内膜上息肉组织,切除顺序从远至近,深度约为2.5~3.5 mm,膨宫液采用0.9%氯化钠注射液或5%葡萄糖注射液,息肉组织切除后进行病理学诊断。所有患者术后第2天给予拜耳医药保健有限公司生产的戊酸雌二醇2 mg,2次/d,连续服用21天;服药第12天起给予荷兰Abbott Biologicals B.V.生产的地屈孕酮片10 mg,2次/d,连续服用10天,停药9天。药物治疗后3个周期行宫腔镜复查。
1.3 观察指标
收集所有患者人口学信息、临床特征、宫腔粘连发生情况。①人口学信息包括年龄、身高、体质量、糖尿病史、高血压史、刮宫史等,计算BMI=体质量(kg)/身高的平方(m2);②临床特征包括息肉个数、息肉直径、息肉部位、合并子宫肌瘤、合并子宫内膜异位症、盆腔炎、孕次、产次。术后随访宫腔粘连发生情况,发生率(%)=发生例数/总例数×100%。
1.4 统计学方法
采用R 3.4.3软件进行统计学分析。连续性变量采用(均数±标准差)描述,t检验进行分析;分类变量采用[n(%)]描述,χ2检验进行分析。多因素分析采用二元logistics回归模型分析。预测作用采用受试者工作特征曲线 (receiver operating characteristic curve,ROC)。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者人口学资料比较
人口学资料中,观察组≥35岁、糖尿病的患者比例较对照组高(均P<0.05),两组BMI、慢性高血压史、刮宫史差异无统计学意义(均P>0.05),见表1。

表1 两组患者人口学资料比较[n(%)]
2.2 两组患者围术期指标比较
观察组多个息肉、息肉直径>1 cm、合并子宫内膜异位症、孕次>1的患者比例较对照组高(均P<0.05),见表2。
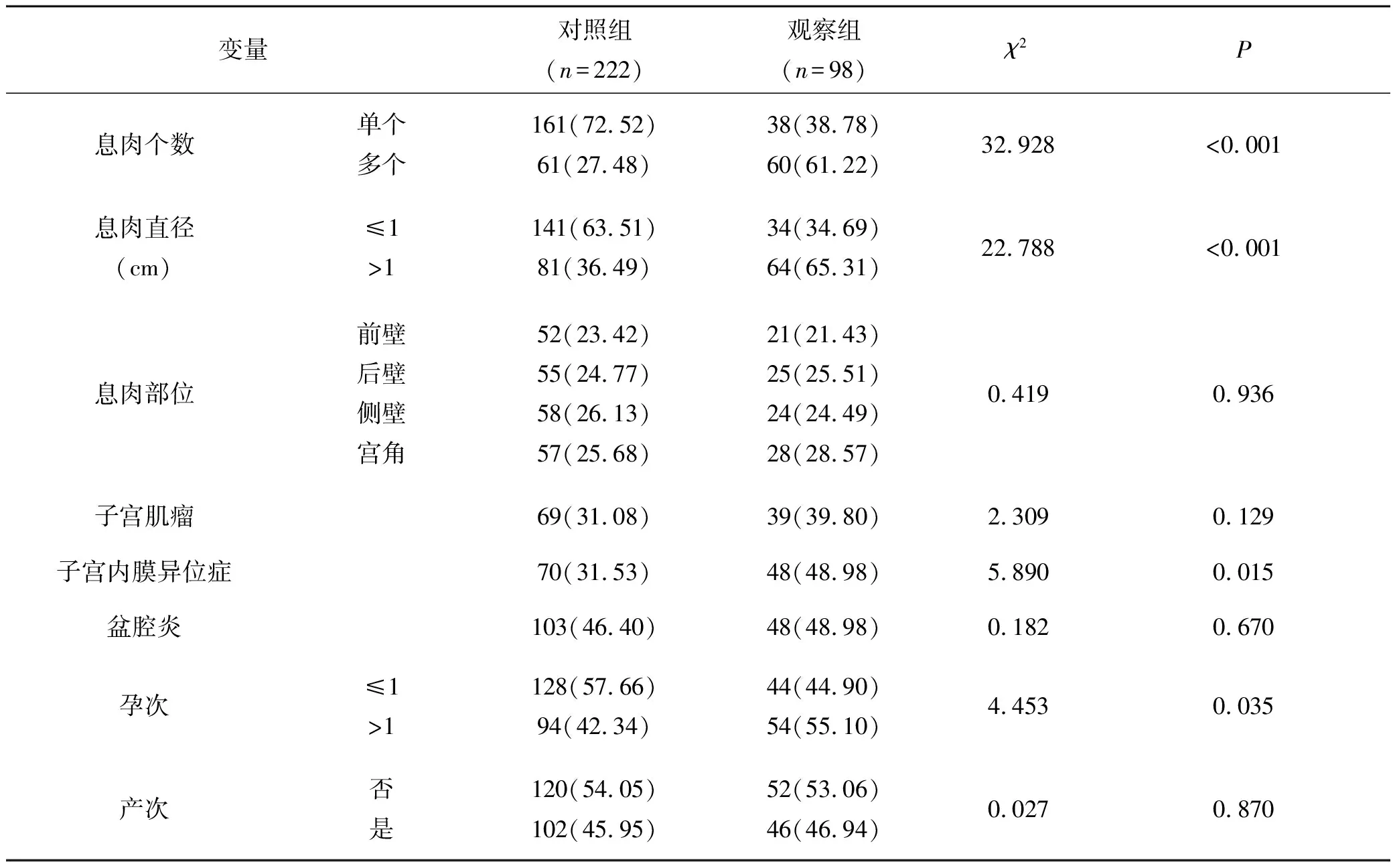
表2 两组患者围术期指标比较[n(%)]
2.3 宫腔镜下EPs切除术后宫腔粘连发生影响因素分析
单因素分析中,年龄、糖尿病史、息肉个数、息肉直径、子宫内膜异位症和孕次对宫腔镜下EPs切除术后宫腔粘连发生有影响(均P<0.05)。将单因素中P<0.05的因素纳入多因素logistics回归分析模型,Y=0为“术后未发生宫腔粘连”,Y=1为“术后发生宫腔粘连”。结果发现,Omnibus检验χ2=77.412,P<0.001,方程成立。H-L检验χ2=2.311,P=0.970,拟合度较好。校正混杂因素后,多因素分析显示年龄、糖尿病史、息肉个数、息肉直径、子宫内膜异位症和孕次是宫腔镜下EPs切除术后宫腔粘连发生的独立影响因素(均P<0.05)。
年龄≥35岁患者术后宫腔粘连发生风险是年龄<35岁患者的2.171倍;糖尿病史患者术后宫腔粘连发生风险是无糖尿病史患者的2.113倍;多个息肉患者术后宫腔粘连发生风险是单个息肉患者的4.366倍;息肉直径>1 cm的患者术后宫腔粘连发生风险是息肉直径≤ 1 cm患者的3.202倍;合并子宫内膜异位症患者术后宫腔粘连发生风险是未合并子宫内膜异位症患者的1.888倍;孕次>1次患者术后宫腔粘连发生风险是孕次≤1次患者的1.984倍,见表3。
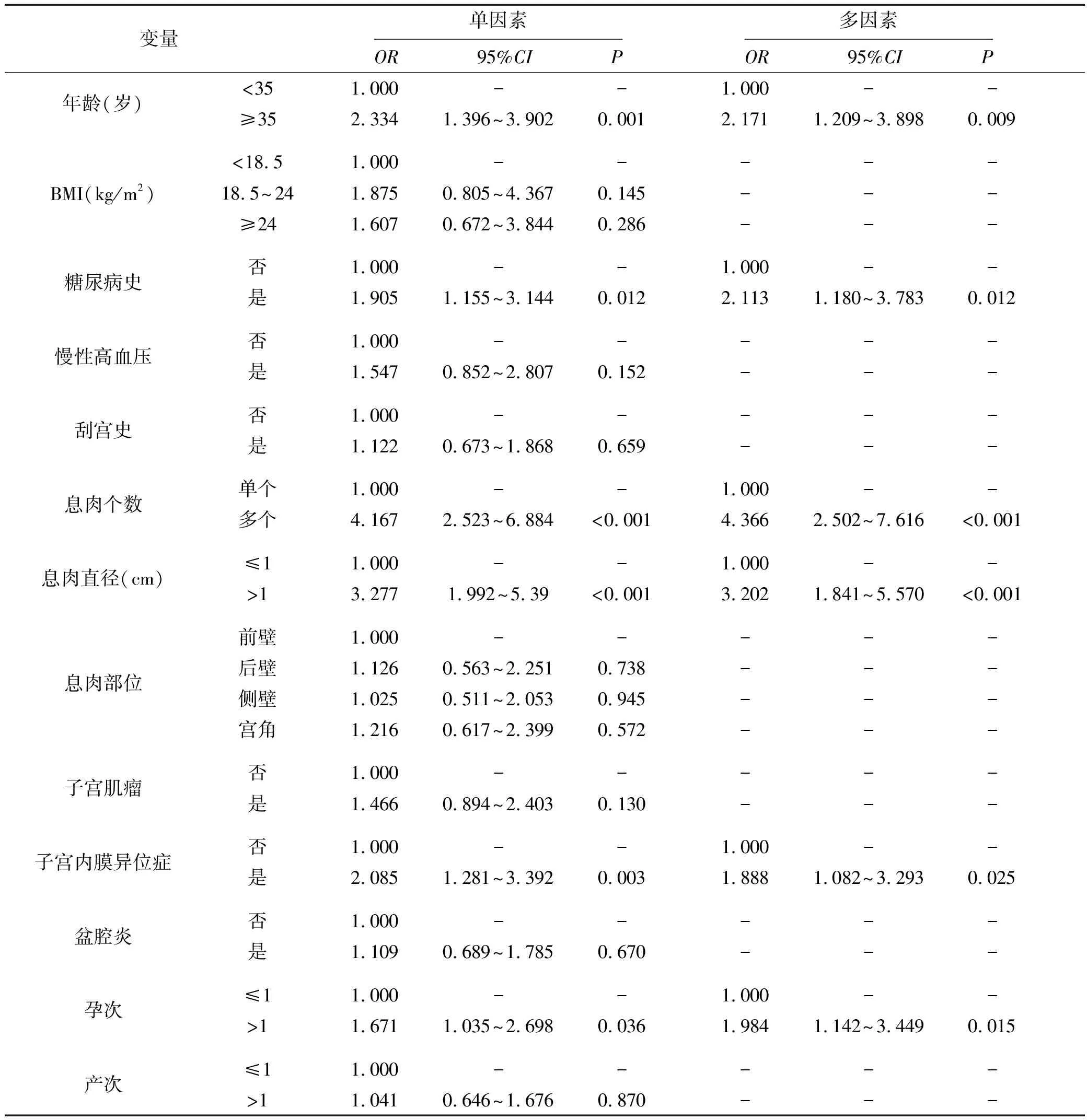
表3 宫腔镜下EPs切除术后宫腔粘连发生影响因素分析
2.4 ROC曲线分析各指标预测宫腔镜下EPs切除术后宫腔粘连的效能
ROC曲线分析显示,年龄、糖尿病史、息肉个数、息肉直径、子宫内膜异位症和孕次预测EPs切除术后宫腔粘连发生的曲线下面积(area under the curve,AUC)分别为0.589、0.571、0.669、0.644、0.587和0.564,均P<0.05。见表4、图1。
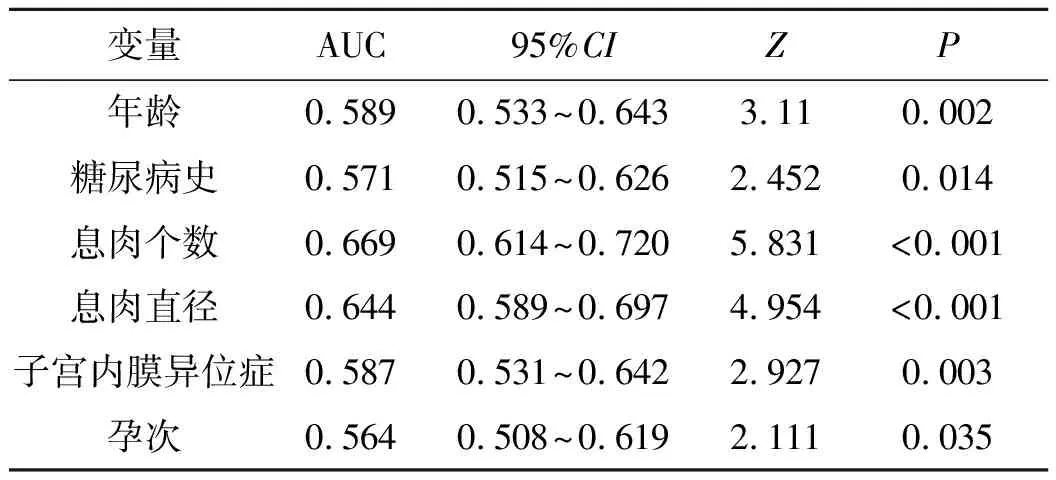
表4 ROC曲线分析各指标预测EPs切除术后宫腔粘连发生的效能
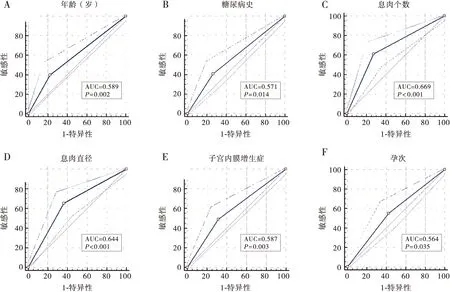
注:A~F:分别为年龄、糖尿病史、息肉个数、息肉直径、是否合并子宫内膜异位症、孕次预测EPs切除术后宫腔粘连发生的ROC曲线图1 ROC曲线分析各指标预测EPs切除术后宫腔粘连的效能
3 讨论
研究报道,宫腔粘连发生率为2.5%~11.5%,但宫腔镜下EPs切除术后宫腔粘连的发生率高达15.6%,可影响女性患者生活质量和生殖健康[6]。EPs切除术后宫腔粘连发生的影响因素和具体机制尚不明确。但术中操作和患者临床特征是重要影响因素。宫腔粘连与宫腔镜下电切术有密切关系。侯丽环等[7]研究认为,切除术后机体血液中纤维蛋白原增加,在凝血酶作用下纤维蛋白原相互联结从而形成纤维蛋白原支架;另一方面,切除术中电热效应使局部组织发生凝固、坏死,引起炎症因子释放和炎性细胞浸润,从而促进成纤维细胞的增生[8]。纤维蛋白原支架和成纤维细胞增生均能促进宫腔粘连的发生。既往研究发现,常规使用激素治疗可有效防止宫腔粘连的发生[9]。但本研究在使用激素治疗的基础上,EPs切除术后仍有部分患者发生宫腔粘连。因此,分析手术本身和激素治疗外其他因素对EPs术后宫腔粘连的影响具有重要意义。
Logistics回归分析显示,年龄、糖尿病史、息肉个数、息肉直径、子宫内膜异位症和孕次是术后宫腔粘连发生的独立影响因素。年龄是影响女性卵巢功能的重要因素。随着年龄增加,女性卵巢功能发生不同程度的下降,影响体内雌激素水平[10]。本研究发现,高龄EPs患者术后宫腔粘连发生风险更大,可能与卵巢功能随着年龄增加而不断下降,体内激素特别是雌激素水平下降,不能有效修复受损子宫内膜和调控纤维化过程有关[11]。因此,对于行EPs切除术的患者可考虑给予适量雌激素以预防术后宫腔粘连发生。糖尿病史患者EPs术后宫腔粘连发生风险更大,可能与子宫内膜微血管的内皮细胞受损,血流灌注不稳定,血管内皮功能下降有关[12]。多发息肉和大直径息肉增加了正常组织血液供应、营养物质的消耗,从而降低了子宫内膜的功能[13]。同时息肉作为一种异常生长的物质可刺激子宫内膜发生不同程度的炎症反应,从而增加术后宫腔粘连的发生风险。蒋儒芳等[14]研究报道,合并子宫内膜异位症的EPs患者腹腔液巨噬细胞活性增强,可通过旁分泌途径分泌多种炎症因子并作用于子宫内膜。同时,合并子宫内膜异位症可导致体内雌激素受体和基质金属蛋白酶7表达增高,这些均与宫腔粘连发生有关。孕次>1的患者,多数由于刮宫、药物流产或不明原因流产,子宫内膜受到损伤,同时血液供应不佳[15]。这些都在一定程度上直接或间接导致了术后宫腔粘连的发生。
ROC曲线分析显示,年龄、糖尿病史、多发息肉、息肉直径>1 cm、子宫内膜异位症和孕次均可预测宫腔镜下EPs切除术后宫腔粘连发生。但单一指标预测的AUC均小于0.7,预测效能不高,可考虑多种指标联合或与公认预测指标联合,构建新的预测指标体系,早期评估术后宫腔粘连的发生风险。
本研究存在一定的局限。首先,研究病例来源单一,仅为一家医院,可能存在选择偏倚;第二,部分患者术前在门诊有激素治疗史,可能干扰研究结果;第三,缺乏炎症因子指标,无法判断炎症反应严重程度对宫腔粘连影响。后续可扩大样本量、多中心开展研究,分层或校正激素治疗对研究结果的影响,同时探讨炎症因子指标及不同炎症反应程度对宫腔粘连的影响,从而更好地判断宫腔镜下EPs切除术后宫腔粘连发生的影响因素。
综上所述,年龄>35岁、糖尿病史、多发息肉、息肉直径>1 cm、合并子宫内膜异位症、孕次>1是宫腔镜下EPs切除术后不孕患者宫腔粘连发生的独立危险因素。建议临床上早期评估术后宫腔粘连的发生风险,及时采取治疗和干预,防止不良预后,促进术后转归和有生育要求的适龄妇女再妊娠。

