血管生成相关生物标志物与非小细胞肺癌PD-1免疫治疗疗效的相关性分析
文彩虹 冯晓庆
(1. 三峡大学 第一临床医学院[宜昌市中心人民医院] 肿瘤科, 湖北 宜昌 443003; 2. 三峡大学 第一临床医学院[宜昌市中心人民医院] 口腔科, 湖北 宜昌 443003)
近年来免疫检查点抑制剂(immune checkpoint inhibitors,ICI)的应用改变了晚期肿瘤的治疗模式,部分晚期肿瘤患者生存显著获益[1-2]。PD-1免疫治疗在非小细胞肺癌(non-small cell lung cancer,NSCLC)领域的应用范围日益增加,尤其是驱动基因阴性的晚期患者,免疫治疗逐渐成为一线及后线的重要治疗手段,但总体客观缓解率(objective response rate,ORR)仅20%左右[3]。因此,筛选能够预测疗效的生物标志物尤为重要。虽然目前已经提出了一些预测ICI疗效的标志物,如PD-L1(programmed cell death 1 ligand 1)蛋白表达水平、微卫星不稳定性(microsatellite instability,MSI)和肿瘤突变负荷(tumor mutation burden,TMB)等[4-5],但这些检测往往需要肿瘤组织样本,不便于动态监测和评估。
肿瘤血管生成是肿瘤生长和转移过程中的标志性事件,主要用于传递肿瘤生长和转移所需各种营养物质、生长因子、氧气等[6]。血管生成是一个复杂、动态的生物学过程,包括血管内皮基质降解,血管内皮细胞的增殖、出芽、迁移等[7]。血管生成是肿瘤微环境(tumor microenvironment,TME)变化的重要事件,ICI联合抗血管治疗已经成为肺癌重要的治疗手段[8],血管生成相关生物标志物与免疫治疗的疗效及预后的关系尚不清楚。本研究探索了与血管生成相关的17种因子在肺癌患者行PD-1免疫治疗时的表达差异,以期找到新的免疫治疗疗效预测标记物,从而为临床实践提供更好的指导。
1 材料与方法
1.1 病例资料
选取2018年1月-2019年9月在我院肿瘤科行PD-1抗体免疫治疗的56例晚期(Ⅲ期或Ⅳ期)NSCLC患者作为研究对象。依据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版分期标准对患者进行TNM分期,患者临床及随访资料完整。
1.2 入选标准和排除标准
入选标准:①年龄18~70岁;②病理诊断为NSCLC,临床分期为Ⅲ期或Ⅳ期;③至少接受2个周期ICI治疗。排除标准:①存在EGFR、ALK、ROS1、BRAF等驱动基因突变;②存在第二部位原发肿瘤;③合并严重肝、肾功能损伤的基础性疾病;④患有严重自身免疫性疾病。所有患者均对该研究内容知情,并签署知情同意书。
1.3 治疗方法
所有患者在第1次PD-1抗体治疗前1天,空腹抽取外周血4 mL,检测血清血管生成相关生物标志物浓度(详见1.4检测方法)。PD-1单抗用药方法:派姆单抗(美国默沙东公司)采用标准的3周方案,剂量为2 mg/kg;纳武单抗(美国百时美施贵宝公司)采用2周方案,剂量为3 mg/kg。持续用药直至出现不可耐受的不良反应或疾病明显进展,每6周进行1次用药疗效评估。在接受免疫治疗前,所有患者均进行完整的基础检查,血液检查包括血常规、肝肾功能、肿瘤标记物等,影像学检査包括MRI、CT和超声等。从影像学角度,所有患者均至少有1个可供评估的病灶。患者每3个治疗周期进行1次血液和影像学检査,评估免疫治疗疗效,观察并记录药物相关不良反应。
1.4 检测方法
在Luminex®xMAP®检测平台(美国)上,使用多重蛋白检测试剂盒Human Angiogenesis/Growth Factor Magnetic Bead Panel 1(Cat. No.HAGP1M AG-12K)(美国Bio-Rad公司),检测17种血管生成相关生物标志物,分别是血管生成素-2(angiopoietin-2,ANG2)、骨形态生成蛋白-9(bone morphogenetic protein 9,BMP-9)、表皮生长因子(epidermal growth factor,EGF)、内皮糖蛋白(endoglin)、血浆内皮素-1(endothelin-1)、纤维母细胞生长因子-1(acidic fibroblast growth factor,FGF-1)、FGF-2、卵泡抑素(follistatin)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、肝素结合表皮生长因子(heparin binding EGF-like growth factor,HB-EGF)、肝细胞生长因子(hepatocyte growth factor,HGF)、白介素-8(interleukin-8,IL-8)、瘦素(leptin)、胎盘生长因子(placenta growth factor,PLGF)、血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)、VEGF-C、VEGF-D。
1.5 疗效评价
根据RECIST 1.1标准,接受治疗的患者疗效评价分为4级:完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病进展(progressive disease,PD)、疾病稳定(stable disease,SD)。其中疾病控制组(disease control,DCR)包含CR、PR和SD。
1.6 统计学方法
应用SPSS 22.0软件进行统计学分析。临床特征计数资料以例数表示,组间比较采用卡方检验;符合正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t检验;非正态分布的计量资料采用中位数(最小值,最大值)表示,组间比较采用独立样本秩和检验。采用logistic回归分析影响晚期肺癌患者免疫治疗疗效的临床因素,结果以比值比(odds ratio,OR)及其95%可信区间(confidence interval,CI)表示,以P<0.05为差异具有统计学意义。
2 结果分析
2.1 入组NSCLC患者的临床资料分析
56例晚期NSCLC患者,经PD-1抗体免疫治疗后,根据首次疗效评价结果将患者分为疾病控制组(DCR组)和疾病进展组(PD组),其中DCR组共34例患者(包含9例PR和25例SD),PD组共22例患者,如表1。免疫治疗近期疗效与患者年龄、性别、ECOG评分、病理类型、临床分期、PD-1单抗类型、是否联合化疗、免疫治疗线数均无明显相关(均P>0.05),与远处器官转移数和PD-L1蛋白表达水平明显相关(P=0.041;P=0.027)。
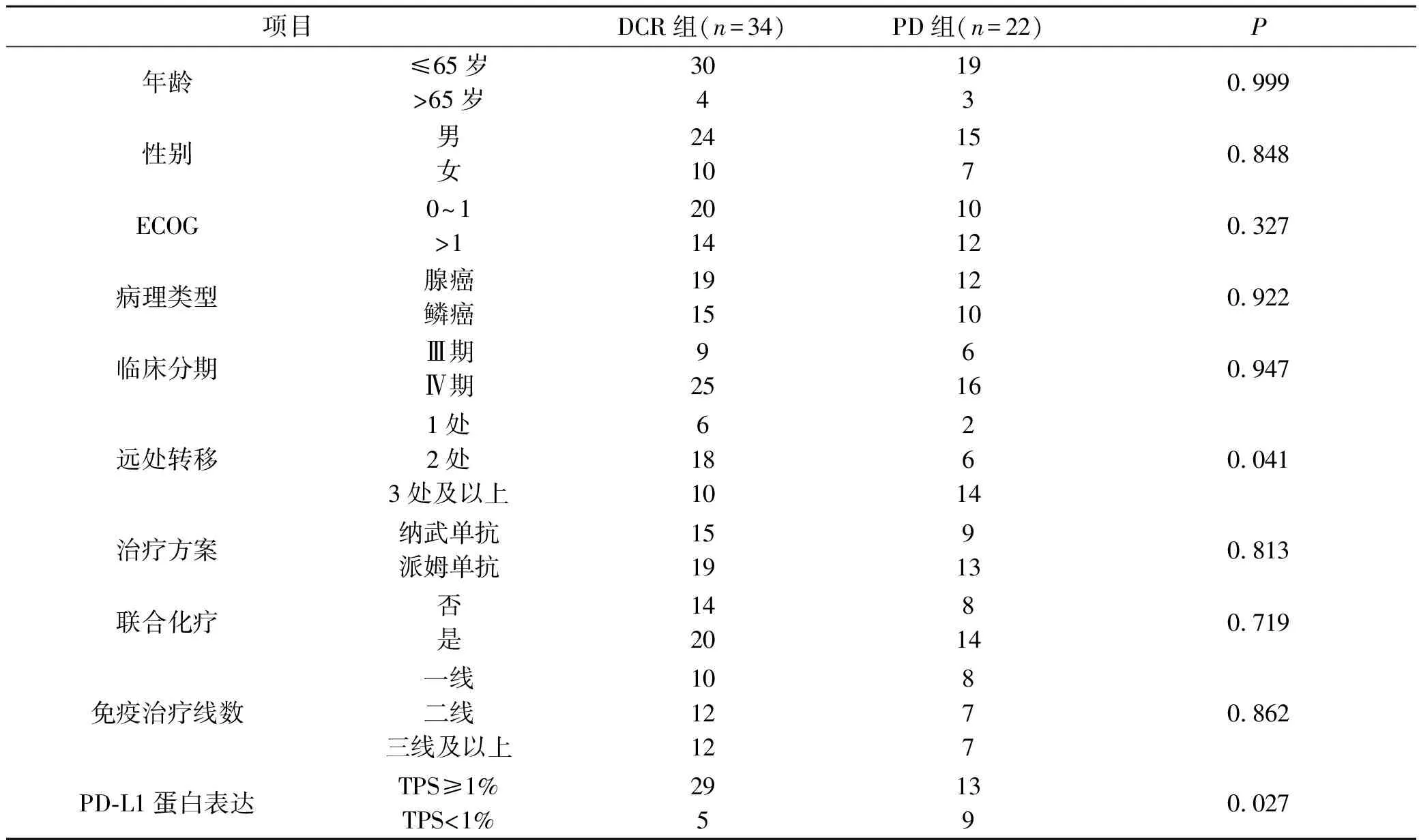
表1 入组NSCLC患者免疫治疗疗效与临床特征
2.2 DCR组与PD组血管生成相关生物标志物基线水平比较
将不同疗效分组的肺癌患者血管生成相关生物标志物水平进行比较,分析基线水平与免疫治疗疗效的关系,如表2。DCR组患者的基线血清HB-EGF、IL-8显著低于PD组(P=0.023,P=0.012);DCR组患者的基线血清VEGF-D显著高于PD组(P=0.032)。两组其余血管生成相关生物标志物浓度均无显著差异(均P>0.05)。
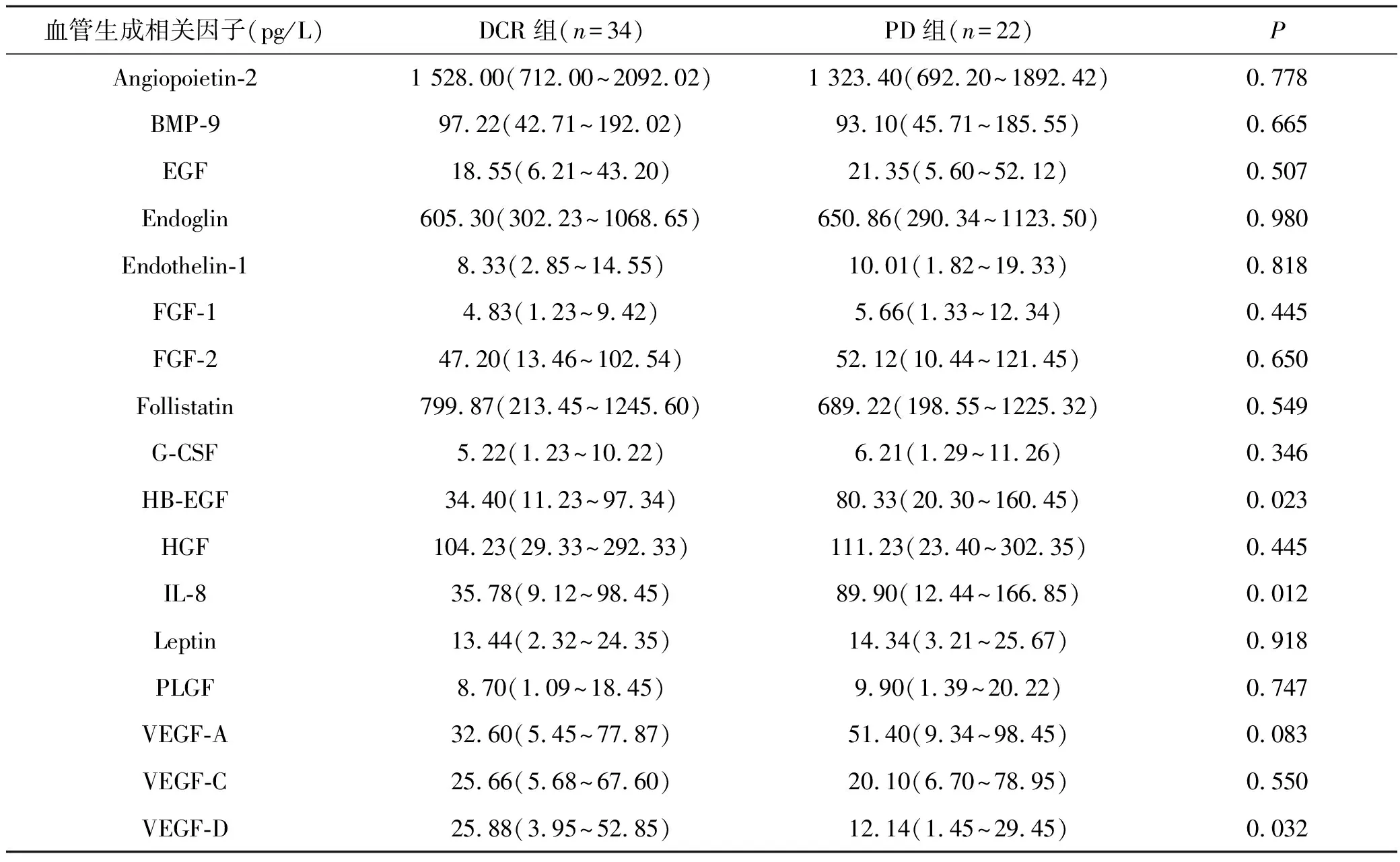
表2 DCR组与PD组血管生成相关生物标志物基线水平比较[M(Min~Max)]
2.3 影响NSCLC患者免疫治疗疗效的临床因素logistic回归分析
Logistic回归分析结果显示,免疫治疗前血清低水平IL-8、组织PD-L1阳性表达(TPS≥1%)为NSCLC患者PD-1抗体治疗达到疾病控制的独立影响因素(OR=14.882,P=0.038;OR=16.459,P=0.011),见表3。
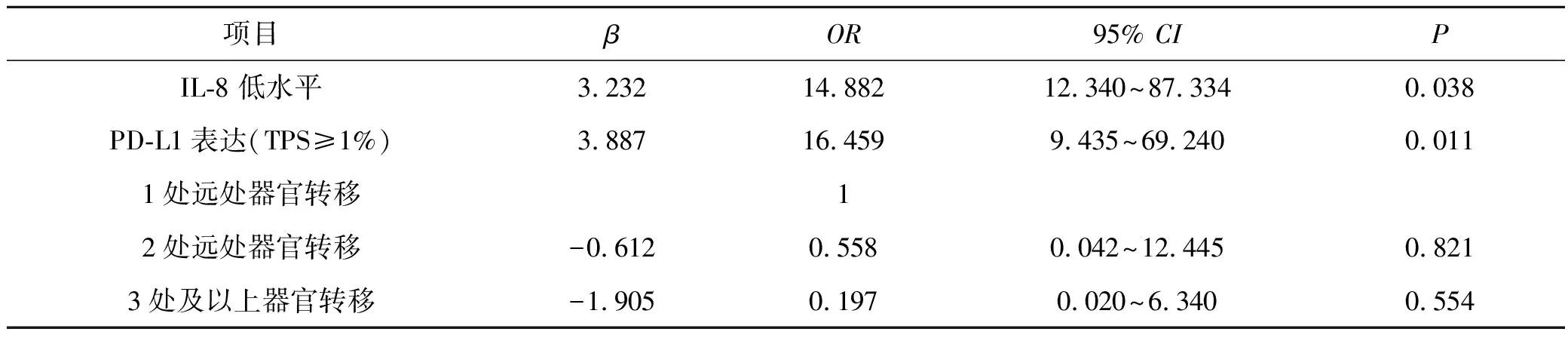
表3 影响NSCLC患者免疫治疗疗效的临床因素Logistic回归分析
3 讨论
ICI的应用逐步改变了晚期肿瘤患者的治疗选择,在黑色素瘤、霍奇金淋巴瘤、肺癌等治疗中取得了突破性进展,显著提高了患者的5年生存期(overall survival,OS)[1-2,9]。然而,只有不到1/3的患者对免疫治疗产生反应,5%~10%患者表现出较强的毒性和副作用[10]。由于免疫治疗起效慢,且存在超进展和假性进展现象,因此,临床迫切需要寻找能够预测免疫治疗疗效的生物标志物,以便对患者进行分群,实现个体化治疗。当前有关免疫治疗的预测标志物是研究热点,其中肿瘤组织PD-L1表达水平是目前临床应用最广泛的标志物,另外MSI和TMB等指标也被写入指南和专家共识,但总体而言,预测能力有限且存在一定争议[4-5]。免疫治疗起效是一个复杂、多层次、动态的反应过程,单一的指标预测能力往往有限,需要结合肿瘤自身及微环境综合分析。本研究从血管生成相关生物标志物的角度,分析其在疾病控制组和疾病进展组中的表达水平差异,初步探索表达水平差异与免疫治疗的相关性。
TME是由一些基质细胞及细胞外基质组成的、肿瘤细胞与免疫细胞发生相互作用的场所[11]。因此,TME的特征可反映机体对肿瘤的免疫状态,可能为ICI治疗提供潜在的疗效预测标志物[12]。肿瘤的发生和发展离不开新生血管。新生血管不仅提供氧气和营养物质,清除废物,还能为肿瘤干细胞提供有利的生存环境,为肿瘤转移和免疫细胞浸润提供通道[7]。血管异常能帮助肿瘤细胞逃避免疫细胞的攻击,这些异常与血管生成相关生物标志物水平升高密切相关,如ANG2和VEGF。Wu等[13]探索了ANG2与免疫检查点治疗黑色素瘤疗效的关系,发现治疗前血浆中ANG2水平较低的患者在接受细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)/PD-L1抗体治疗时,均具有显著较长的OS。Yuan 等[14]则发现接受CTLA-4抗体治疗的晚期黑色素瘤患者中,治疗前血浆VEGF含量高的患者OS显著降低。本研究通过分析17种血管生成相关生物标志物在DCR和PD组中的表达,DCR组患者的基线血清HB-EGF、IL-8显著低于PD组,VEGF-D显著高于PD组。进一步经logistic回归分析显示,IL-8基线低水平为NSCLC患者PD-1免疫治疗达到疾病控制的独立影响因素。PD-L1表达阳性是预测免疫治疗疗效的指标,已被写入多个肿瘤治疗指南[4-5]。本研究同样证实PD-L1表达阳性是免疫治疗达到疾病控制的独立影响因素。HB-EGF被报道在多种肿瘤的诊断和预后中发挥作用,包括卵巢癌、胃癌等,提示高水平的HB-EGF与预后不良相关[15-16]。HB-EGF表达水平与免疫治疗疗效的关系尚未见报道。
IL-8是一种血管生成相关细胞因子,存在趋化因子受体1(CXC-chemokine receptor 1,CXCR1)和CXCR2两个受体。IL-8由单核细胞、内皮细胞和各种上皮细胞产生,可招募嗜中性粒细胞,刺激肿瘤增殖和血管生成[17]。Alfaro等[18]研究发现,IL-8高表达与肿瘤分期及肿瘤负荷明显相关。Hodi等[19]研究发现,采用PD-1/CTLA-4免疫联合治疗黑色素瘤患者,高IL-8与低IL-8水平患者之间的生存风险比超过3倍。IL-8水平和PD-L1表达相关性较低,IL-8对生存的影响是独立的[20]。血清IL-8水平与肿瘤组织CXCL8基因表达、嗜中性粒细胞/单核细胞计数呈明显正相关[21]。血清IL-8水平与CD8+T细胞活化标志物表达水平、T细胞浸润相关转录、干扰素-γ(interferon-gamma,IFN-γ)水平负相关,提示IL-8对适应性免疫存在一定的抑制作用,影响抗原递呈效率和效应T细胞的肿瘤细胞杀伤能力[22],而靶向IL-8可能是破解免疫治疗耐药的方法之一[23]。
本研究较系统地分析了血管生成相关生物标志物与肺癌PD-1免疫治疗疗效的相关性,找到了3个表达差异的因子,其中IL-8水平可能是NSCLC患者PD-1免疫治疗疗效相关的影响因素。本研究作为初步的探索性研究,尚存在一些不足:①疗效的评估需要参考更多指标,如ORR、无进展生存期(progression free survival,PFS)、OS等;②纳入的样本数量较少,需要在更大规模的多中心研究中验证。
为了进一步研究血管生成标志物与免疫治疗的相关性,我们接下来会做两个方面的延续工作:①除检测血管生成相关生物标志物基线水平外,在治疗的过程中动态检测,以期得到变化趋势与治疗疗效的相关性;②从分子、细胞、动物及临床病例中进一步研究IL-8预测免疫治疗疗效的分子机制;③HB-EGF、VEGF-D表达水平与免疫治疗疗效的相关性尚不明确,对于这两个有差异的分子,需要进一步挖掘其临床意义。总结而言,本文的研究结果对免疫治疗疗效预测标志物的研究提供了依据,具有一定的临床参考价值。

