基于数据库分析COL1A2在肝细胞癌组织中的表达及对预后的影响
鄂志野,文怡欣,张 珊,聂 影,赵珈华,海艳洁,鞠宝玲,张红军
(牡丹江医学院 1.免疫学教研室;2.病原生物学教研室;3.附属红旗医院肿瘤科,黑龙江 牡丹江 157011)
肝细胞癌是全球发病率及死亡率均较高危害最为严重的肿瘤之一[1],其死亡率在癌症相关的死亡率中排名第三,每年在全球范围内因肝癌造成的死亡人数超过50万[2]。HCC占所有原发性肝癌(Primary liver cancer,PLC)病例的75%~85%,是PLC的主要组织学类型。在临床中,甲胎蛋白(AFP)作为一种诊断和预后生物标志物发挥着重要作用,但其敏感性和特异性不令人满意,一些生理活动可能影响AFP的表达,因此,筛选对肝癌更敏感的诊断及预后生物标志物对于指导肝癌的治疗具有重要意义。
Ⅰ型胶原蛋白存在于大多数结缔组织和胚胎组织中,是胶原蛋白家族的重要成员,而胶原蛋白家族是细胞外基质的关键结构成分。Ⅰ型胶原蛋白由两条Ⅰ型胶原蛋白α1(COL1A1)链和一条Ⅰ型胶原蛋白α2(COL1A2)链组成。COL1A2具有多种生物学功能,近年来发现可在结肠癌、黑色素瘤等多种组织呈高表达状态,且在癌细胞增殖、分化、侵袭等病理过程中发挥作用[3],本研究通过生物信息学技术探讨COL1A2在HCC组织的表达变化及其对肝癌预后的影响。
1 材料与方法
1.1 癌症的基因分析通过GEPIA 2.0(http://gepia2.cancer-pku.cn/#index)网络平台利用TCGA数据在线分析COL1A2在正常肝组织中及HCC组织中的表达量。通过UALCAN(http://ulcan.path.uab.edu/index.html)在线分析COL1A2与HCC肿瘤分级,分期及TP53基因突变的相关性,探讨COL1A2对HCC发生发展的影响。
1.2 生存分析利用Kaplan-Meier(http://kmplot.com/analysis)网站评估COL1A2的差异表达对HCC整体存活率(OS)、无进展生存率(PFS),无复发存活率(RFS)的影响。
1.3 免疫浸润分析利用TIMER(http://timer.comp-genomics.org/)在线分析TCGA数据库HCC肿瘤组织中COL1A2的表达水平与CD8+T淋巴细胞肿瘤组织浸润的相关性。通过GEPIA 2.0网络平台在线分析HCC癌组织中COL1A2的表达与T淋巴细胞免疫抑制检查点PD-1、CTLA4的相关性。
1.4 GEO分析在GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库中下载GSE101728(HCC中lncRNA和mRNA的表达谱)GSE134568(间充质亚型HCC基因表达数据)GSE135375(miR-221介导HCC基因表达数据)数据集,综合分析验证COL1A2在肝脏组织与HCC癌组织中的差异表达。
2 结果
2.1 COL1A2与HCC发展的相关性COL1A2表达在肝肿瘤组织中上调,并且COL1A2在存活时间的临床意义也得到证实(如图2)。为了进一步了解COL1A2对HCC发展的影响,我们在UALCAN分析了COL1A2的表达与肝癌肿瘤分级,肿瘤分期和TP53基因突变的相关性[4]。如(图1A)所示,随着肿瘤等级的增加,COL1A2表达进一步升高。同样地,随着肿瘤分期的进展,COL1A2表达也明显上升(图1B),表明COL1A2表达水平与HCC的进展正相关。此外,TP53基因是机体的重要抑癌基因。其突变与肿瘤发展密切相关,TP53突变是HCC中最常见的突变,它会影响HCC的进展和预后。我们发现在TP53突变的HCC组织中COL1A2的表达较TP53无突变的HCC组织明显升高(图1C),表明TP53基因突变伴随着COL1A2的高表达,进而提示COL1A2的高表达与肝癌发展有关。
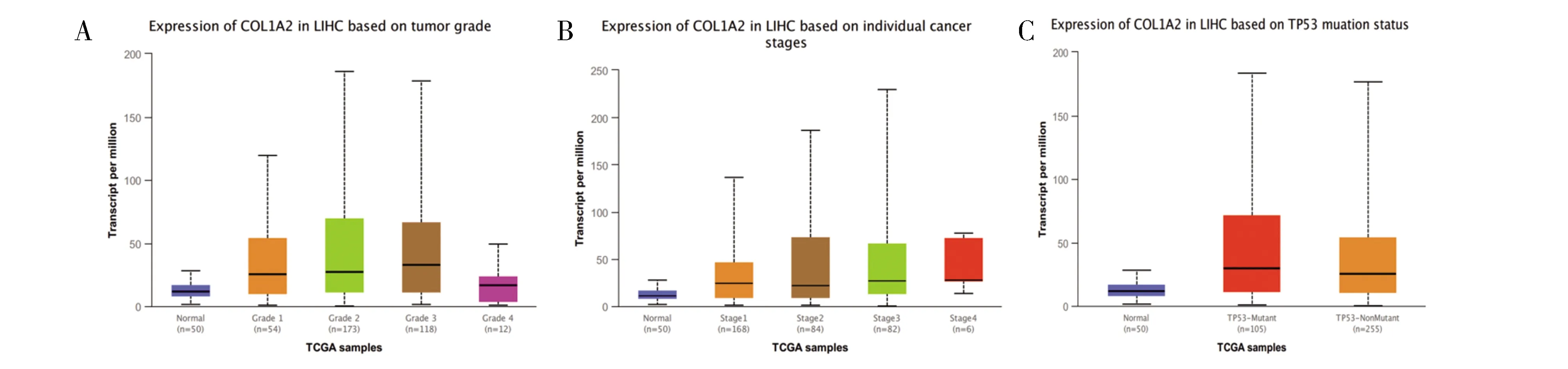
图1 COL1A2表达与肿瘤分级、肿瘤分期和TP53突变的关系
2.2 COL1A2在HCC癌组织中表达及其对患者生存率的影响共纳入369例肝癌(HCC)肿瘤样本和160例正常肝组织样本,在GEPIA[5]中评估COL1A2在HCC癌组织中表达,发现与正常肝组织相比,肝肿瘤组织中COL1A2表达升高(图2A)。为了进一步明确HCC癌组织中COL1A2高表达对HCC发展的影响,我们进行了Kaplan-Meier生存分析[6]。如(图2B~D)所示,COL1A2的表达量影响了患者无进展生存率(PFS)和无复发存活率(RFS),而COL1A2表达高低对总体生存率影响差异不显著,这些结果表明,肝癌组织中COL1A2水平与肝癌患者的生存预后有关,COL1A2表达高预后生存率较高,COL1A2表达低预后生存率相对较低。

图2 COL1A2在正常组织与肿瘤组织中表达量的对比及其表达量的高低对患者生存预后的影响
2.3 COL1A2的表达对肝癌组织CD8+T细胞浸润及抗肿瘤活性的影响运用Timer探讨COL1A2对机体抗肿瘤免疫的影响[7]。显示COL1A2与CD8+T细胞的浸润度显著相关(R=0.339,P=9.39×10-11,图3A)。为进一步分析T细胞介导的抗肿瘤作用,我们评估了两个经典的免疫抑制检查点,CTLA-4和PD-1与COL1A2表达的相关性。如图3B和3C所示,COL1A2表达与CTLA-4和PD-1呈正相关相关,表明肝肿瘤组织中COL1A2升高会伴随肿瘤组织中CTLA-4和PD-1的高表达。因为CTLA-4和PD-1的高表达可以抑制CD8+T细胞的杀伤肿瘤细胞活性,可见COL1A2可以通过调控CTLA-4和PD-1的表达继而抑制CD8+T细胞的杀伤肿瘤细胞活性。
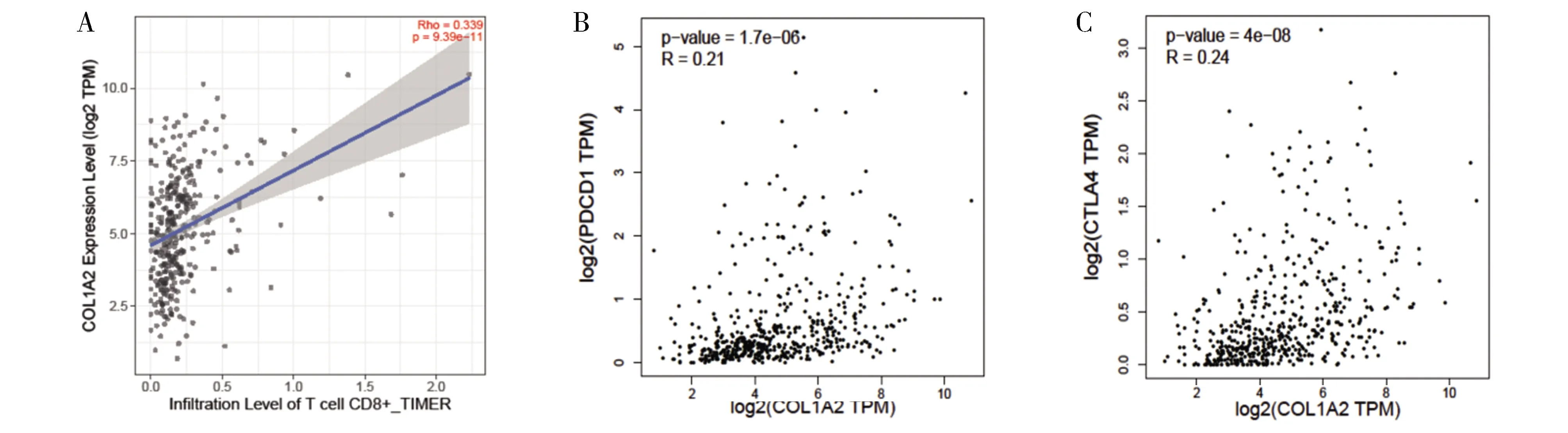
图3 COL1A2的表达与肝癌组织CD8+T细胞浸润及CTLA-4、PD-1表达的相关性
2.4 通过GEO数据库综合分析验证COL1A2在HCC癌组织中的差异表达基因差异分析从GSE101728[8](HCC中lncRNA和mRNA的表达谱)GSE134568(间充质亚型HCC基因表达数据)GSE135375(miR-221介导HCC基因表达数据)三组数据分别用GEO2R进行差异分析,结果保留P≤0.05,Log.FC≥1或≤-1,将三组数据整理如(图4)发现三组数据交集基因中包含COL1A2。从而证明COL1A2对HCC发展的关键的作用。
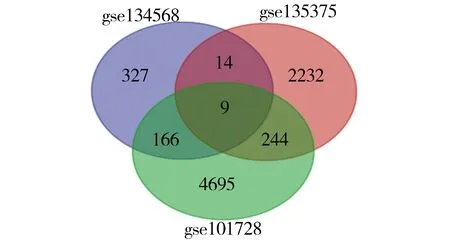
图4 GSE101728、GSE134568和GSE135375三组数据差异基因的交集
3 讨论
COL1A2是编码Ⅰ型胶原α2链的重要基因,Ⅰ型胶原蛋白由两条Ⅰ型胶原蛋白α1(COL1A1)链和一条Ⅰ型胶原蛋白α2(COL1A2)链组成。广泛存在于细胞外基质中。COL1A2 具有多种生物学功能,异常表达的甲基化的COL1A2可以引起机体内环境的改变,从而参与多种疾病的发生发展,如颅内动脉瘤、动静脉畸形、脑出血等[9]。I型胶原纤维是胶原家族的主要成分,被认为是参与肿瘤侵袭和发展。然而,COL1A2在恶性肿瘤中的表达水平仍存在争议。一方面,在肾细胞癌和HCC检测COL1A1频繁启动子甲基化[10],COL1A2在黑素瘤[11],和膀胱癌下调[12]。在另一方面,COL1A2蛋白和mRNA表达的结肠直肠癌[13]和髓母细胞瘤被上调。
本研究主要通过TCGA数据库运用在线工具GEPIA分析COL1A2在HCC组织表达量高于正常组织。生存分析显示,COL1A2低表达的患者无进展生存(PFS)和无复发存活(RFS)生存期要长于高表达的患者,表明肝癌组织中COL1A2水平与肝癌患者的生存预后有关,COL1A2表达高预后生存率较低,COL1A2表达低预后生存率相对较高。有研究发现COL1A2在结肠癌组织中高表达,对肿瘤细胞的增殖、分化及侵袭具有促进作用,同时提高了肿瘤组织的临床分期[15]。我们也在研究中发现随着肿瘤等级的增加,COL1A2表达进一步升高。同样地,随着肿瘤分期的进展,COL1A2表达也明显上升,表明COL1A2表达水平与HCC的进展正相关。此外,TP53基因是机体的重要抑癌基因。其突变与肿瘤发展密切相关,TP53突变是HCC中最常见的突变,它会影响HCC的进展和预后。我们发现在TP53突变的HCC组织中COL1A2的表达较TP53无突变的HCC组织明显升高,表明TP53基因突变伴随着COL1A2的高表达,进而提示COL1A2的高表达与肝癌发展有关。
抗肿瘤免疫是决定肿瘤发展的重要因素,研究探讨了COL1A2对机体抗肿瘤免疫的影响,显示COL1A2与CD8+T细胞的浸润度呈正相关;COL1A2表达与CTLA-4和PD-1正相关,表明肝肿瘤组织中COL1A2升高会伴随肿瘤组织中CTLA-4和PD-1的高表达。CTLA-4和PD-1是两个经典的免疫抑制检查点,CTLA-4和PD-1的高表达可以抑制CD8+T细胞的杀伤肿瘤细胞活性,可见COL1A2可以通过调控CTLA-4和PD-1的表达继而抑制CD8+T细胞的杀伤肿瘤细胞活性。
为进一步综合分析验证COL1A2与肝癌的发展密切相关。从GEO数据库抽取GSE101728(HCC中lncRNA和mRNA的表达谱);GSE134568(间充质亚型HCC基因表达数据);GSE135375(miR-221介导HCC基因表达数据)三组数据进行差异分析取交集,发现三组交集的9个基因里包含COL1A2。显示COL1A2高表达与肝癌的发展密切相关具有普遍性。
肝癌是世界上最具侵略性的癌症之一,筛选对肝癌更敏感的诊断及预后生物标志物对于指导肝癌的治疗具有重要意义。本研究分现,COL1A2可在HCC癌组织中高表达,通过促进TP53基因突变,诱导抗肿瘤细胞的免疫抑制与肿瘤的发展及患者生存密切相关,由此提示COL1A2具有作为筛查肝癌和判断治疗预后的标志物的潜力。

