硼替佐米原料药细菌内毒素检查方法研究*
张 璞
(重庆市食品药品检验检测研究院,重庆 401121)
硼替佐米为首个用于治疗多发性骨髓瘤的蛋白酶抑制剂[1]。硼替佐米作为无菌制剂的非无菌原料药,在N,N-二甲基甲酰胺、甲醇中易溶,在水中几乎不溶。本研究中按2020 年版《中国药典(四部)》通则1143 细菌内毒素检查法[2]和《中国药品检验标准操作规范(2010 年版)》[3],对硼替佐米原料药细菌内毒素的检查方法进行研究,为其他难溶性原料药细菌内毒素检查法的建立提供参考。现报道如下。
1 仪器与试药
1.1 仪器
TAL-40D 型试管恒温仪(湛江安度斯生物有限公司);XPE205 型电子天平(瑞士Mettler Toledo 公司);VG3 S25 型涡旋混匀器(德国IKA 公司);SW-CJ-2FD 型超净工作台(苏州安泰空气技术有限公司)。
1.2 试药
硼替佐米原料药(某企业,批号分别以Ⅰ,Ⅱ,Ⅲ指代)。鲎试剂(湛江安度斯生物有限公司,批号为1910283,灵敏度为0.25 EU/mL,规格为每支0.1 mL;批号为1910143,灵敏度为0.06 EU/mL,规格为每支0.1 mL。福州新北生化工业有限公司,批号为19120812,灵敏度为0.25 EU/mL,规格为每支0.1 mL;批号为19081612,灵敏度为0.125 EU/mL,规格为每支0.1 mL);细菌内毒素工作标准品(中国食品药品检定研究院,批号为150601-202088,规格为每支60 EU);Tris缓冲液(批号为2005190,规格为每支4 mL),细菌内毒素检查(BET)用水(批号为2010100,规格为每支5 mL),均购自湛江安度斯生物有限公司;福州新北生化工业有限公司(批号为19110105,规格为每支5 mL);甲醇为色谱级。
2 方法与结果
2.1 供试品细菌内毒素限值(L)的确定
美国药典论坛42(6)InProcess Revision Bortezomib制订的细菌内毒素限值(L)为应小于16 EU/mg;注射用硼替佐米成人单药治疗推荐剂量为单次1.3 mg/m2,根据2020 年版《中国药典(四部)》规定,L =K / M =[5 EU/(kg·h)]/ [1.3 mg/m2×1.62 m2÷(60 kg·h)]=142 EU/mg,其中K 为机体每千克体质量每小时最大可接受的内毒素剂量,M 为用每千克体质量每小时的最大供试品剂量,故原研药将L 定为应小于25 EU/mg。综合考虑,将硼替佐米原料药细菌内毒素的L 确定为16 EU/mg。
2.2 鲎试剂灵敏度复核试验
按2020 年版《中国药典(四部)》通则1143 细菌内毒素凝胶检查法的相关技术要求,选用标示灵敏度为0.25,0.06 EU/mL 的鲎试剂,以BET 用水为阴性对照(NC)进行灵敏度复核试验。2 个厂家4 批次鲎试剂的灵敏度实测值(λc)均在0.5 λ~2.0 λ 范围内,符合规定,结果见表1。
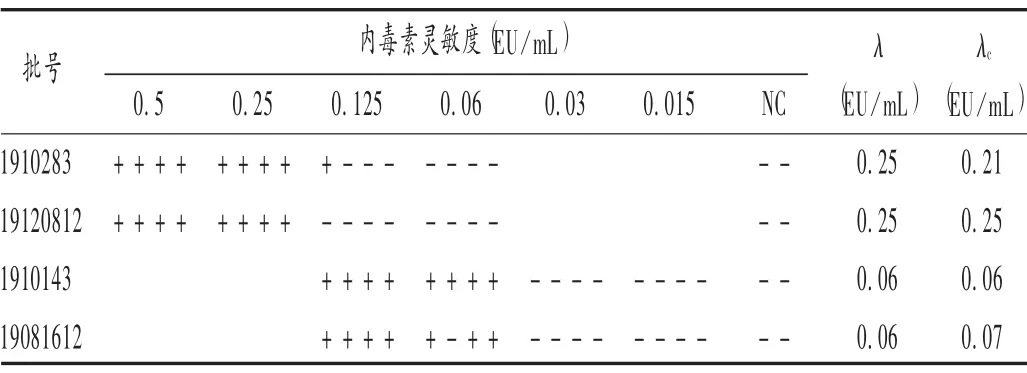
表1 鲎试剂灵敏度复核结果Tab.1 Sensitivity checking results of tachypleus amebocyte lysate
2.3 干扰预试验
凝胶法市售鲎试剂的λ 为0.03~0.5 EU / mL,L 为16EU/mg,按最小有效稀释浓度(MVD)=λ/ L计算,得供试品有效稀释质量浓度为0.002 00~0.031 25 mg/mL。选取2 个不同生产厂家标示灵敏度为0.25 EU/mL 的鲎试剂进行干扰预试验。取3 批样品,加甲醇溶解,制成质量浓度为12.5 mg /mL 的供试品溶液,用Tris 缓冲液稀释至3.125 mg /mL,再加BET 用水稀释,分别制得质量浓度为0.031 25,0.015 62,0.007 80,0.003 90,0.002 00 mg/mL 的系列阴性对照(NPC)溶液;同法操作配制一组含2 λ 细菌内毒素的系列阳性对照(PPC)溶液;以含2 λ 即0.50 EU/mL 的细菌内毒素溶液为阳性对照(PC),以BET 用水为阴性对照(NC)。各平行制作2管,每管加样后混匀,在(37±1)℃的试管恒温仪中保温(60±2)min。试验结果见表2。据此初步判断,供试品溶液质量浓度在0.003 90 mg/mL 时对不同厂家的鲎试剂与细菌内毒素的反应无干扰。

表2 硼替佐米干扰预试验结果Tab.2 The pre-interference test results of bortezomib
2.4 正式干扰试验
根据干扰预试验结果,取样品适量,加甲醇制成质量浓度为12.5 mg/mL 的供试品溶液,再依次用Tris 缓冲液、BET 用水稀释,得质量浓度为0.003 9 mg/mL 的溶液A。将细菌内毒素工作标准品用BET 用水稀释至0.125,0.060,0.030,0.015 EU/mL,即得内毒素工作标准品系列溶液;用溶液A 将细菌内毒素工作标准品稀释至0.125,0.060,0.030,0.015 EU/mL,作为供试品A;每个浓度均平行4 管。以BET 用水作NC,平行2 管。通过试验结果计算出细菌内毒素工作标准品系列溶液的内毒素反应终点浓度(Es)和供试品A 内毒素反应终点浓度(Et)。结果见表3。可见,Es及Et均在0.5 λ~2.0 λ范围内,表明供试品溶液质量浓度为0.003 9 mg/mL时,对2 个厂家的鲎试剂与细菌内毒素的反应均无明显干扰。
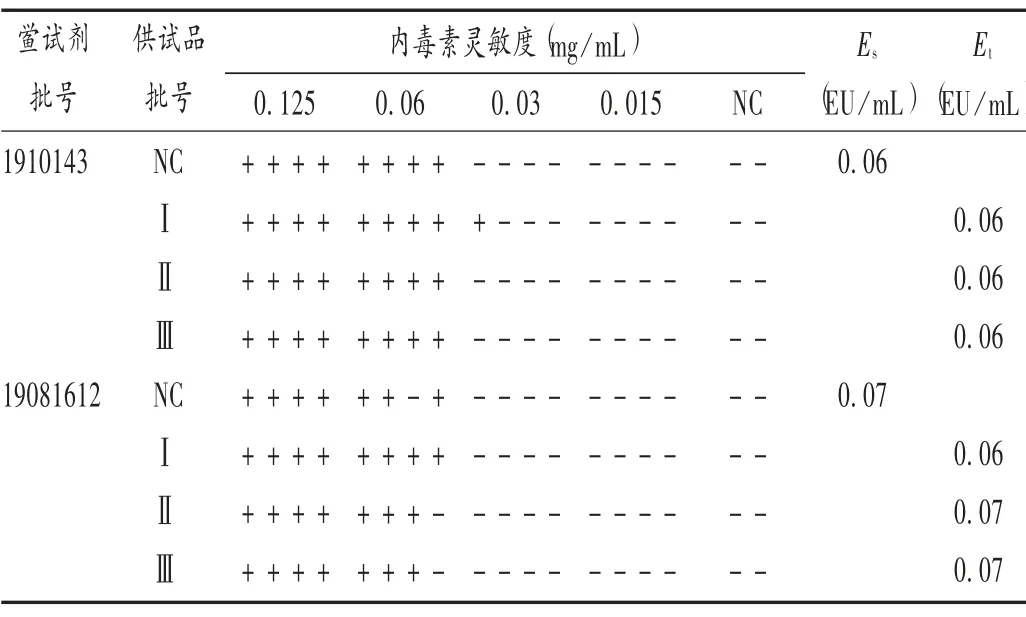
表3 硼替佐米正式干扰试验结果Tab.3 The interference test results of bortezomib
2.5 细菌内毒素检查
取3 批次样品各适量,按2.2 项下0.003 90 mg/mL NPC 溶液的试验方法,同时按药典要求设立PPC 管、NC管和PC 管。取2 个厂家灵敏度为0.06 EU/mL 的鲎试剂进行检查。结果见表4。可见,3 批次样品中细菌内毒素含量均符合规定。
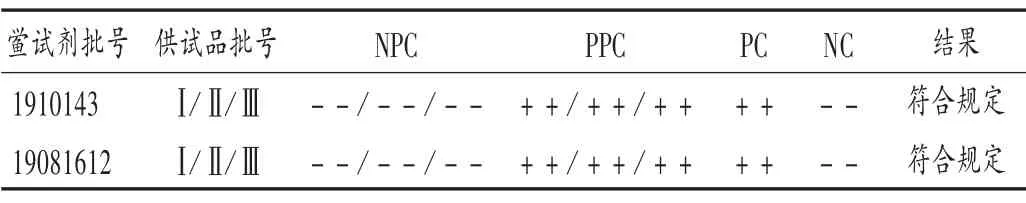
表4 硼替佐米细菌内毒素检查结果Tab.4 The bacterial endotoxin test results of bortezomib
3 讨论
鲎试剂与内毒素的反应需在水溶液中进行,难溶性药物可根据自身的溶解性选择合适的溶剂如二甲基亚砜(DMSO)、乙醇、二氯甲烷等[4-7]进行溶解,然后进行细菌内毒素检查。硼替佐米在水中几乎不溶[8],且高浓度的硼替佐米溶液对鲎试剂与细菌内毒素的凝集反应有干扰[9]。前期研究显示,3 批样品的pH 约为5.4。故首先根据硼替佐米的溶解性选择甲醇溶解,再用Tris 缓冲液调节pH,最后经BET 用水稀释得检查用溶液。经上述方法稀释后,能完全消除各种干扰因素对样品细菌内毒素检查的影响,且方法的灵敏度高、可靠性强。本试验结果显示,当硼替佐米原料药的L 确定为16 EU/mg,质量浓度稀释至0.003 90 mg/mL,选用灵敏度不低于0.06 EU/mL 的鲎试剂进行试验时,对鲎试剂与细菌内毒素的反应无明显干扰。
综上所述,本研究中建立的方法可用于硼替佐米的细菌内毒素检查。

