南海杯叶海绵Phyllospongia sp.的甾体化学成分研究
康永锋,段 松,张红军,甘建红,*
1上海海洋大学食品学院,上海 201306;2中国人民解放军第二军医大学长征医院药学部,上海 200433;3上海水产品加工及贮藏工程技术研究中心;4食品科学与工程国家级实验教学示范中心,上海 201306
海绵属多孔动物门(Porifera),是最原始的低等多细胞动物,海绵多变的生境和原始的进化地位,使其产生并积累了大量结构新颖且具有抗肿瘤、抗寄生虫、抗病毒、抗菌、抗炎和免疫调节等不同生物活性的次生代谢产物,是海洋天然产物的首要来源[2,3]。我国南海海域辽阔,是世界上海绵集中分布的海域之一,多年来南海海绵一直是被研究的海洋天然产物化学研究热点生物之一[4]。早在1933年,美国耶鲁大学的Bergmann教授开始对海绵的化学成分进行研究,从中得到了甾体类成分。1951年,他从海绵Phyllospongiasp.中分离获得了spongothymidine和spongouridine 等核苷类化合物;后来的抗病毒药阿糖腺苷和抗癌药阿糖胞苷就是spongothymidine的合成类似物[5,6]。从海绵研究中获得的laulimalide、peloruside A、salicylihalimide A、variolins、dictyodendrins已作为抗肿瘤药进入临床前研究[7]。
本文的研究对象杯叶海绵Phyllospongiasp.属寻常海绵纲(Demospongiae),网角海绵目(Dictyoceratida),角骨海绵科(Spongiidae)海绵[8]。目前,国内外有很多课题组对该种海绵进行了系列研究报道,从中分离得到许多结构新颖的次生代谢产物,包括二倍半萜类、甾体类、二苯基醚类、甘油糖脂类和神经酰胺类等化合物[9]。其中含有独特的四环或五环scalarane型的二倍半萜类和甾体类化合物占大多数。但其生物活性研究报道较少,为了更好地阐明Phyllospongiasp.中具有生物活性的成分,本实验综合运用各种现代色谱和光谱技术,对提取物的石油醚和乙酸乙酯部位分离的化合物进行研究,并进行细胞毒活性的筛选,丰富了Phyllospongiasp.的成分,为后续该海绵的活性成分的开发与利用奠定了基础。
1 材料与方法
Q-Tof micro YA019型液质联用仪、Bruker AV-600型核磁共振仪、Waters 1525/2996高效液相色谱仪(美国Waters公司);EYELAN-2000型旋转蒸发仪;Sephadex LH-20凝胶柱(美国Pharmacia公司);层析硅胶(200~300目)、TLC高效薄层层析板(烟台江友硅胶开发有限公司);甲醇、乙腈、正已烷(色谱纯,美国Promptar公司);二氯甲烷、甲烷、石油醚、乙酸乙酯、丙酮(分析纯,上海化学试剂公司);氘代试剂(上海思域化工科技有限公司);显色剂用10%硫酸香兰素溶液。
MCF-7(人乳腺癌细胞株)、HT-29(人结肠癌细胞细胞株)、Hep-2(人喉癌上皮细胞株)(上海交通大学细胞中心);HF 90 CO2培养箱(上海力升科学仪器);Nikon Eclipse倒置显微镜,LDZM位式压力蒸汽灭菌锅(上海申安医疗器械厂);Spark多功能酶标仪试剂(瑞士Tecan公司);离心机(上海贝克曼库尔特仪器设备);胎牛血清、DMEM高糖培养基(美国Hyclone 公司);青链霉素混合液、PBS、MTT、胰酶(上海鼎国生物技术有限公司)。
杯叶海绵Phyllospongiasp.(XS-2019.12)样品于2019年12月采自中国南海西沙永兴岛附近,种属名称经上海交通大学林厚文教授和本文作者之一张红军教授鉴定为Phyllospongia属海绵(Phyllospongiafoliascens)。标本(XS-2019.12)存放于上海海洋大学食品学院。
1.1 提取与分离
将冷冻的杯叶海绵(Phyllospongiasp.,干重2.0 kg)切碎后,用丙酮超声1 h提取共3次;每次用二氯甲烷∶甲醇(1∶1)混合溶剂超声1.5 h提取,共3次。合并提取液,减压浓缩得到总浸膏32.0 g,将其混悬分散于90 %的甲醇溶液中,用石油醚萃取3次,浓缩萃取液得到石油醚部位浸膏(12.5 g);再加水将混悬液的甲醇浓度调整至65 %,用二氯甲烷萃取3次,浓缩萃取液得到二氯甲烷部位浸膏(6.3 g)。将石油醚部位浸膏进行减压硅胶柱色谱,二氯甲烷-甲醇(100∶1→5∶1)梯度洗脱,根据 TLC显色合并相似流分得到 7个组分Fr.a ~ Fr.g。对组分Fr.e进行正相硅胶柱色谱,石油醚-乙酸乙酯(100∶1→5∶1)梯度洗脱,根据TLC显色合并相似流分得到5个组分(Fr.e1 ~ Fr.e5)。其中Fr.e-3(13.7 mg)以95%甲醇-水(含0.1%甲酸,2 mL/min,UV 254 nm )经高效液相色谱洗脱,得到化合物1(1.5 mg,tR= 35 min)、2(2.5 mg,tR= 38 min)和3(1.9 mg,tR= 47 min)。Fr.e-4(18.5 mg)以90%甲醇-水(含0.1%甲酸,2 mL/min,UV 254 nm )经高效液相色谱洗脱,得到化合物4(2.4 mg,tR= 32 min)和5(2.7 mg,tR= 39 min)。将二氯甲烷部位浸膏按照上述同样的方法,经HPLC检测合并得到5个组分(Fr.1 ~ Fr.5),其中Fr.3(20.4 mg)以75%甲醇-水(2 mL/min,UV 254 nm)经制备液相色谱洗脱,得到化合物6(2.3 mg,tR= 19 min)、7(1.3 mg,tR= 26 min)和8(2.5 mg,tR= 34 min)。
1.2 细胞毒活性筛选
将MCF-7、HT-29和Hep-2细胞株用含10%新生胎牛血清的DMEM完全培养基培养,37 ℃,5% CO2培养箱培养至细胞覆盖率达85%以上时传代,生长状态良好的细胞用于实验研究[10]。用MTT法检测化合物对MCF-7、HT-29和Hep-2细胞的抑制作用,将三种细胞进行细胞计数后接种于96孔板内(体积为100 μL/孔),设相应浓度的溶媒对照孔,然后加入不同浓度的受试药物100 μL/孔,每个浓度设3个复孔,空白组加入等量含0.1% DMSO的培养基[11]。以顺铂为阳性对照,在培养箱中培养48 h后用MTT法检测细胞生长情况。取出细胞培养板,倒置显微镜下观察细胞形态。每孔加入10 μL MTT,置培养箱中继续培养4 h。弃去MTT,然后在DMSO中溶解[12]。用酶标仪在测定550 nm处的OD值,计算IC50,试验反复进行3次。
2 实验结果
2.1 结构鉴定
从杯叶海绵Phyllospongiasp.的石油醚和二氯甲烷萃取部位首次分离鉴定了8个甾体类化合物(1~8)(见图1)。
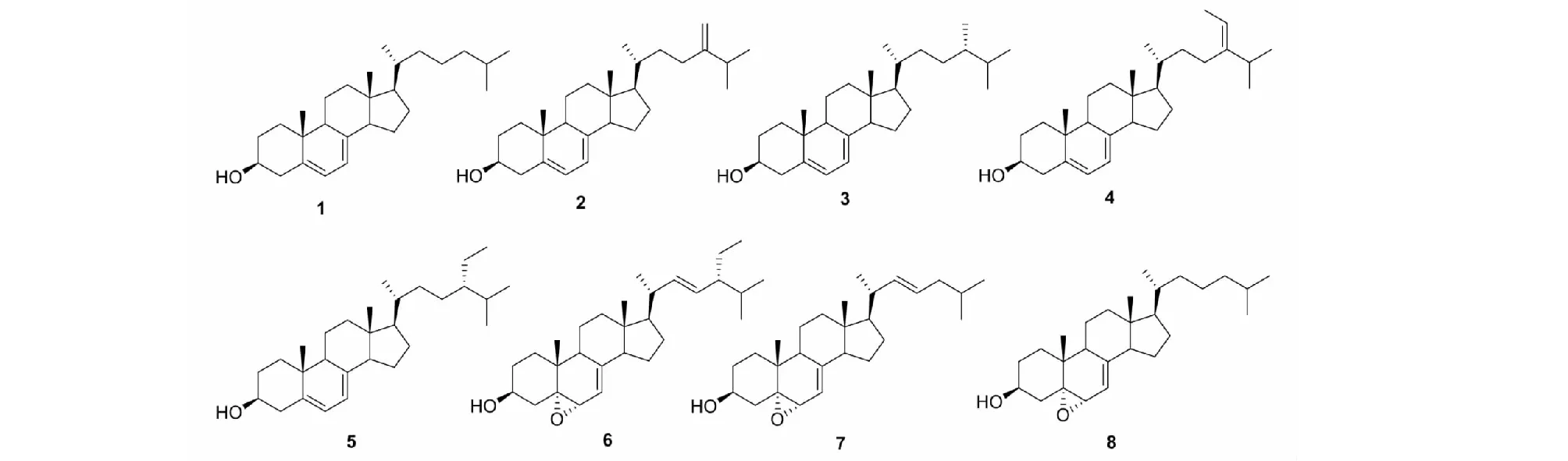
图1 化合物1~8的结构式Fig.1 Chemical structures of compounds 1-8
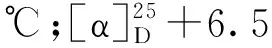
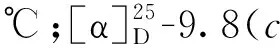
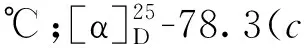
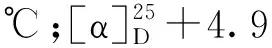
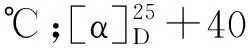
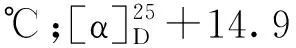
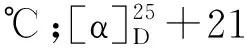
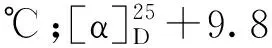
2.2 细胞毒活性实验结果
检测化合物对MCF-7、HCT-116和Hep-2的细胞毒活性,镜下观察可见,化合物3、6和8组细胞生长形态规则,破碎不明显,其余各化合物不同剂量组细胞形态不规则出现细胞破碎等现象,阳性对照顺铂组细胞出现明显的细胞破碎现象。各化合物对以上三种细胞的IC50值如表1所示。化合物7对MCF-7具有显著的细胞毒活性,IC50值为3.9 μmol/L,顺铂为阳性对照(IC50= 6.0 μmol/L);化合物2对Hep-2有较好的细胞毒活性,IC50值为10.6 μmol/L,顺铂为阳性对照(IC50= 6.3 μmol/L)。
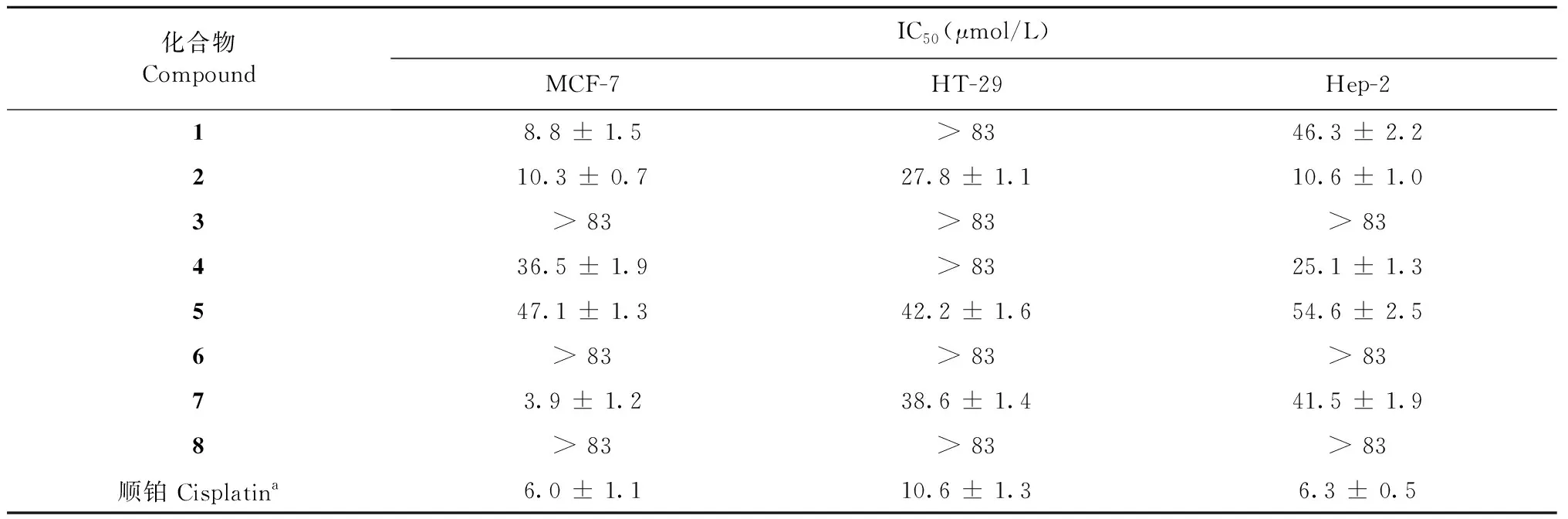
表1 各化合物对MCF-7、HT-29和Hep-2的IC50值
3 结论
本文对采自我国南海西沙群岛的杯叶海绵Phyllospongiasp.进行了化学成分研究,首次从石油醚和二氯甲烷部位中分离得到8个甾体类化合物,并采用MTT法测试了其对MCF-7(人乳腺癌细胞)、HT-29(人结肠癌细胞)和Hep-2(人喉癌上皮细胞)的细胞毒活性试验,其中化合物1、3、4、6、8对人结肠癌细胞HT-29毒活性较弱,IC50均大于83 μmol/L;化合物1、2、7对MCF-7的细胞毒活性显著,IC50分别为8.8、10.3、3.9 μmol/L;化合物2对Hep-2的细胞毒活性较好,IC50为10.6 μmol/L。实验结果表明化合物7的细胞毒活性优于阳性对照药顺铂组,由于该化合物的含量较少,且未有文献报道显著活性,故有望通过结构修饰或有机合成发展成为新的抗肿瘤药物的潜力。这些工作进一步对南海西沙海绵资源和生物活性的考察和研究,寻求高效低毒的新的抗肿瘤化学结构和先导化合物提供了参考依据。

