土壤链霉菌Streptomyces ardus WS-65090产生的teleocidin类化合物及其生物活性研究
张亚妮,吴兆圆,万中义,张志刚,石丽桥,方 伟,柯少勇,王开梅
湖北省生物农药工程研究中心,武汉 430064
微生物为药物和农药的开发提供了大量的先导化合物资源。链霉菌属是放线菌的一个主要类群,链霉菌次级代谢产物结构多样,生物活性显著,被认为是许多抗生素的来源和潜在的药物来源[1]。近年来,从链霉菌中发现了一些具有良好生物活性的代谢产物,例如,阿德加霉素P(aldgamycin P)是分离自土壤链霉菌Streptomycessp.KIB-K1的新大环内脂类化合物,对金黄色葡萄球菌具有显著的抑制作用,MIC值为7.81 μg/mL[2]。化合物endostemonines A~J是首次报道的从一株内生链霉菌属的菌株BS-1 中分离鉴定出的新天然吡咯-2-羧酸酯衍生物,对棉蚜具有很强的致死活性,72 h LC50值为3.55~32.00 mg/L[3]。
在我们从放线菌中寻找活性代谢产物的过程中,发现一株土壤链霉菌StreptomycesardusWS-65090发酵提取物具有较好的杀虫活性,为了明确其活性代谢产物,对其进行了分离纯化,获得了一些teleocidin类化合物。Teleocidin最早是在1960年作为有毒物质由地中海链霉菌菌丝体的甲醇提取物中分离出来[4-6],其拥有独特的吲哚内酰胺骨架,有A-1、A-2、B-1、B-2、B-3和B-4 6种立体构型[7,8],因独特的结构和多样的生物活性而备受关注[9-11]。目前,已从微生物中分离出多种teleocidin结构相关的化合物,如lyngbyatoxins A~C[12,13]、olivoretins A~C[14,15]、14-O-(N-acetylglucosaminyl)teleocidin A[16]和2-oxo-teleocidin A1[17]。这些化合物表现出重要的生物活性,如皮肤刺激物、肿瘤促进剂和PKC激活剂以及细胞毒活性[12-17]。本研究报道的新teleocidin B类构型的类似物及其杀虫与细胞毒活性,丰富了此类化合物的结构类型及活性,也丰富了链霉菌活性代谢产物类型,为其在农用方面的研究提供了基础数据。
1 材料与方法
1.1 仪器
MPC 500旋光计(Waltham,USA);岛津UV-2600 PC紫外分光度计(Shimadzu,Japan);NICOLET IS50 FT-IR红外光谱仪(Thermo Fisher Scientific,USA);Bruker AVANCE 700核磁共振仪(TMS为内标,德国BrukerBioSpin公司);Jasco J-810圆二色光谱仪(日本分光公司),Waters Xevo TQD UPLC-MS超高效液质联用(Waters Corporation,USA);Bruker maXis Q-TOF高分辨质谱(Bruker,Germany);Waters高效液相制备色谱仪器(Waters2525泵,带2767自动收集系统,2996二极管阵列检测器,色谱工作站Masslynx V4.0,Waters,USA);色谱柱:Sunfire C18OBD 制备柱(19 mm×250 mm /10 mm×250 mm,5 μm,Waters,USA)。
1.2 菌株来源
菌株分离于湖北随县山坡土壤(2015年4月采样),编号为WS-65090,在ISP-2培养基上菌落生长旺盛,28 ℃下培养14天,菌落直径7~8 mm,颜色为白色,菌落背面呈淡黄色(见图1)。气生菌丝长而直,表面光滑,孢子稀少(见图2)。将WS-65090菌株的16S rRNA序列以AB184864的登录号筛选到Gen-Bank,与ardus-NBRC 13430菌株的相似性为99.57%。通过形态鉴定和16S rRNA基因序列分析结果,将菌株WS-65090鉴定为链霉菌属StreptomycesardusWS-65090(艰难链霉菌)。菌种现保存于中国典型物保藏中心(武汉,CCTCC),登记号为CCTCCM2020096。
图1 WS-65090菌株的平板菌落形态Fig.1 Colony morphological characteristics of strain WS-65090

图2 WS-65090菌株电镜扫描图片(Bar 2.0 μm)Fig.2 Scanning electron micrograph of strain WS-65090 (Bar 2.0 μm)
1.3 供试昆虫
草地贪夜蛾(Spodopterafrugiperda)初孵幼虫、棉铃虫(Helicoverpaarmigera)初孵幼虫、小菜蛾(PlutellaxylostellaL.)二龄幼虫、豆蚜(Aphiscraccivora)均由湖北省生物农药工程研究中心提供。
1.4 细胞株
人肝癌细胞株HepG2、人恶性黑色素瘤细胞株A875、非洲绿猴肾细胞株Marc-145均由湖北省生物农药工程研究中心实验室常规保存培养。
1.5 培养基
发酵培养基:ISP-2液体培养基:葡萄糖4.0 g/L,麦芽提取物10.0 g/L,酵母提取物 4.0 g/L,pH值调至7.2。
1.6 菌株发酵
将S.ardusWS-65090菌株的斜面菌种接种到含有100 mL种子培养基ISP-2的500 mL锥形瓶中。在28 ℃下,以150 rpm进行振摇培养。发酵96 h后,在无菌条件下,将10%的种子培养物转移到含有100 mL发酵培养基的500 mL锥形瓶中,在28 ℃下,摇床上以150 rpm发酵培养120 h。
1.7 提取与分离
将链霉菌WS-65090菌株的10L发酵液冻干,用乙酸乙酯萃取冻干粉2次,合并乙酸乙酯萃取液,过滤并在真空下旋转蒸发得到粗提取物。将粗提物溶解于甲醇、离心,采用反相制备液相色谱进行分离纯化,色谱柱为Waters Sunfire prep C18OBD柱(19 mm×250 mm,5 μm);乙腈(B)和水(A)为流动相,以24 mL/min的流速梯度洗脱(0~2 min,5%B;2~27 min,5%→100% B;27~32 min,100%B;32~37 min,100%→5%B;37~40 min,5%B),采用PDA 全波长扫描,收集得到13个组分(Fr1~Fr13)。其中,组分Fr4~13对草地贪夜蛾、棉铃虫、小菜蛾和蚜虫具有较强的毒杀活性,采用反相制备液相色谱分别对组分Fr4~13进行进一步分离纯化,色谱柱为Waters Sunfire prep C18OBD柱(19 mm×250 mm,5 μm);乙腈(B)和水(A)为流动相,以24 mL/min的流速梯度洗脱(0~2 min,20%B;2~22 min,20%→100%B;22~26 min,100%B;26~30 min,100%→20%B;30~33 min,20%B)。采用PDA全波长扫描,由Fr11分离到了化合物1(19.08 mg),由Fr12获得了化合物2(10.96 mg),由Fr7获得了化合物3(28.70 mg),由Fr8获得化合物4(16.93 mg),从Fr5获得化合物5(10.33 mg)。
1.8 杀虫活性测定
采用24孔微量盘人工饲料表面涂布法测定了化合物1~5对草地贪夜蛾、棉铃虫和小菜蛾幼虫的杀虫活性。首先将每种化合物溶解在甲醇中,并用含0.1%吐温-80的水稀释至0.25、0.125、0.63、0.031、0.016 mg/mL。将40 μL样品溶液转移到24孔微量盘人工饲料表面。然后,将10只幼虫放入孔中,在25 ℃下培养。每一种浓度使用30只幼虫(每孔10只幼虫)。72 h后,与85%阿维菌素阳性对照组和阴性空白对照组比较,目测死亡率,计算致死浓度50%值(LC50)。
化合物1~5对蚜虫的杀虫活性采用浸渍法[18]。每一种化合物用0.1%吐温-80乙醇溶液制备成5种浓度梯度(0.8、0.4、0.2、0.1、0.05 mg/mL)。在实验室条件下,将带蚜虫大豆幼苗浸入不同浓度的供试样品溶液5 s,吸取多余的溶液,然后置于室温培养。每种处理重复3次,72 h后,与阴性对照组和85%阿维菌素阳性对照组比较,观察死亡率。然后计算致死浓度50%值(LC50)。
1.9 体外细胞毒活性测定
化合物1~5对HepG2、A875和Marc-145 3种细胞系的体外细胞毒活性采用MTT法[19]。实验重复3次,用统计软件SPSS16.0进行数据分析并计算样品的半数抑制浓度(IC50)。
2 结果与分析
2.1 化合物结构鉴定
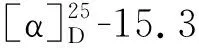
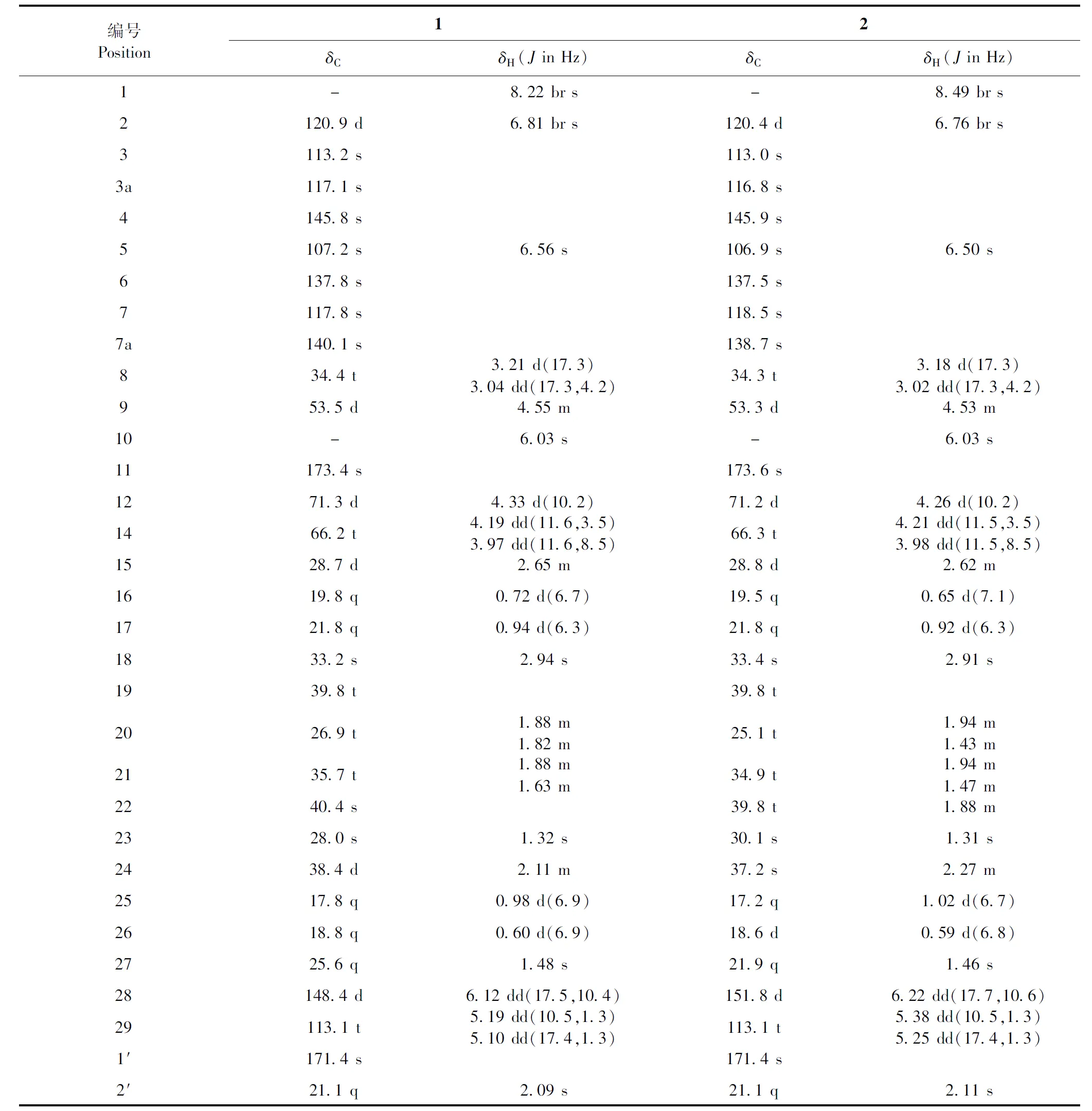
表1 化合物1和2的1H NMR(700 MHz)和13C NMR(175 MHz)数据(CDCl3)

图3 化合物1~5的化学结构Fig.3 Structures of compounds 1-5
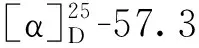

图4 化合物1和2的HMBC和1H-1H COSY相关信号Fig.4 1H-1H COSY and HMBC correlations of compounds 1 and 2
虽然化合物1和2具有相同的平面结构,且CD谱表明两者在220~340 nm呈现相似的科顿效应(见图5),但它们的一些核磁共振数据却有很大不同,表明它们是立体异构体。化合物1和2在二维NOESY谱中并未表现出明显的相关,根据1和3,2和4的1H和13C NMR中化学位移的相似性,推测1的立体中心的相对构型与3相同,2与4相同。由于未能成功获得化合物1和2的晶体,通过化学方法碱水解实验进一步确定1和2的绝对构型。分别用相同质量的0.1 N氢氧化钠溶液水解化合物1和2[21],应用UPLC-MS将它们的水解产物分别与共同分离的化合物teleocidin B-2(3)、B-3(4)进行比较分析,通过比较其紫外吸收光谱、分子离子、色谱数据及CD谱(补充数据),确认化合物1和2的水解产物分别为化合物teleocidin B-2、B-3,而teleocidin B-2、B-3的立体构型早在20世纪80年代通过X-Ray确定[8]。因此,1与teleocidin B-2(3)具有相同的立体结构,为9S,12S,19R,22S;2与teleocidin B-3(4)具有相同的立体结构,为9S,12S,19S,22S。
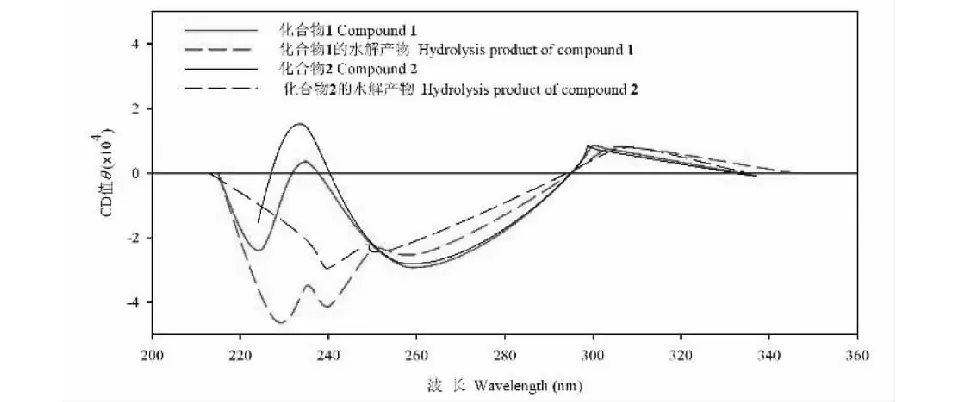
图5 化合物1~4的CD谱Fig.5 CD spectrum of compounds 1-4
化合物3白色无定形固体;ESI-MS:m/z452.73 [M+H]+,450.77 [M-H]-;1H NMR(700 MHz,CDCl3)δ:8.20(1H,br s,H-1),6.81(1H,br s,H-2),6.55(1H,s,H-5),6.12(1H,dd,J= 17.5,10.4 Hz,H-28),5.18(1H,dd,J= 10.5,1.4 Hz,H-29),5.10(1H,dd,J= 17.4,1.3 Hz,H-29),4.35(1H,d,J= 10.2 Hz,H-12),4.34(1H,m,H-9),3.74(1H,dd,J= 11.4,3.8 Hz,H-8),3.54(1H,dd,J= 11.4,8.5 Hz,H-14),3.16(1H,d,J= 17.3 Hz,H-8),3.00(1H,dd,J= 17.3,3.9 Hz,H-8),2.93(3H,s,H-18),2.62(1H,m,H-15),2.11(1H,m,H-24),1.90~1.82(2H,m,H-20),1.88~1.62(2H,m,H-21),1.48(3H,s,H-27),1.32(3H,s,H-23),0.98(3H,d,J=6.8 Hz,H-25),0.93(3H,d,J=6.3 Hz,H-17),0.70(3H,d,J=6.7 Hz,H-16),0.60(3H,d,J=6.9 Hz,H-26);13C NMR(175 MHz,CDCl3)δ:174.4(C-11),148.5(C-28),145.9(C-4),140.0(C-7a),137.8(C-6),120.8(C-2),117.6(C-7),117.2(C-3a),113.9(C-3),113.1(C-29),107.0(C-5),71.1(C-12),65.3(C-14),56.1(C-9),40.4(C-19),39.8(C-22),38.4(C-24),35.8(C-21),34.0(C-8),33.3(C-18),28.6(C-15),28.1(C-23),26.9(C-20),25.6(C-27),21.9(C-17),19.8(C-16),18.9(C-26),17.8(C-25)。以上数据与文献[8,22]基本一致,故化合物3鉴定为teleocidin B-2。
化合物4白色无定形固体;ESI-MS:m/z452.73 [M+H]+,450.86 [M-H]-。1H NMR(700 MHz,CDCl3)δ:8.46(1H,br s,H-1),6.76(1H,br s,H-2),6.47(1H,s,H-5),6.22(1H,dd,J= 17.7,10.6 Hz,H-28),5.38(1H,dd,J= 17.7,1.2 Hz,H-29),5.25(1H,dd,J= 10.6,1.2 Hz,H-29),4.35(1H,m,H-9),4.29(1H,d,J= 10.2 Hz,H-12),3.76(1H,dd,J= 11.4,3.7 Hz,H-14),3.57(1H,dd,J= 11.4,8.5 Hz,H-14),3.13(1H,d,J= 17.1 Hz,H-8),2.98(1H,dd,J= 17.4,3.7 Hz,H-8),2.90(3H,s,H-18),2.60(1H,m,H-15),2.27(1H,m,H-24),1.94~1.42(2H,m,H-20),1.94~1.42(2H,m,H-21),1.47(3H,s,H-27),1.31(3H,s,H-23),1.02(3H,d,J=6.8 Hz,H-25),0.92(3H,d,J=6.3 Hz,H-17),0.65(3H,d,J=6.8 Hz,H-16),0.63(3H,d,J=6.8 Hz,H-26);13C NMR(175 MHz,CDCl3)δ:174.6(C-11),151.9(C-28),146.0(C-4),138.6(C-7a),137.5(C-6),120.3(C-2),118.3(C-7),116.8(C-3a),113.7(C-3),111.4(C-29),106.7(C-5),71.0(C-12),65.5(C-14),56.0(C-9),39.8(C-19),39.6(C-22),37.2(C-24),34.9(C-21),33.9(C-8),33.4(C-18),30.1(C-23),28.7(C-15),25.1(C-20),21.9(C-17),21.8(C-27),19.5(C-16),18.6(C-26),17.2(C-25)。以上数据与文献[8,22]基本一致,故化合物4鉴定为teleocidin B-3。
化合物5白色无定形固体;ESI-MS:m/z438.73 [M+H]+,436.68 [M-H]-。1H NMR(700 MHz,CDCl3)δ:8.53(br s,1H,H-1),6.97(d,J= 8.1 Hz,1H,H-6),6.82(br s,1H,H-2),6.48(d,J= 8.1 Hz,1H,H-5),6.20(dd,J=17.7,10.6 Hz,1H,H-21),5.30(d,J= 19.0 Hz,1H,H-22),5.26(d,J= 10.7 Hz,1H,H-22),5.09~5.06(m,1H,H-25),4.34(d,J= 10.0 Hz,1H,H-12),4.33(br s,1H,H-9),3.74(dd,J= 11.3,4.1 Hz,1H,H-14),3.55(dd,J= 11.3,8.5 Hz,1H,H-14),3.15(br d,J= 17.2 Hz,1H,H-8),3.02(dd,J= 17.3,3.6 Hz,1H,H-8),2.91(s,3H,H-18),2.59(m,1H,H-15),1.99~1.81(m,2H,H-23),1.96~1.89(m,2H,H-24),1.63(s,3H,H-28),1.45(s,3H,H-20),1.39(s,3H,H-27),0.91(d,J= 6.3 Hz,3H,H-16),0.60(d,J= 6.7 Hz,3H,H-17);13C NMR(175 MHz,CDCl3)δ:174.3(C-11),149.2(C-21),146.7(C-4),137.7(C-7a),131.7(C-26),124.8(C-25),121.3(C-2),120.6(C-6),120.3(C-3),118.7(C-7),114.1(C-3a),112.4(C-22),106.2(C-5),71.3(C-12),65.4(C-14),55.8(C-9),43.6(C-19),38.2(C-23),34.3(C-8),33.2(C-18),28.8(C-15),25.9(C-27),25.0(C-20),23.4(C-24),21.8(C-16),19.6(C-17),17.6(C-28)。以上数据与文献[7,23,24]基本一致,故化合物5鉴定为teleocidin A-2。
2.2 化合物活性测试结果
2.2.1 杀虫活性测试结果
化合物1~5对草地贪夜蛾、棉铃虫和小菜蛾幼虫的活性测定,采用24孔盘人工饲料表面涂布法,对蚜虫的测定采用浸渍法。72 h杀虫活性结果如表2所示,化合物1对草地贪夜蛾、棉铃虫、小菜蛾这3种供试昆虫的活性是这5个化合物中表现最强的,其LC50值分别为42.6、36.5、66.4 μg/mL;其次为化合物2,LC50值分别为44.8、44.2、68.1 μg/mL;化合物3~5对这3种供试昆虫的LC50值为76.6~168.3 μg/mL。这5个化合物对蚜虫表现出中等的杀虫活性,其LC50值为144.5~206.8 μg/mL。而阳性对照阿维菌素对这4种供试昆虫的活性均高于化合物1~5,其LC50值分别为2.2、1.9、3.1、1.7 μg/mL。
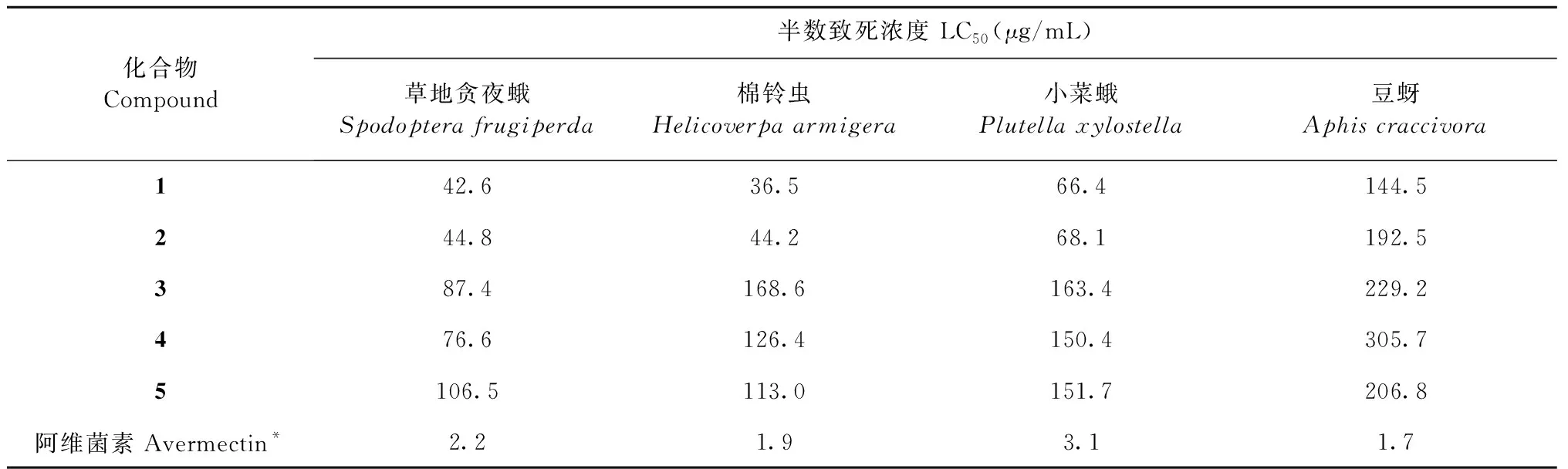
表2 化合物1~5对4种供试昆虫的杀虫活性
2.2.2 体外细胞毒活性
化合物1~5的细胞毒活性测试采用MTT法。结果表明,与阳性对照5-氟尿嘧啶相比,这些化合物的细胞毒活性较强,对A875、HepG2和Marc-145细胞系的IC50值为3.08 ± 1.04~18.40 ± 2.06 μM(表3)。具体而言,1对这3种细胞系表现出细胞毒活性的IC50值分别为15.53 ± 2.53、4.64 ± 0.95、13.52 ± 2.88 μM;2对这3种细胞系的IC50值为11.72 ± 1.42、5.29 ± 1.95、13.86 ± 3.16 μM,与化合物3~5相比,显示出近似的细胞毒活性。
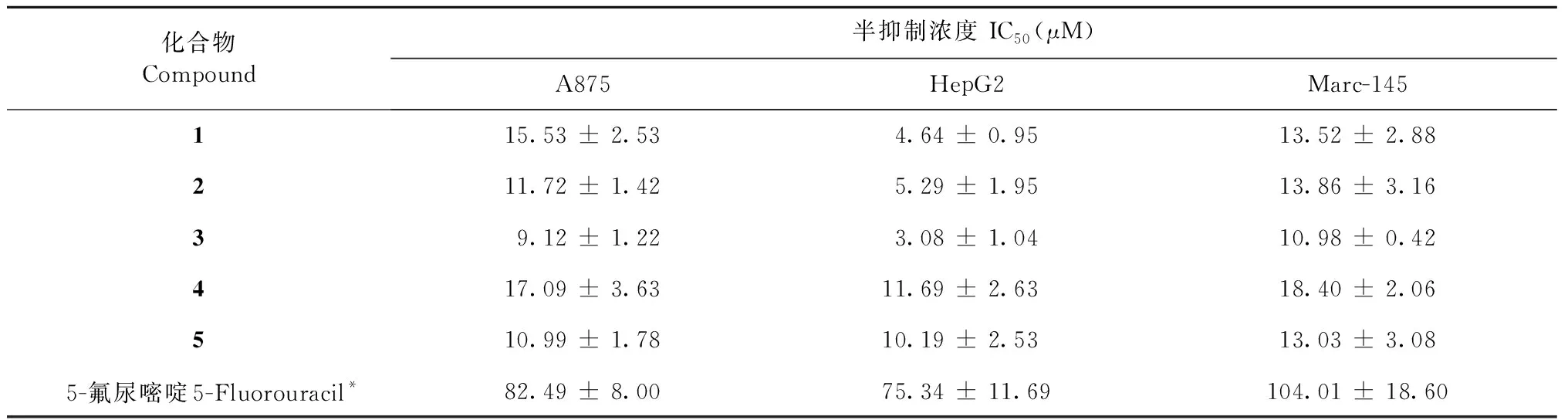
表3 化合物1~5对A875、HepG2和Marc-145细胞系的体外细胞毒活性
3 结论
从链霉菌StreptomycesardusWS-65090发酵提取物中分离得到5个teleocidin类化合物,这些化合物均具有杀虫和细胞毒活性。其中14-O-acetylteleocidin B-2(1)是一种新的化合物,14-O-acetylteleocidin B-3(2)是一种新的天然产物,首次对其核磁共振波谱数据进行了详细阐述。这也是近年来首次从土壤来源的链霉菌菌株中分离出的teleocidin B类型结构的化合物,其对草地贪夜蛾、棉铃虫、小菜蛾和蚜虫具有杀虫活性。另外,这两种新的teleocidin类似物在C-14处含有乙酰基,其杀虫活性强于已知的三种化合物。结合细胞毒活性的实验结果,说明了teleocidin类似物的C-14位的乙酰基基团对其生物活性有重要影响。Teleocidin类化合物生物活性多集中在医用活性方面,本研究报道的化合物丰富了teleocidin类化合物的种类,扩展了生物活性,为其在农用方面的研究提供了探讨。

