中药及天然产物抗子宫内膜癌作用及机制的研究进展
李 璐,周 欣,龚小见,赵 超*
1贵州师范大学 贵州省山地环境信息系统与生态环境保护重点实验室;2贵州师范大学 喀斯特山地生态环境保护与资源利用协同创新中心;3贵州师范大学 贵州省药物质量控制及评价技术工程实验室;4贵州师范大学 天然药物质量控制研究中心,贵阳 550001
子宫内膜癌(endometrial cancer,EC)又称子宫体癌,是发生于子宫内膜的一组上皮性恶性肿瘤,通常在绝经后发病,主要症状表现为子宫异常出血,阴道异常排液,下腹疼痛或有肿块等[1]。目前,EC的主要治疗方式是手术,对于中、高复发风险的患者,可选择化疗、放疗或其联合治疗。虽然这些传统的治疗手段效果显著,但也会产生严重的副作用,如肝肾损害、胃肠道毒性、骨髓抑制、月经不调等[2];此外,长期治疗也会出现化疗耐药,影响治疗进展。
已有研究证实,给予患者西医治疗同时,加以中药辅助干预,可以发挥明显的增效减毒作用,改善患者的生活质量[3]。传统中药在辅助治疗EC方面已发挥了显著优势,继续发掘低毒、广谱的抗癌药物成为了抗肿瘤研究的重点,由于天然产物的资源丰富、药理作用多样等特点,近年被研究者们广泛研究。笔者通过查阅近五年来国内外关于中药和天然产物抗EC的体内外实验研究,归纳总结了其潜在的作用机制,以期为中药和天然产物应用于EC的临床治疗提供参考。
1 中药抗EC的作用机制
古代中医医籍中“崩漏”“经断复来”“五色带下”“癥积”等论述与EC的临床症状相似[4],林丽珠[5]、蒋士卿[6]和孙伟芬[7]教授将EC病因病机归为“热、毒、痰、瘀、虚”,五脏多与肝、脾、肾密切相关,可采用活血化瘀、清热解毒、祛痰散结、扶正祛邪等功效为主的中药进行治疗,并在临床应用中富有成效。
中药活性成分丰富,复方中药配伍多样(见表1),可通过多靶点治疗方式,发挥多方位全面的药效。中药及其制剂在EC治疗方面的独特优势,已被大量实验所证实。根据中医辨证论治理论,将其大致分为清热类、补虚类、化瘀类、止血类。
1.1 清热类
具有清热解毒作用的连花汤是治疗EC的有效方,Bao等[8]发现连花汤通过激活AKT/mTOR通路抑制细胞自噬,诱导细胞凋亡,进而抑制HEC-1-A细胞生长。六神丸具有清热解毒、消肿止痛等功效,Liu等[9]发现六神丸能诱导DNA损伤,抑制JEC细胞的增殖和迁移,促进细胞凋亡;并证明复方六神丸抗EC的作用强于单味药雄黄,提示了复方中药多成分、高疗效的特点。
1.2 补虚类
补肾养血方具有益气补肾的功效,Chen等[10]采用体内外实验研究,发现补肾养血方可有效治疗EC,其作用机制是调节PI3K/AKT信号通路,抑制细胞增殖和迁移,加速细胞凋亡。具有补气升阳、益卫固表等功效的黄芪被证明能有效抗EC。Wang等[11]将黄芪注射液作用于HEC-1-B细胞后,能够显著降低TGF-β1蛋白含量和mRNA表达水平,进而抑制细胞的增殖和侵袭能力。Ouyang等[12]用黄芪注射液干预HEC-1-B细胞后,与Qiu得到了相同的结果。
1.3 化瘀类
桂枝茯苓汤具有活血、化瘀、消癥之功,常用作妇科疾病治疗,He等[13]为考察桂枝茯苓汤的抑瘤疗效,建立了HEC-1-B人EC荷瘤裸鼠模型,研究发现桂枝茯苓汤能抑制肿瘤生长,诱导肿瘤细胞凋亡;并推断其抗EC的可能分子机制是调控caspase-3和Bcl-2的表达水平。莪术归肝、脾经,常用作治疗气滞血瘀所致的癥瘕积聚,莪术油注射液常用于肿瘤的治疗[14]。Li等[15]证明,莪术油注射液可抑制HEC-1-B细胞增殖,通过下调Bcl-2蛋白的表达、上调Caspase-3和Bax蛋白的表达来诱导细胞凋亡。三七具有化瘀止血,活血定痛的功效。三七的主要有效成分三七总皂苷被Tan等[16]证明能干扰EC细胞增殖、转移,促进细胞凋亡作用;其作用机制可能与下调VEGF水平,抑制PI3K/AKT/mTOR信号通路的活性有关。
1.4 止血类
地榆常为凉血止血之药,可治崩漏量多血红,临床上也用作子宫肌瘤、宫颈癌等妇科疾病的治疗。Liu等[17]采用地榆提取液干预HEC-1-B细胞后,观察到凋亡相关蛋白Cleaved Caspase-3和Bax表达水平上调,炎症因子IL-1β、IL-8、TNF-α的表达下调,结果表明地榆可以调节细胞中相关炎症因子和凋亡相关蛋白,抑制EC细胞生长。

表1 抗EC的复方中药组成及干预的信号通路
2 天然产物抗EC的作用机制
根据近5年文献报道,抗EC的天然产物主要集中在植物药,本文将其活性成分主要分为黄酮类、多酚类、生物碱类、萜类、三萜类、醌类、苯丙素类、有机含硫化合物、甾类和其他类(见表2),并分类阐述了药理作用机制:主要通过单一或者协同方式调控NF-κB、PI3K/AKT/mTOR、MAPK、JAK/STAT3、Wnt等多种信号通路,抑制或活化通路中相关因子的磷酸化,干预与细胞增殖、转移、凋亡、自噬相关的蛋白或基因表达,发挥抑制细胞增殖、阻断肿瘤扩散和转移、诱导细胞凋亡和调节细胞自噬等作用。

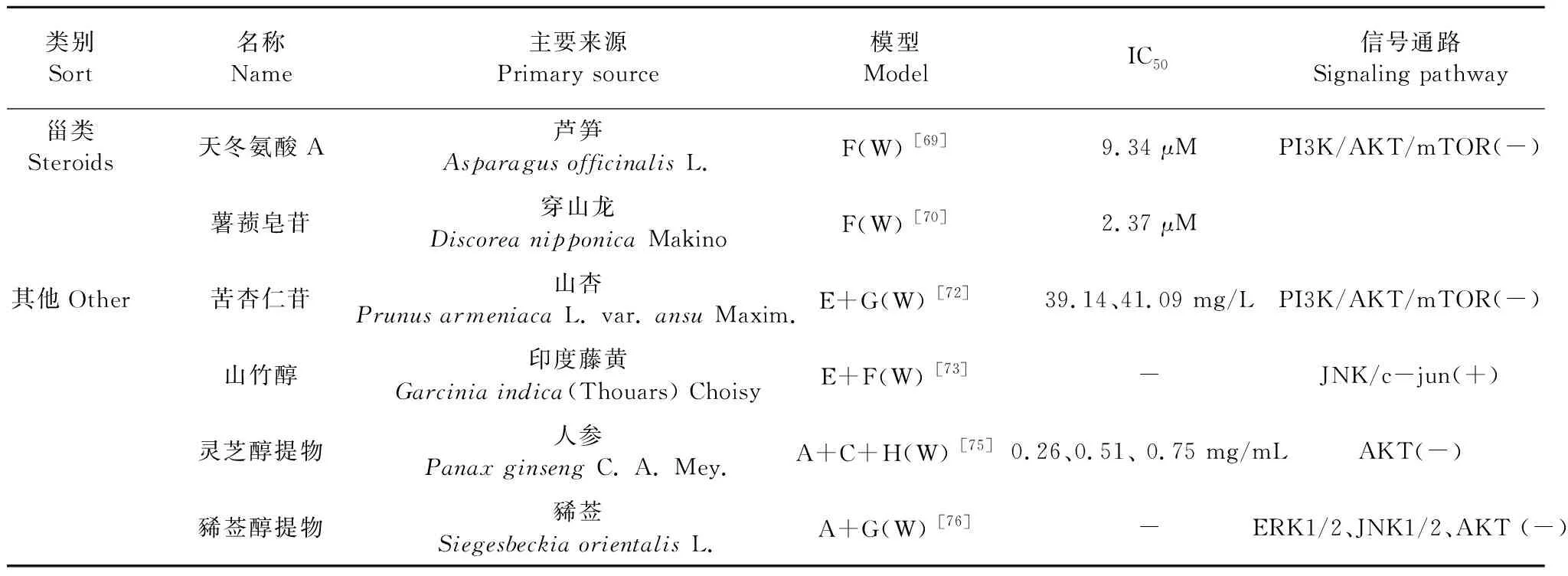
表2 抗EC的天然产物及干预的信号通路

续表2(Continued Tab.2)
续表2(Continued Tab.2)
2.1 黄酮类
2.1.1 查尔酮类
Wu等[18]利用体外和体内实验发现异甘草素可诱导EC细胞凋亡、自噬,抑制细胞生长;结果表明与激活ERK信号通路,诱导G2/M期细胞阻滞,提高Caspase-7、LC3-II、p53蛋白的表达有关。Chen等[19]证明异甘草素通过抑制TGF-β/Smad信号通路,有效抑制子宫内膜癌细胞的迁移,减少HEC-1A-Luc裸鼠的肿瘤转移。
2.1.2 二氢黄酮类
橙皮苷能上调促凋亡基因caspase-3、Bax、Bik的表达,下调抗凋亡基因Bcl-2的含量,发挥抗增殖促凋亡作用;运用转录组测序方法,推测橙皮苷诱导细胞凋亡可能与抑制ERα、MAPK/ERK、PI3K/AKT/mTOR和JAK/STAT信号通路有关[20]。
2.1.3 黄酮醇类
Chen等[21]用桑黄素干预AN3-CA细胞后,发现桑黄素可以降低细胞的侵袭能力,诱导细胞的凋亡;并推测其作用机制可能与抑制MMP-2和MMP-9蛋白的表达有关。山奈酚可阻滞MFE-280细胞于G2/M期,激活线粒体介导的细胞凋亡,抑制细胞迁移和细胞侵袭,其分子机制与抑制PI3K/AKT/mTOR通路有关[22]。
2.2 多酚类
Liu[23]、Chen等[24]研究发现,姜黄素通过下调MMP-2、MMP-9和CyclinD1的表达,进而抑制HEC-1-B细胞的增殖、侵袭和转移。姜黄素能下调Ishikawa和HEC-1-B细胞中CXCR-4、SDF-1、MMP-2、MMP-9的表达,发挥其抑制癌细胞迁移的作用[25]。Jin等[26]证明姜黄素通过上调cyclinD1蛋白泛素化水平,诱导cyclinD1蛋白降解,进而介导Ishikawa细胞周期G1/S期阻滞,并推断其分子机制可能和受到CHIP基因的直接或者间接调控有关。姜黄素还可下调EMT基因的表达,阻滞ERK信号转导通路,抑制EMT的发生和细胞的侵袭转移[27]。
白藜芦醇可通过抑制MAPK和ERK的激活,发挥抑制细胞自噬,促进细胞凋亡的作用,并且白藜芦醇联合自噬抑制剂可以更有效地抑制EC细胞生长[28]。Wen等[29]发现紫檀芪是一种很好的抗EC辅助药物,它能有效地协同醋酸甲地孕酮治疗EC,上调细胞凋亡标志物caspase-3的裂解,下调Bcl-2和Bcl-xL的表达,诱导细胞线粒体途径凋亡;下调细胞周期调节因子cyclin D1、cyclin B1和Cdk4的表达,抑制细胞增殖。其机制可能是通过减少ER的表达,抑制STAT3和MAPK/ERK信号通路,抑制癌细胞的生长和存活。
2.3 生物碱类
苦参碱阻滞细胞于G1期,抑制细胞增殖。下调VEGF的表达,抑制细胞转移[30]。氧化苦参碱能通过下调MMP-2和MMP-9的表达,进而抑制HEC-1-B细胞的侵袭和转移[31]。千金藤素通过上调miR-215的表达,进而抑制eIF4E及其活性形式p-eIF4E的表达来实现促进RL-952细胞凋亡[32]。小檗碱也可阻滞HEC-1-A细胞周期于G0/G1期,抑制细胞迁移与增殖,诱导细胞凋亡[33]。此外,Wang等[34]利用体内外实验证明了小檗碱主要通过上调miR-101以调控COX-2的转录,来抑制EC细胞的生长、侵袭和转移。吴茱萸碱通过增加HEC-1-A细胞内ROS水平,以及激活p38信号通路,抑制细胞增殖,促进细胞凋亡,增强细胞放射敏感性[35]。α-茄碱和α-卡茄碱是茄科植物中常见的生物碱,其通过降低AKT和ERα的表达来抑制RL95-2细胞增殖[36]。有研究表明,辣椒素可通过辣椒素受体(TRPV1)和非辣椒素受体两种途径发挥抗肿瘤作用。Ma等[37]研究发现,辣椒素可阻滞细胞周期于S期,抑制Ishikawa细胞增殖和诱导凋亡,这与TRPV1依赖性的cleaved caspase-3的表达升高和Cdk2的表达降低相关。
2.4 萜类
2.4.1 单萜类
香叶醇能显著增加Ishikawa细胞中Bax、caspase-3、caspase-8、cyt C和Fas基因表达,而降低Bcl-2的表达。Bax和Bcl-2的免疫组化结果与PCR结果一致,证明香叶醇诱导EC细胞凋亡[38]。芍药苷作用于RL9-2细胞后,增加了p-p38 MAPK、p-ERK、p-JNK和p-p65的含量,用p38 MAPK抑制剂和NF-κB抑制剂干预后抑制了芍药苷的抗肿瘤作用;证明PAE通过激活p38 MAPK和NF-κB信号通路抑制RL9-2细胞增殖[39]。异紫堇碱可下调Bcl-2/Bax含量,通过线粒体途径诱导细胞凋亡;下调Cdk2和Cyclin E,阻滞细胞周期于G1期,下调MMP-2、MMP-9,抑制细胞转移。其分子机制与抑制PI3K/AKT/NF-κB通路活性有关[40]。
2.4.2 二萜类
An等[41]研究curcusone C对Ishikawa和HEC-1-A细胞的凋亡影响,结果表明,curcusone C通过线粒体途径诱导细胞凋亡,与cyt C释放、caspase-3和caspase-9活化、Bcl-xL/Bax失调及凋亡抑制蛋白(如XIAP和Survivin)的表达降低有关。土荆皮乙酸阻滞细胞周期于G2/M期,抑制细胞增殖,促进细胞凋亡;下调MMP-9和VEGF含量以及上调E-cadherin表达,抑制细胞的粘附、侵袭、迁移[42]。Ni等[43]通过体外和小鼠异种移植模型实验,发现雷公藤甲素能抑制HEC-1-B细胞生长,阻滞细胞周期于S期和G2/M期;下调Bcl-2和VEGF的表达,诱导肿瘤细胞凋亡和抑制肿瘤血管生成。雷公藤甲素阻滞细胞周期于S期和G2/M期,抑制细胞增殖;上调LC3-Ⅱ基因表达,增强细胞自噬[44]。冬凌草甲素可通过下调lncRNACCAT1表达水平,来发挥抑制癌细胞增殖、迁移和侵袭,促进子宫内膜癌HEC-1-B细胞凋亡的作用[45]。
2.5 三萜类
2.5.1 三萜类
Chen等[46]发现,竹节香附素作用于HEC-1-B细胞48 h后,JAK和STAT3基因表达量下降;推测竹节香附素通过抑制JAK/STAT3信号通路,抑制HEC-1-B细胞的侵袭和转移。齐墩果酸3-乙酸酯改变了线粒体膜电位,降低了细胞内ROS生成,通过激活多种促凋亡细胞因子PARP、Bcl-2、caspase-8、caspase-3和caspase-7,发挥线粒体途径的诱导HEC-1-A凋亡作用[47]。
2.5.2 三萜皂苷
桔梗皂苷D通过下调MMP-2和MMP-9蛋白的表达,上调Cleaved-Caspase3、P53蛋白表达,增加KLF4 mRNA与蛋白表达,抑制EC细胞的增殖,诱导其凋亡、侵袭和转移[48]。Wang[49]和Kim等[50]研究人参皂苷Rh2对HEC-1-A和Ishikawa细胞的作用时发现,细胞中PARP和Caspase-3水平均升高,E-cadherin的表达升高,EMT相关蛋白水平下降,揭示了其诱导凋亡和侵袭转移的分子机制。太白楤木皂苷通过下调sirtuin 1表达,抑制HEC-1-B细胞迁移、侵袭[51]。
2.6 醌类
2.6.1 蒽醌类
大黄素通过抑制ROS介导的耐药基因表达,增强顺铂对EC的化疗敏感性,发挥抑制增殖、生长和诱导凋亡作用[52]。
2.6.2 萘醌类
胡桃醌处理Ishikawa细胞后,引起细胞S期阻滞进而抑制细胞增殖,与p21水平升高,CDK2、cdc25A、CHK1和cyclin A水平下降有关;胡桃醌也可使ROS水平显著升高,Bcl-2和Bcl-xL表达显著下调,Bax、Bad和cyt C表达上调,证实线粒体途径参与了胡桃酮诱导的凋亡[53]。白花丹素可显著抑制细胞增殖,通过上调p53和p21的表达,白花丹素可阻断G2/M期细胞周期,下调细胞周期素依赖性激酶[54]。
miR-106b在多种癌症中均能发挥促癌作用,紫草素可通过下调miR-106b的表达,靶向促进抑癌基因PTEN的释放,进而负向调节PI3K/AKT/mTOR信号通路,抑制EC细胞增殖,促进其凋亡[55]。紫草素也可下调ERα、Cyclin D1、cMyc蛋白表达,推测其通过抑制雌激素通路起到抑制Ishikawa细胞增殖的作用[57]。紫草素亦能通过bcl-2、bax和caspase家族的调控发挥抗Ishikawa、HEC-1-B细胞凋亡作用[58,59]。
2.6.3 菲醌类
丹参酮I可抑制HEC-1-A细胞的增殖,引起细胞中ROS水平的升高,MMP水平的降低;其抗增殖诱凋亡的机制可能与调节JAK/STAT信号通路蛋白的表达有关[60]。丹参酮ⅡA可以引起Ishikawa细胞发生G2/M期阻滞,抑制其增殖,诱导其凋亡[61]。
2.7 苯丙素类
2.7.1 木脂素类
Dong等[62]将肉桂醛作用于Ishikawa细胞24h后,发现肉桂醛可上调p21的表达,下调CDK4、MMP2与MMP9的表达;证明肉桂醛可以抑制EC增殖与侵袭,促进其凋亡。
2.7.2 木脂内酯类
牛蒡子苷元能显著下调p65、p-IκBα蛋白表达,抑制HEC-1-B细胞增殖;其作用机制可能与抑制NF-κB信号通路活化有关[63]。
2.7.3 香豆素类
蛇床子素可通过上调miR-424来抑制Ishikawa和中KLE细胞中CPEB2的表达,从而抑制细胞增殖和诱导细胞凋亡[64]。
2.8 有机含硫化合物
Tang等[65]通过体内实验证明,大蒜素可通过抑制移植瘤组织PI3K/AKT通路信号转导,来抑制裸鼠移植瘤(HEC-1-B)生长。大蒜素可通过下调TLR4、MyD88 mRNA及蛋白的表达,抑制EC荷瘤小鼠肿瘤增长及促进细胞凋亡[66]。Jia等[67]利用Ishikawa细胞体外模型,发现大蒜素可诱导细胞周期阻滞和凋亡,提高顺铂化疗敏感性。
2.9 甾类
豆甾醇增强了EC细胞对顺铂的敏感性,其机制是降低Nrf2蛋白水平[68]。Zhang等[69]利用体外和体内实验,探究天冬氨酸A对Ishikawa细胞的抑制增殖、诱导凋亡机制,发现天冬氨酸A使细胞形态发生改变,细胞周期停滞在G0/G1期。此外,它还能通过线粒体途径诱导细胞凋亡,包括诱导ROS的产生,cyt C的上调,Δψm的降低,caspase的活化。此外,Zhang等[70]还运用miRNA-seq和mRNA-seq整合分析,采取qRT-PCR和Western blot检测手段,进一步证实天冬氨酸A可以通过RAS/ERK/MAPK途径抑制人EC细胞的迁移和侵袭。薯蓣皂苷通过上调p16、p21、p27,下调细胞周期蛋白(Cyclin A/D/E) 和细胞周期素依赖性激酶(Cdk 2/4/6),抑制细胞增殖。通过调节Bcl家族蛋白、增加ROS水平、激活caspase 9/3、降低线粒体膜通透性等途径促进细胞凋亡;此外,薯蓣皂苷也可激活与死亡受体介导的凋亡相关的标记基因和蛋白(Fas、TNF-R1和Caspase 8)发挥促凋亡作用[71]。
2.10 其他
苦杏仁苷可抑制细胞侵袭迁移;上调促凋亡蛋白Bax,下调抑制凋亡蛋白Bcl-2,促进细胞凋亡[72]。山竹醇是一种多聚异戊二烯基苯甲酮,可从印度藤黄的干果皮中提取出来,Zhang等[73]发现山竹醇以剂量依赖性的方式抑制Ishikawa和HEC-1B细胞的增殖,诱导细胞周期阻滞于G1期和G2/M期,降低S期和DNA合成。并通过westernblot的方法检测周期相关蛋白,推测其可能激活EC细胞的JNK/c-jun信号通路。灵芝是一种常见抗肿瘤植物[74],灵芝醇提物阻滞细胞周期于G1/S期,抑制细胞增殖;通过线粒体途径诱导细胞凋亡[75]。豨莶醇提物逆转上皮间充质转换(EMT),下调MMP-9、MMP-2,抑制细胞迁移和侵袭[76]。
3 结论与展望
EC是一种常见的妇科恶性肿瘤,常见发病机制与无孕激素拮抗的雌激素长期作用有关。随着人们生活和饮食习惯的改变,EC的发病率也在逐年上升,高效低毒的中药和天然产物在抗癌方面的研究逐渐成为热点。EC患者常见的中医病性证素以痰湿为主,其次为湿热、气虚、阴虚和血瘀[77]。临床实践表明,一些清热、补虚、化瘀、止血类中药对治疗EC有一定效果,且毒性较低。此外,大量体内外实验证实了中药、植物药及其天然活性成分可通过调控多条信号通路发挥对EC的干预效果,包括干扰细胞分裂周期、抑制雌激素,来抑制EC细胞增殖;抑制肿瘤微血管新生、上皮间质转化和细胞侵袭,提高细胞粘附能力,发挥抑制EC细胞转移作用;通过线粒体和死亡受体途径抑制细胞凋亡;增强或减弱细胞自噬等(见图1)。
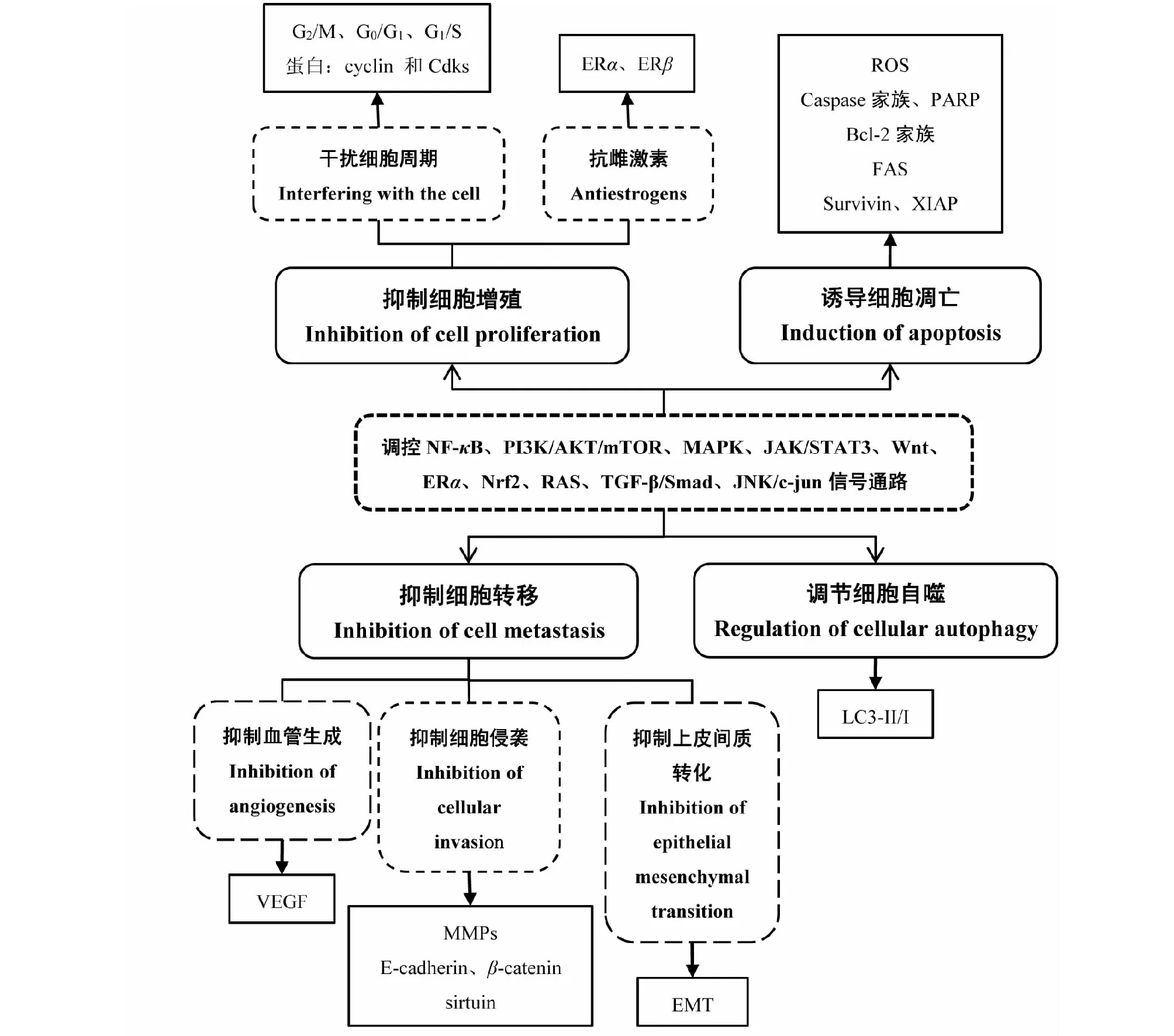
图1 中药及天然产物抗EC的作用及机制图Fig.1 Anti-endometrial cancer effects and mechanisms of Chinese medicine and natural products
现阶段,中药、天然产物抗EC作用机制的实验研究虽然较多,但还需要从以下方面深入研究:①部分研究只得出某中药、天然产物干预EC的效果,如能够抑制细胞增殖、转移,诱导细胞凋亡、自噬等,今后还需在已有研究基础上,从分子层面对其作用机制进行深入研究。②目前体内实验研究相对较少,应从体内或体内外结合两方面建立模型展开实验,提高临床研究参考价值。③有效干预EC的天然产物的来源主要集中在植物药,今后可以寻找如动物药、矿物药、海洋药物等其他天然产物,为药物研发及抗EC提供新方向。④同类天然产物的结构相似,应结合化学手段开展构效关系研究,力求明确其结构中的药效基团,为设计新衍生物、开发新药提供思路。⑤结合基因组学、转录组学、蛋白质组学和代谢组学等技术,运用多组学数据整合分析EC的发生、发展与治疗机制,寻找与EC相关的潜在生物标志物,探索新的治疗靶点。⑥通过结合中西医手段,把研究侧重点放在开发综合癌症疗法上,充分发挥中药的低毒高效优势,以减轻常规化疗药物的毒副作用。

