人源肠道菌中转化连翘苷制备连翘脂素的菌株筛选及固定化
郭雪健,李彬春,赵 邑,尉敬涛,张立伟
1山西大学分子科学研究所,化学生物学与分子工程教育部重点实验室;2山西省生物研究院;3山西大学生物技术研究所,太原 030006
连翘脂素,主要存在于中药连翘、桂花、小白菊及石榴籽中。近年来,人们发现连翘脂素具有多种药理活性,如抗炎活性[1]、抑制人肺癌细胞株增殖[2]、抑制胰腺癌细胞的增殖和迁移[3]、调节自发性高血压大鼠收缩压和舒张压[4]等。连翘脂素是连翘苷脱糖后的苷元(见图1),Quan[5]、Mao等[6]研究发现连翘脂素在抗炎及抗癌效果上优于连翘苷,此外,Ye等[7]发现连翘脂素的生物利用度较连翘苷高。目前,连翘脂素的制备方法主要有两种:直接从植物中提取和经由连翘苷转化获得。Wang等采用发酵连翘叶的方式制备获得连翘脂素[8]。Mei等[9]从土壤中筛选得到一株具有转化连翘苷生成连翘脂素的霉菌,还有使用纤维素酶或酸水解连翘苷制备连翘脂素[10]。但以上方法都存在一些缺陷,如酶的加入易造成乳化现象使产物难以分离制备;酸和霉菌可造成连翘脂素不稳定产生副产物。基于以上原因,目前还没有一种简单易行、完整可靠的转化方法,需进一步完善。

图1 连翘苷及连翘脂素结构式Fig.1 Molecular structures of phillyrin and phillygenin
有报道称连翘苷与人的肠道菌共孵育后会代谢产生连翘脂素。并且,连翘脂素可进一步代谢为小分子物质[11]。因此,本研究希望从人源肠道菌中筛选出可以高效转化连翘苷制备连翘脂素的菌,以弥补现有方法的不足,旨在为连翘脂素的进一步开发利用奠定基础。
1 材料和方法
1.1 仪器与试剂
GAM液体培养基、GAM固体培养基、革兰氏染色试剂盒(北京Solarbio生物科技有限公司);连翘苷(批号:MUST-18020210)、连翘脂素(批号:MUST-18072402)(成都曼思特生物科技有限公司);色谱甲醇(Fisher Scientific 上海公司)。
ACQUITY H-class UPLC(美国 Waters 公司);ionexUltiMate 3000超高效液相色谱及四级杆-静电场轨道阱高分辨质谱联用仪、Xcalibur工作站(美国Thermo Fisher Scientific公司);LAI-3T 厌氧培养箱(上海龙跃仪器设备有限公司);高压蒸汽灭菌锅(上海三申医疗器械有限公司)。
1.2 菌株筛选
1.2.1 肠道菌混悬液与培养基的制备
取健康成人的4 g中段粪便,立即溶于20 mL冰浴生理盐水中,搅拌均匀后经三层纱布过滤取上清,即为肠道菌混菌液[12]。
配置GAM液体培养基,灭菌后加入连翘苷至终浓度为0.5 mg/mL。药物空白的GAM培养基为同法配置,但不含连翘苷。
1.2.2 菌株初筛
菌株初筛的主要目的是确定混菌液中含有转化连翘苷的菌株,并利用连翘苷的抗菌作用缩小菌株筛选范围[13]。具体方法为:量取4 mL含底物的GAM液体培养基于5 mL离心管中,加入肠道菌混悬液1 mL,置于37 ℃厌氧培养箱中培养12 h后取出。吸取1 mL转化液加入4 mL甲醇,离心去除蛋白,将上清液减压蒸干后,用2 mL乙酸乙酯溶解提取三次,过滤,合并溶解液减压蒸干,然后用1 mL甲醇复溶,过0.22 μm滤膜、UPLC分析。同时做菌液空白及底物空白,各样平行3份。
1.2.3 菌株复筛及纯化
取“1.2.2”中转化液,配制浓度为10-1、10-2、10-3、10-4、10-5、10-6、10-7的菌液。取100 μL涂布平板,于37 ℃下厌氧培养后挑取平板中形态及颜色不同的单菌落,于试管中划线培养再纯化,至同一试管中长出的菌落形态及颜色均相同,获得纯化的单克隆菌株。取9 mL GAM液体培养基于10 mL带盖EP管中,将单菌株扩增培养至OD600值为0.7~0.8。
1.2.4 转化模型的建立
主要采用Guo等[14]建立的人肠内菌体外转化模型,并略有修改。取4 mL含底物的GAM液体培养基于5 mL带盖EP管中,加入1 mL扩增的菌液,平行制备11份培养。分别于0、1、3、5、7、9、11、13、15、25、35 h取出一管。吸取1 mL加入2 mL甲醇中淬灭,并离心去除蛋白后按“1.2.2”中方法溶解转化产物分析。单菌株保存于终浓度为20%甘油中,置于-80 ℃冰箱保存。
UPLC色谱分析条件:使用Waters ACQUITY H-class型超高效液相色谱仪(UPLC),ACQUITY-UPLC-BEH C18色谱柱(1.7 μm,2.1×100 mm)。流动相为乙腈(A)-0.2%甲酸水溶液(B)。梯度洗脱(0~4 min:10%→23%A;4~9.5 min:23%→23%A;9.5~11 min:23%→30%A;11~15 min:30%→40%A;15~17 min:40%→10%A;17~18 min:10%A)。流速0.3 mL/min,检测波长280 nm,柱温40 ℃,进样量2 μL。
标准曲线的绘制:以甲醇为溶剂配制浓度分别为0.01、0.1、0.2、0.4、0.6、0.8、1 mg/mL的连翘苷对照品溶液,进行UPLC分析,绘制标准曲线。同法绘制连翘脂素对照品溶液标准曲线。
1.2.5 转化模型的方法学验证
1.2.5.1 精密度考察
日内精密度为在同一天内将连翘苷和连翘脂素对照品溶液各浓度的样品连续测定6次。根据标准曲线计算浓度和连续6次进样的相对标准偏差(RSD)和准确度(RE)[14]。日间精密度为将各浓度的同一样品连续进样3天,每天进样2次。
1.2.5.2 基质效应和回收率试验
按“1.2.2”中方法除去GAM培养基中的蛋白,再用其分别配制不同浓度的连翘苷和连翘脂素溶液,每个浓度平行6份,得到样品A。然后,用甲醇代替除去蛋白的GAM培养基,同法配制,得到样品B[14]。另用GAM培养基配制连翘苷和连翘脂素溶液,除去蛋白得到同样浓度的样品C。分别分析A、B和C,计算连翘苷和连翘脂素的浓度[14],按照A/B×100%和C/A×100%计算基质效应和回收率。
1.2.5.3 重复性考察
用GAM培养基配制3个不同浓度的连翘苷和连翘脂素溶液,每个浓度6份,除去蛋白得供试品溶液[14]。
1.2.6 液质联用对产物鉴定
采用超高效液相色谱-质谱联用(UPLC-MS)的方法,将连翘苷的转化产物与标准品比对保留时间、一级碎片和二级碎片来鉴定产物。
质谱参数为:离子源以电喷雾离子源(ESI)离子化方式;扫描模式:full scan/dd-MS2,正负离子切换并同时采集模式;正离子模式喷雾电压为3.5 kV,负离子为2.5 kV;质核比采集范围100~1000;毛细管温度320 ℃;鞘气体积流量35 arb,辅助气体积流量10 arb;加热器温度300 ℃;碰撞量设定为12.5、25和37.5 eV;分辨率设定为MS full scan 35000 FWHM以及MS/MS 17500 FWHM[15]。
1.2.7 菌株鉴定
观察包括液体培养与平板培养后的菌株,并用革兰氏染色法染色后进行显微观察。
16S rDNA测序分析:本部分16S rDNA测序工作交由华大基因科技有限公司武汉分公司完成。利用Premier 5.0软件设计细菌的扩增引物得27f:AGAGTTTGATCMTGGCTCAG,1492R:TACGGYTACCTTGTTACGACTT。然后提取目的基因后扩增,通过琼脂糖凝胶电泳检测纯度,上机测序。将所得序列提交NCBI网站在线Blast分析序列的同源性,并与数据库中的序列进行比对分析,利用MEGA 5.1软件构建16S rDNA序列系统发育树。
1.2.8 菌株转化的氧气条件考察
大肠杆菌SXUXJ-1为革兰氏阴性兼性厌氧菌,为了提高后续实验操作的简便性,需要对其转化条件的需氧性进行探究。在“1.2.4”的基础上只改变厌氧培养为普通培养箱中培养,其余条件均不改变,同时做厌氧培养对照。
1.3 菌株的固定化
1.3.1 固定化菌球的制备
取9 mL不同浓度的海藻酸钠溶液,加入菌液1 mL(平板菌落计数法[16]测得活菌数为3×1011~4×1011CFU/mL),搅拌均匀后使用1 mL的注射器吸取溶液,在距离氯化钙溶液液面垂直距离为10~15 cm处,将海藻酸钠溶液匀速滴入氯化钙溶液中,边滴入边匀速摇动。静置交联后滤出菌球,用灭菌的生理盐水冲洗菌球3遍后备用。然后进行单因素条件探究,分别考察海藻酸钠浓度、氯化钙溶液浓度、交联时间对菌球比活力的影响。最后,通过正交实验优化制备条件。
1.3.2 固定化菌球的酶活检测
对硝基苯酚(p-nitrophenol,pNP)标准曲线绘制:配制浓度分别为30.3、60.6、121.2、151.5、242.4、303、484.8、606 μmol/L的pNP溶液。吸取100 μL的pNP溶液加入100 μL的Na2CO3溶液混合均匀,然后取100 μL于96孔板中,用酶标仪在400 nm处测吸光度,以pNP浓度(μmol/L)为横坐标,以OD400为纵坐标绘制标准曲线。
固定化菌球酶比活力的检测参照文献[17]稍作修改:取5 g菌球放入5 mmol/L的pNPG(对硝基苯基-β-D-吡喃葡萄糖苷)溶液中,于37 ℃下诱导产酶1 h后滤出固定化的菌球,冲洗3遍。然后将菌球放入10 mL浓度为5 mmol/L的pNPG溶液中,置于37 ℃的摇床中以150 rpm反应1 h。取初加入菌球时(空白)和反应结束时的pNPG溶液各100 μL分别测吸光度,每组3平行。β-葡萄糖苷酶酶比活力计算公式如下:
公式中,比活力的单位为U/g;ΔC:pNP摩尔浓度差(mmol/L);V:pNPG溶液体积(mL);t:反应时间(h);m:菌球质量(g)。
固定化菌球酶活大小以β-葡萄糖苷酶酶活力大小评价,一个酶活单位(U)定义为:在上述反应条件下,每小时释放1 μmol的pNP所需要的固定化菌球量。
1.3.3 固定化菌球转化连翘苷研究
配置10 mL的连翘苷生理盐水溶液,调整pH值后超声15 min。取5 g菌球放入溶液中,在不同温度的恒温振荡箱中以150 rpm转化20 h后取出。向体系中加入30 mL甲醇终止反应,并超声提取15 min。按“1.2.2”中方法溶解产物并计算连翘苷的转化率,平行重复3次。分别考察pH值、温度和底物浓度的对转化率的影响。
菌球的耐用性考察:根据单因素确定的最优转化条件将同一批菌球连续使用14天,每天使用一次,观察连翘苷转化率的变化。
2 结果与讨论
2.1 连翘苷、连翘脂素标准曲线
连翘苷标准曲线符合线性回归方程y=4 156 129x+36 654,相关系数R2为0.999 2,线性范围为0.01~1 mg/mL;连翘脂素标准曲线符合线性回归方程y=6 163 326x+83 565,相关系数R2=0.999 0,线性范围为0.01~1 mg/mL。式中y为峰面积,x为标准品浓度(mg/mL)。
2.2 方法学验证结果
如表1所示,连翘苷和连翘脂素的RSD和RE均符合要求,该方法的日内、日间精密度和准确度良好。如表2所示,连翘苷和连翘脂素的基质效应和回收率的误差都在±5%以内,并且重复性的RSD在2%以内,表明模型可靠可以用于后续转化研究。

表1 精密度、准确度考察结果(n=6)

表2 基质效应、回收率和重复性考察结果
2.3 菌株筛选结果
筛选纯化后获得了一株具有较强的连翘苷转化能力的单菌株,命名为SXUXJ-1。图2为该菌株的平板生长图。
图2 菌株SXUXJ-1在平板上生长图Fig.2 The growth of strain SXUXJ-1 on the plate
图3反应了菌体在培养开始后5 h进入对数生长期,同时开始转化连翘苷;15 h后进入稳定期,此时连翘苷已基本转化完全。反应持续20 h后,产物连翘脂素的量基本保持不变。

图3 菌株(SXUXJ-1)生长曲线及转化连翘苷的时效曲线Fig.3 The growth curve and the time-activity curve of transforming phillyrin of strain (SXUXJ-1)
从图4中可以看出,连翘苷转化产物的液相保留时间与连翘脂素对照品一致。
2.4 产物UPLC-MS分析结果
在正离子模式下,比较产物与标品相对丰度最高(依次为355.15、373.16、390.19、189.09、395.15)的五个分子离子峰保持一致。推测其中质核比为355.15的碎片为连翘脂素中性损失水而产生。比较其二级质谱图,相对丰度最高的五个碎片分别为337.14、355.15、284.10、137.06、286.11。以上五个碎片在产物与标准品中均保持一致。
结合图4中样品与标准品液相色谱保留时间的一致性,及连翘脂素的理论生成量与实际生成量无明显差别,可以判断产物为连翘脂素。并且在转化体系中,连翘脂素生成后可以在20 h内保持稳定,无副产物生成。

图4 菌株SXUXJ-1转化连翘苷液相色谱图Fig.4 Liquid chromatographic image of phillyrin transformed by strain SXUXJ-1注:A为菌液空白组;B为实验组12 h;C实验组转化结束;D为混标。Note:A:Bacterial liquid blank group;B:Experimental group 12 h;C:The end of transformation of experimental group;D:Mixed stand-ard solution.
2.5 菌株的鉴定结果
如图5所示,经革兰氏染色后在显微镜下可观察到菌株SXUXJ-1呈短杆状,两端圆头。图2所示平板上菌落为圆或近圆,边缘整齐表面光滑,颜色为乳白色,培养24 h后菌落大小为2 mm,在有氧或无氧状态均可生长。菌株在液体培养基中培养24 h后培养基变浑浊,产生气泡及沉淀。革兰氏染色结果为阴性。

图5 菌体显微形态Fig.5 Micromorphology of the strain
16S rDNA测序结果经拼接,得到菌株SXUXJ-1的16S rDNA序列,长度为1 409 bp,序列如下:

将测序所得序列与NCBI Genbank数据库进行blast同源序列分析。通过绘制菌株系统进化树(图6)发现,菌株SXUXJ-1与埃希氏属大肠杆菌(Escherichiacoli)的多个菌株具有较高的同源性,与登录号为CCFM8336及KVP104的大肠杆菌菌株具有99.86%的相似度,序列比对覆盖率达100%。参考《伯杰氏细菌手册》第八版相关内容及测序结果,综合该菌株的形态特征及革兰氏染色结果,可以确定菌株SXUXJ-1为肠杆菌科埃希氏属大肠杆菌,已保存于中国普通微生物菌种保藏管理中心,保藏编号:CGMCC No:21514。

图6 菌株SXUXJ-1 16S rDNA序列系统发育树Fig.6 Phylogenetic tree of SXUXJ-1 based on 16S rDNA
2.6 有氧与厌氧培养对比
有氧及厌氧培养条件下连翘脂素的最终得率分别为96.9%和96.0%。结合表3,可以看出是否提供厌氧培养条件对连翘苷转化率与连翘脂素转化得率无明显影响。在后续转化中无需提供严格厌氧条件,这样可以减少成本及降低操作复杂性。

表3 有氧及厌氧培养对比
2.7 菌株的固定化条件
对硝基苯酚标准曲线符合线性回归方程y=0.002 075x+0.050 51,相关系数R2=0.998 7,线性范围0~606 μmol/L,式中y为吸光度,x为对硝基苯酚浓度。
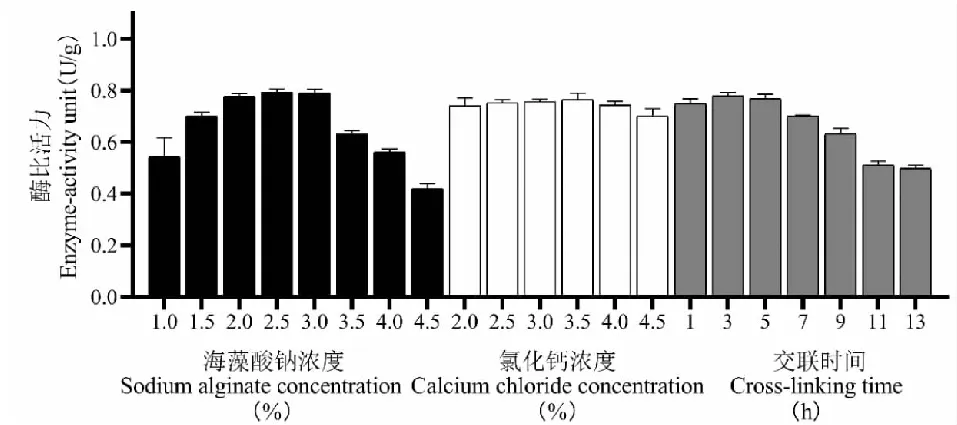
图7 单因素考察结果Fig.7 Results of single factor investigation
根据图7单因素结果确定的最佳条件为海藻酸钠浓度2.5%、CaCl2浓度3.5%、交联时间3 h。则正交实验因素水平设置为:A海藻酸钠浓度2、2.5、3%;B氯化钙浓度3、3.5、4%;C交联时间1、3、5 h。
通过极差分析可知(见表4),3个因素对酶活影响的大小顺序为:A>C>B,即海藻酸钠浓度>交联时间>氯化钙浓度。

表4 正交实验结果
正交分析的效应曲线给出固定化菌球工艺条件为海藻酸钠浓度为3%,氯化钙浓度为3.5%,交联时间3 h,以此工艺条件制作的凝胶球如图8所示,胶球大小适中,机械强度较好。
图8 海藻酸钠凝胶球Fig.8 Sodium alginate hydrogel beads
根据最优条件重复三次验证得到酶活平均为0.836 U,标准差(SD)为0.013 3,相对标准偏差(RSD)为1.6%。
在pH值条件考察中,pH值为8时连翘苷的转化率达到最大82.5%,说明此时菌体活力旺盛,转化效率最高,因此确定pH值8为最适条件。
当底物浓度逐渐增大时,由于连翘苷具有一定的抗菌作用,浓度过大必然会在一定程度上影响微生物生存,同时也会超过菌的催化能力,则转化效率较低,经济性不高;而如果底物浓度过小时,又不利于充分发挥菌球效力。因此,菌球与底物浓度之间存在一个最佳比例。从图9中可以看出,当底物浓度从0.2~0.8 mg/mL逐步增大时,连翘苷的转化率下降缓慢。这可能是由于菌球提供的酶量较为充足,底物可以与酶充分接触。而当底物浓度高于0.8 mg/mL后,连翘苷的转化率急剧下降,这可能是因为底物量超过了体系中酶的最大催化能力,而使连翘苷的转化率下降。因此综合考虑转化率以及经济性,选择底物浓度为0.8 mg/mL。
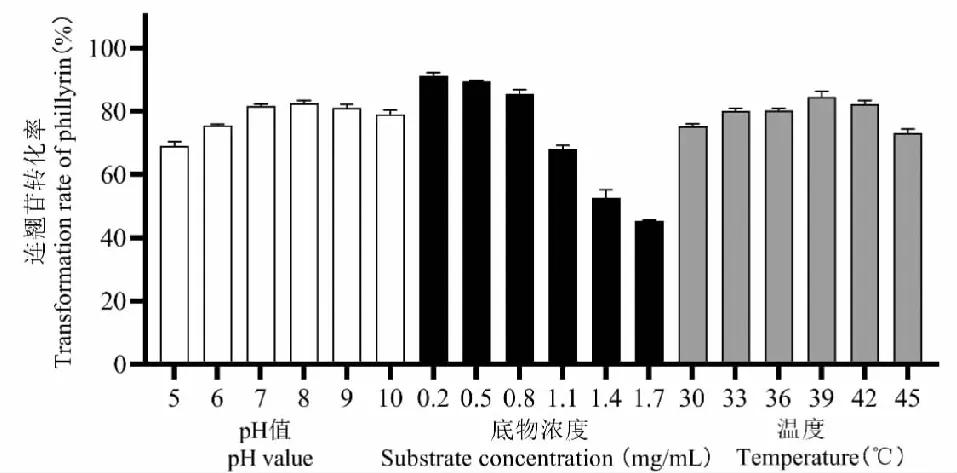
图9 单因素条件转化条件考察Fig.9 Investigation on single-factor condition transformation process
2.8 转化条件考察结果
肠杆菌科的细菌一般最适温度在33~42 ℃,因此本研究选择考察范围为30~45 ℃。如图9所示,当温度为39 ℃时,连翘苷转化率最大,即选择39 ℃为最优转化温度。
综上,确定固定化菌球转化连翘苷的条件为pH值为8,底物浓度为0.8 mg/mL,温度为39 ℃。在此条件下重复三次,得到连翘苷在20 h内的转化率分别为84.3%、85.7%、85.6%,平均转化率达到85.2%,将转化时间延长至25 h左右,连翘苷即可实现完全转化;计算连翘脂素的最终得率分别为96.8%、97.2%、96.9%,平均得率为97.0%。
2.9 菌球的耐用性
图10所示固定化菌球连续循环使用13次后,连翘苷在20 h内的转化率仍能达到70.2%。说明在此工艺条件下,微生物经固定化后可以维持其生命活力,连续产生酶,菌球具有良好的耐用性。

图10 菌球的耐用性Fig.10 Durability of the bacteria ball
3 讨论与结论
首先在筛菌研究中,由于连翘苷具有一定的抗菌作用,我们在初筛所用的液体培养基及复筛所用的平板培养基中均加入一定量的连翘苷,可以抑制与连翘苷不友好的菌株生长,为筛选缩小了一定的范围。其次,已有研究表明,连翘苷在肠道菌的作用下转化为连翘脂素后会继续代谢产生副产物[11]。本研究筛选得到的单菌株在转化连翘苷得到连翘脂素后,产物可在20 h内保持稳定,未发生继续代谢,无副产物的生成。本方法克服了已有微生物转化法中连翘脂素继续被代谢的缺点,也未引入多余基团。再次,大肠杆菌是一种革兰氏阴性兼性厌氧菌,由于其良好的生长活力及可有效利用廉价碳源,在基因工程中被改造为工程菌。其兼性厌氧的特点对于发酵工程上具有重要的意义,本研究筛选到的大肠杆菌同时具备以上特性。最后,我们还使用固定化微生物的方法将菌株SXUXJ-1固定,通过优化制作工艺最终制得了一种实用性较强的菌球。在最优转化条件下,连翘苷可在25 h左右转化完全。固定化菌球转化法是一种简单、高效、环保的方法,且转化后的产物连翘脂素易于提取分离,因此具备非常好的应用前景。

