胀果甘草多糖GiP-B1通过TLR4/MyD88/NF-κB信号通路激活巨噬细胞RAW 264.7
丛媛媛,依明·尕哈甫,陈春丽,娜迪热木·肖克拉提,俞永婷
新疆医科大学药学院,乌鲁木齐 830011
天然免疫系统是机体抵抗病原体入侵的重要防线,而Toll样受体(toll-like receptors,TLRs)以及表达TLRs的巨噬细胞、树突状细胞等抗原提呈细胞是天然免疫系统的重要组成部分[1,2]。有关TLRs参与巨噬细胞免疫识别、调控信号转导、启动免疫应答反应的研究表明,TLRs家族中除了TLR3外的其他成员,都可以通过识别脂多糖(lipopolysacchride,LPS)等配体,结合髓样分化因子88(mycloid differentiation factor 88,MyD88),招募相关激酶并激活核因子-κB(nuclear factor-kappa B,NF-κB)抑制物的激酶(inhibitor of NF-κB kinases,IKK),使结合NF-κB的NF-κB抑制蛋白(inhibitor of NF-κB,IκB)发生磷酸化并解离,活化NF-κB进入细胞核,启动或抑制靶基因的转录,进而调控天然免疫应答反应[3-5]。
多糖作为一类有效的生物应答调节剂,激活巨噬细胞免疫应答的机制也与TLRs/NF-κB信号通路转导有关。研究发现,许多植物多糖可与巨噬细胞表面的TLR2/4等受体特异性结合,激活NF-κB信号通路,调控细胞因子的转录和吞噬细胞中共刺激分子的表达,并启动下级级联,激活先天性免疫与获得性免疫[6-9]。
胀果甘草(GlycyrrhizainflataBat.)是新疆特色药用植物资源,其干燥根及根茎作为药材甘草已被《中国药典》收录,其粗多糖GiP及其纯化组分已被本课题组证实具有促进巨噬细胞和淋巴细胞增殖作用[10-12],其中含量较高的纯化组分GiP-B1是一个具有聚Rha-GalA主链的酸性多糖,相对分子量大于2.0×106Da,糖醛酸含量为16.8%,可显著促进巨噬细胞RAW 264.7的增殖和吞噬作用,提高巨噬细胞的IL-1β和TNF-α分泌量,促进NO和NOS的生成。课题组进而采用单克隆抗体anti-TLR4干预巨噬细胞后发现,GiP-B1诱导的TNF-α、IL-1β、1L-6和NO的分泌,以及iNOS、1L-1β、TNF-α、1L-6 mRNA表达,都出现不同程度的抑制,提示GiP-B1激活巨噬细胞可能与TLR4及其相关信号通路有关。为了深入研究胀果甘草多糖GiP-B1激活巨噬细胞与TLR4/NF-κB信号通路有关,本文在体外利用TLR4干扰RNA(TLR4-siRNA)转染巨噬细胞RAW 264.7,探讨GiP-B1干预后是否可通过TLR4介导的NF-κB信号通路激活巨噬细胞,以期阐明GiP-B1激活巨噬细胞的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞株
RAW 264.7小鼠巨噬细胞株购自中科院上海细胞生物所,培养条件为DMEM(高糖)培养基+10% FBS+1%双抗(青霉素+链霉素),37 ℃,5% CO2,饱和湿度。
1.1.2 胀果甘草多糖GiP-B1
实验室自制,用DMEM完全培养液配成20 mg/mL样品母液,0.22 μm无菌滤器过滤,放于4 ℃备用。
1.1.3 试剂
胎牛血清(FBS,批号:16000044)、DMEM培养基(批号:C11965500BT)、胰酶(0.25% Trypsin-EDTA,批号:25200-056)购自美国GIBCO公司;CCK-8试剂盒(批号:FC101-03)、Trans2K DNA Marker(批号:BM101)、TransZol Up(批号:ET111)、TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(批号:AT311)购自北京全式金生物,QuantiNava SYBR Green PCR试剂盒(批号:208054)购自德国QIAGEN公司;lipofectamine RNAiMAX(批号:13778-150)、Block-iT Alexa Fluor Red(批号:14750-100)、TLR4 siRNA(批号:MSS211922,MSS211923,MSS211924)、Negative Control(批号:452000)购自美国Life Technologies公司;Anti-IκBα(批号:ab32518)、Anti-NF-κB p65单克隆抗体(批号:ab32536)购自英国Abcam公司;MyD88(批号:4283)、Phospho-IκBα(批号:2859)、Phospho-NF-κB p65(批号:3033)、TLR4兔单克隆抗体(批号:14358)购自美国CST公司。
1.1.4 仪器
Smart Cell HF-90 CO2细胞培养箱(上海力康仪器有限公司);Eclipse TS100-F荧光倒置显微镜(日本尼康公司);xMarkTM酶标仪(美国Bio-Rad公司);K5500核酸蛋白定量仪(北京凯奥公司);2500凝胶成像系统(上海天能公司);MyCycler Thermal Cycler PCR仪(美国Bio-Rad公司);QuantStudioTM6 Flex Real Time PCR仪(美国ABI公司)。
1.2 方法
1.2.1 不同浓度GiP-B1对RAW 264.7细胞活力的影响
取生长状态良好汇合率达90%的细胞,完全培养基制备成2×105个/mL单细胞悬液,接种至96孔板中,37 ℃、5% CO2培养24 h;加入100 μL不同浓度(0、25、50、100、200、400、800 μg/mL)的GiP-B1溶液,每组5个复孔。37 ℃、5% CO2培养24 h后,每孔加入10%的CCK8溶液,继续培养2 h;用酶标仪测定450 nm处的OD值。
1.2.2 siRNA转染条件确定和TLR4-siRNA的筛选
取9 μL lipofectamin RNAiMAX试剂,分别与1.5 μL不同浓度Block-iT Alexa Fluor Red试剂(0.01、0.1 μmol/L)混匀,室温孵育5 min,静置20 min。将细胞接种至24孔板培养孔中,使转染时细胞密度达70%,在每孔细胞中加入100 μL转染液,37 ℃培养24 h和48 h后,于倒置荧光显微镜下观察荧光情况,根据红色荧光数确定转染效率较好的转染条件。
4) 母舰减速制动不影响其所拖曳的多分枝线列阵的线阵声学段的安全保障性能及工作稳定性,但若减速度过大或减速冲时过少,会导致阵列自身的摆动加剧从而使得分支阵列难以保持平衡,无法精确预报拖曳线列阵声纳的位置和构型姿态,出现阵型畸变后探测性能下降、甚至无法工作的状态。
3条TLR4 siRNA和Negative Control siRNA(与人类基因无同源性)的序列见表1。用无血清培养基稀释各siRNA至浓度50 nmol/L,取7.5 μL与45 μL lipofectamin RNAiMAX试剂混匀,室温孵育5 min,静置20 min。将细胞接种至24孔板培养孔中,使转染时细胞密度达70%,在每孔细胞中加入100 μL转染液,37 ℃培养,用RT-PCR法分别检测细胞各TLR4 siRNA表达量,筛选出干扰效率最高的siRNA进行后续实验[13-16]。
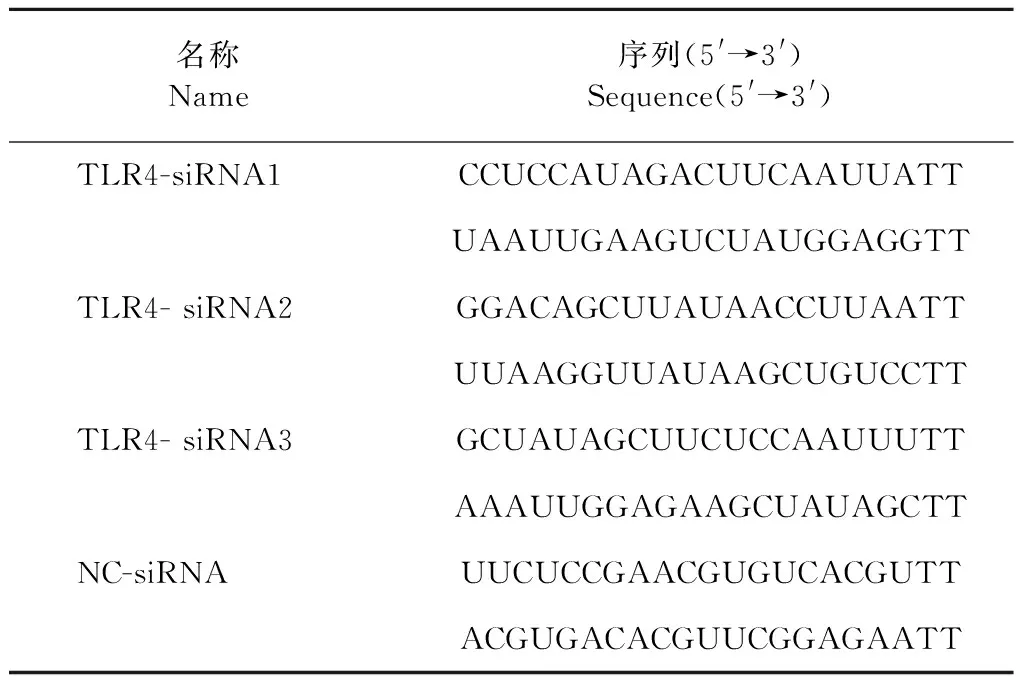
表1 TLR4-siRNA序列
1.2.3 实验分组
将生长状态良好的RAW 264.7细胞接种至培养瓶中,贴壁生长24 h后使其汇合率达70%,分为空白对照组(不转染,blank control)、阴性对照组(RAW 264.7细胞与人类基因无同源性的siRNA转染,negative control,NC)、TLR4小干扰RNA转染组(TLR4-siRNA组,si)、100 μg/mL GiP-B1组(样品组)、100 μg/mL GiP-B1+TLR4-siRNA组(样品+si组)。
1.2.4 TLR4-siRNA转染后GiP-B1对RAW 264.7细胞增殖的影响
按“1.2.2”项下方法培养细胞24 h后,分组给药:100 μL用完全培养基配制的Negative Control(与人类基因无同源性的siRNA)溶液、TLR4-siRNA溶液、100 μg/mL GiP-B1溶液,100 μg/mL GiP-B1+TLR4-siRNA溶液以及空白对照组,每组5个复孔,转染24 h;放入培养箱中培养2 h后,每孔加入培养基总体积10%的CCK-8溶液,继续培养2 h,用酶标仪测定450 nm处的OD值。
1.2.5 TLR4-siRNA转染后GiP-B1对RAW 264.7细胞炎症因子产生的影响
按“1.2.2”项下方法培养细胞24 h后,分组给药:500 μL用完全培养基配制的Negative Control溶液、TLR4-siRNA溶液、GiP-B1溶液,GiP-B1+TLR4-siRNA溶液以及空白对照组,每组5个复孔,转染24 h;分别吸取各组培养上清液ELISA法进行检测。
1.2.6 TLR4-siRNA转染后GiP-B1对RAW 264.7细胞NF-κB信号通路相关基因表达的影响
按“1.2.2”项下方法培养细胞24 h后,分组给药,每组5个复孔,转染24 h后,弃上清液,按Trizol试剂说明书方法提取各组细胞总RNA,按TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix说明书方法逆转录成cDNA。荧光定量PCR检测按QuantiNava SYBR Green PCR Kit说明书进行。反应条件:94 ℃预变性30 s,95 ℃、60 ℃、72 ℃ 30 s,72 ℃延伸7 min,40个循环。引物序列见表2。

表2 引物序列表
1.2.7 TLR4-siRNA沉默TLR4基因后,胀果甘草多糖对巨噬细胞NF-κB信号通路相关蛋白表达的影响
按“1.2.2”项下方法培养细胞24 h后,分组给药,每组5个复孔,转染24 h后,弃上清液,加入1 mL胰酶消化细胞,参照文献提取细胞总蛋白和线粒体蛋白,用BCA法测定蛋白浓度。每个样本上样总量为50 μg,蛋白质预染Marker上样量为9 μL,用10% SDS-PAGE凝胶电泳分离,转至PVDF膜。用5%脱脂奶粉溶液(Tert)室温振摇封闭1 h,然后加入TLR4一抗(1∶1 000)、MyD88一抗(1∶1 000)、NF-κB p65一抗(1∶500)、P-NF-κB p65一抗(1∶500)、IκB一抗(1∶500)、P-IκBα一抗(1∶500)、β-actin一抗(1∶2 500),4 ℃孵育过夜。TBST洗膜后加入相应二抗(1∶10 000),室温孵育1 h,TBST洗膜10 min×3次。加入化学发光试剂,经显影、定影后,ChemiScope mini化学发光仪检测、拍照。
1.2.8 统计学分析
2 结果
2.1 不同浓度胀果甘草多糖(GiP-B1)对RAW 264.7细胞活力的作用
由图1可知,GiP-B1干预细胞24 h后,50~200 μg/mL组的OD值都明显高于对照组(P<0.05),其中100 μg/mL组的OD值最高,表明该浓度范围内GiP-B1无细胞毒性,可促进巨噬细胞增殖;随着浓度增加,各组的OD值反而降低。因此后续实验GiP-B1干预浓度选择100 μg/mL。
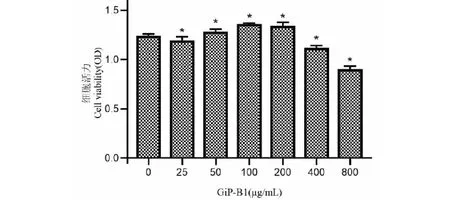
图1 不同浓度GiP-B1对RAW 264.7细胞株干预24 h后的结果Fig.1 Results of different concentrations of GiP-B1 on RAW 264.7 cell line after 24 h of intervention 注:与空白对照组比较,*P<0.05。Note:Compared with the blank control group,*P<0.05.
2.2 siRNA转染条件确定和TLR4-siRNA的筛选
不同浓度siRNA转染RAW 264.7细胞不同时间的荧光照片(见图2)显示,只有转染成功的细胞才能在荧光显微镜下看到Block-iT Alexa Fluor指示剂的红色荧光,当0.01 μmol/L siRNA转染细胞24 h时,红色荧光亮度及具有荧光细胞数较多,转染效率较好,故选择siRNA浓度为0.01 μmol/L,转染时间24 h为正式实验的转染条件,用于以下目的基因的转染实验。

图2 RAW 264.7细胞转染荧光图片(×100)Fig.2 Fluorescence image of RAW 264.7 cell transfection (×100)注:A:0.01 μmol/L;B:0.1 μmol/L
3对TLR4-siRNA转染RAW 264.7细胞24 h后,TLR4 mRNA表达水平由RT-PCR法检测,结果显示(见图3),3组TLR4-siRNA都能有效沉默相应mRNA的表达(P<0.05),其中TLR4-siRNA1组与空白对照组相比,TLR4的mRNA表达水平下调了68.4%,沉默效果最为明显,因此后续实验选用TLR4-siRNA1进行转染。

图3 不同TLR4-siRNA转染细胞后TLR4的mRNA相对表达量Fig.3 Relative expression of TLR4 mRNA in cells transfected 注:与空白对照组相比,*P<0.05;与阴性对照组相比,#P<0.05。Note:Compared with the blank control group, *P<0.05;Compared with the negative control group,#P<0.05.
2.3 TLR4-siRNA沉默后GiP-B1对RAW 264.7巨噬细胞增殖的影响
选择沉默效率最高的TLR4-siRNA1转染24 h后,CCK-8法检测GiP-B1对巨噬细胞增殖中的作用。结果显示(见图4),与空白组相比,TLR4-siRNA组巨噬细胞增殖率显著降低(P<0.05),说明TLR4-siRNA干扰模型成立;100 μg/mL GiP-B1组巨噬细胞增殖率显著提高(P<0.05);GiP-B1+ TLR4-siRNA组巨噬细胞的增殖作用则受到抑制,与GiP-B1组差异显著(P<0.01),提示GiP-B1可通过TLR4促进巨噬细胞的增殖。

图4 TLR4沉默后GiP-B1对RAW 264.7细胞增殖活性的影响Fig.4 Effect of GiP-B1 on the proliferative activity of RAW 264.7 cells after TLR4 = 5)注:与空白对照组比较,*P<0.05;与GiP-B1组比较,##P<0.01。Note:Compared with the blank control group,*P<0.05;Compared with GiP-B1 group,##P<0.01.
2.4 TLR4-siRNA沉默后GiP-B1对巨噬细胞RAW 264.7分泌炎症因子的影响
TLR4-siRNA1转染24 h后,ELISA法检测GiP-B1影响巨噬细胞分泌炎症因子的结果显示(见图5),与空白组相比,100 μg/mL的GiP-B1则可促进巨噬细胞分泌IL-1β、IL-6及TNF-α,差异均具有统计学意义(P<0.05);GiP-B1+TLR4-siRNA1组巨噬细胞分泌IL-1β、IL-6及TNF-α的含量均相应减少,与GiP-B1组差异均显著(P<0.05),提示GiP-B1可通过TLR4促进巨噬细胞分泌IL-1β、IL-6及TNF-α。

图5 TLR4沉默后GiP-B1对巨噬细胞RAW 264.7分泌 IL-1β、IL-6及TNF-α的影响Fig.5 Effects of GiP-B1 on the secretion of IL-1β,IL-6 and TNF-α in macrophage RAW 264.7 cells 注:与空白对照组比较,*P<0.05;与GiP-B1组比较,##P<0.01。Note:Compared with the blank control group,*P<0.05;Compared with GiP-B1 group,##P<0.01.
2.5 TLR4-siRNA干扰下GiP-B1对巨噬细胞NF-κB信号通路相关基因表达的影响
RT-PCR检测结果见图6,与空白组相比,GiP-B1干预组的TLR4 mRNA表达显著上调,表达量增加93.2%,该组经TLR4-siRNA1转染24 h后,TLR4的mRNA显著下调,表达量降低44.2%,与未转染组相比表达量降低71.1%,差异具有统计学意义(P<0.01);在GiP-B1的干预下,MyD88、P65、IκBα的mRNA水平明显上调,在TLR4-siRNA1转染后则都显著下调,表达量分别降低44.2%、54.6%、50.89%,与未转染组差异均极显著(P<0.01)。该结果表明,干扰TLR4基因表达后,TLR4/NF-κB信号通路的表达被干扰,100 μg/mL GiP-B1诱导的巨噬细胞TLR4/NF-κB信号通路下游基因MyD88、p65、IκBα的mRNA表达量被显著抑制,说明TLR4/NF-κB信号通路与GiP-B1激活巨噬细胞有关。

图6 TLR4沉默后GiP-B1对RAW 264.7细胞mRNA相对表达量的影响Fig.6 Effect of GiP-B1 on the relative expression of mRNA in RAW 264.7 cells after TLR4 =5)注:与空白对照组相比,**P<0.01;与GiP-B1组相比,##P<0.01。Note:Compared with the blank control group,**P<0.01;Compared with GiP-B1 group,##P<0.01.
2.6 TLR4-siRNA干扰下GiP-B1对巨噬细胞NF-κB信号通路相关蛋白表达的影响
Western blot检测结果见图7,与空白组相比,GiP-B1干预组的TLR4、MyD88蛋白表达显著上调,表达量分别增加55.9%和43.2%,该组经TLR4-siRNA1转染24 h后,TLR4、MyD88的蛋白则显著下调,与未转染组相比表达量分别降低33.9%和30.9%,差异具有统计学意义(P<0.05);在GiP-B1的干预下,IκBα、NF-κB p65的蛋白表达水平几乎没有改变,但p-p65、p-IκBα的蛋白表达水平明显上调(P<0.05);而当TLR4-siRNA1转染后,p-p65、p-IκBα的蛋白则都相应显著下调,表达量分别降低32.4、30.4%,差异均具有统计学意义(P<0.05),说明TLR4-siRNA沉默TLR4基因后,GiP-B1激活NF-κB信号通路的作用减弱。该结果提示GiP-B1可通过TLR4上调NF-κB p65磷酸化水平,诱导p-IκBα磷酸化降解,促进NF-κB入核,从而启动NF-κB信号通路,激活巨噬细胞的免疫应答反应。
3 讨论与结论
巨噬细胞是机体先天性免疫的重要执行者,作为专职性组织吞噬细胞,通过其表面表达的TLRs等模式识别受体(pattern recognition receptor,PRR),可以识别病原微生物表面保守的病原体相关分子模式(pathogen - associated molecular pattern,PAMP),通过下游的信号途径,调节各种免疫反应基因的表达从而清除病原体[17]。研究表明,许多天然植物多糖可作为TLR4的配体,通过MyD88依赖和非依赖两条途径进行巨噬细胞内信号传递,促进NF-κB进入细胞核并与DNA启动子上特定识别序列结合,介导细胞因子IL-1、IL-6、TNF-α等的表达,同时这些细胞因子又作为NF-κB的刺激剂,可进一步活化NF-κB造成持续的炎症反应,激活适应性免疫应答[18-22]。
胀果甘草作为中药甘草的一种基源植物,其主要药效物质除了具有抗癌活性的查尔酮类外,还包括具有抗氧化、抑制α-葡萄糖苷酶活性、免疫调节活性的多糖类[10-12,23-25]。前期本课题组研究发现,胀果甘草粗多糖GiP及其纯化组分具有促进巨噬细胞和淋巴细胞增殖作用,其中含量较高的纯化组分GiP-B1对巨噬细胞RAW 264.7的增殖、吞噬、分泌细胞因子的功能具有显著促进作用。前期课题组利用anti-TLR4处理细胞并加样干预后发现,其作用机制与激活TLR4/NF-κB信号通路有关。本文利用siRNA技术,通过TLR4-siRNA沉默TLR4基因,发现GiP-B1促进巨噬细胞RAW 264.7增殖、分泌细胞因子TNF-α、IL-1β、IL-6的作用被抑制,说明TLR4参与了GiP-B1对巨噬细胞RAW 264.7增殖、分泌细胞因子的作用,即GiP-B1激活巨噬细胞与TLR4相关,这与前期抗体封闭实验的结果是一致的。另外,从GiP-B1通过TLR4激活巨噬细胞分泌的TNF-α、IL-1β、IL-6等细胞因子的类型上看,提示GiP-B1激活巨噬细胞后可诱导其向M1型极化,M1型巨噬细胞除了促进炎症反应外,还具有抗原提呈能力,能够激活T细胞的适应性免疫反应,诱导Thl细胞免疫反应,对病原体和肿瘤细胞可发挥宿主免疫清除功能[26,27]。前期研究也发现,GiP-B1也具有一定的体外抗肿瘤作用,其作用机制是否与GiP-B1促进巨噬细胞极化有关,是否可以通过调节肿瘤微环境中的巨噬细胞促进机体的抗肿瘤免疫作用还需要进一步深入研究。
为了进一步证明GiP-B1激活巨噬细胞与TLR4/NF-κB通路有关,本实验还对TLR4-siRNA干预下GiP-B1对巨噬细胞NF-κB通路上游调控基因TLR4、依赖性分子MyD88、受体下游基因NF-κBp65、IκBα等的mRNA和蛋白表达变化进行了研究。结果发现由于TLR4基因被沉默,TLR4 mRNA表达量降低,细胞核内游离NF-κBp65含量显著减少,激活NF-κB通路的作用也随之降低;而GiP-B1不仅可提高正常状态下巨噬细胞中TLR4基因的表达,上调TLR4信号依赖分子MyD88及下游基因NF-κBp65、p-IκBα的mRNA和蛋白表达量,而且还可上调因RNA干扰导致的TLR4及MyD88、NF-κBp65、p-IκBα的mRNA和蛋白的表达下降,进一步证明GiP-B1可作为TLR4配体之一,可活化依赖MyD88的TLR4/NF-κB信号通路,使NF-κB家族中的核转录因子p65被活化,导致IκB发生磷酸化降解而与NF-κB解离,促进NF-κB从细胞质移位到细胞核,与DNA特定序列结合,调节炎症细胞因子、细胞增殖(抗凋亡)等基因的转录,参与炎症反应、免疫应答等。GiP-B1通过TLR4/MyD88/NF-κB信号通路激活巨噬细胞的调控方式,与上述研究中多糖的作用通路几乎一致[20-22]。
综上所述,GiP-B1可通过TLR4/NF-κB信号通路调控巨噬细胞RAW 264.7免疫功能,其调控作用主要是通过MyD88依赖途径实现的。本实验为胀果甘草多糖激活巨噬细胞的作用研究提供了实验依据,有助于阐明胀果甘草多糖在炎症反应、免疫应答等方面的作用机制。

