蒲公英根多糖硫酸酯化工艺条件优化及其对HepaRG细胞氧化损伤的保护作用
朱永红,范震宇,韩 勇,吴雯仪,蔡亮亮*
1南通大学附属医院药学部;2南通大学附属医院肿瘤科;3国药控股南通有限公司,南通 226001
多糖的活性通常与糖单元的组成、分子量、糖苷键的类型、主链构型、支链、空间构型相关,结构修饰后的多糖与原多糖相比,水溶性会明显提高,有利于多糖活性的增强,有些甚至会产生新的生物活性。磷酸化、硫酸酯化、羧甲基化和乙酰化是常用的多糖化学修饰方法,其中硫酸酯化多糖因其具有良好的生物活性,如抗凝血、抗炎、抗氧化、抗肿瘤、增强机体免疫力等[1-5],引起越来越多研究人员的关注。多糖的硫酸酯化是指多糖分子链上的羟基被硫酸基团取代而发生的反应,反应所得的产物又称多糖硫酸酯[6]。多糖硫酸酯化常用的方法主要有氯磺酸-吡啶法、浓硫酸法、Nagasawa法等[7]。其中氯磺酸-吡啶法具有反应试剂经济、反应条件简单、产物回收率高等优点,因此常作为多糖硫酸酯化的方法。
蒲公英根为菊科植物蒲公英的干燥根,具有抗氧化、降血脂、保肝等多种药理活性[8-10]。马红梅等的研究表明多糖是蒲公英根中含量最高的活性成分,其含量可达42.75%[11]。本课题组前期研究发现蒲公英根多糖具有较好的体外抗氧化活性,体现在对DPPH自由基、羟自由基、超氧阴离子自由基均有较好的清除能力,呈现一定的量效关系[12]。但是我们在研究中发现蒲公英根多糖水溶性不是很好,限制其发挥更好的药效。文献报道多糖硫酸酯化可以提高多糖的水溶性,增强其生物活性[13]。因此,作者考虑对蒲公英根多糖进行硫酸酯化修饰。H2O2是一种常见的活性氧分子,可通过破坏蛋白质与脂质,尤其是基因组与线粒体中的DNA,诱导细胞凋亡或坏死[14]。由于H2O2能够有效提高细胞内的氧化应激水平,模拟机体内的氧自由基的损伤情况,因而常被用于建立体外细胞氧化应激损伤的模型物质[15]。因此,本研究拟采用H2O2造细胞氧化应激损伤模型,考察硫酸酯化蒲公英根多糖对H2O2诱导细胞损伤的保护作用。
综上,本研究采用氯磺酸-吡啶法对蒲公英根多糖进行硫酸酯化修饰,以取代度为指标,用响应曲面法对硫酸酯化的工艺进行优化,初步探讨蒲公英根多糖及其硫酸酯对H2O2诱导致HepaRG细胞氧化损伤的保护作用,以期为蒲公英根多糖的开发利用提供有价值的参考。
1 材料
1.1 实验材料
HepaRG细胞(上海冠导生物科技有限公司);蒲公英根(吉林省鼎祥参业有限公司),蒲公英(吉林)。
1.2 试剂
MTT(批号:73020200812,上海碧云天生物技术有限公司);吡啶(批号:20150416,上海凌峰化学试剂有限公司);二甲基亚砜(批号:20150818,上海凌峰化学试剂有限公司);氯磺酸(批号:C1276,山东西亚化学试剂有限公司);二甲基甲酰胺(批号:20190424,国药集团化学试剂有限公司);酚酞(批号:20151222,国药集团化学试剂有限公司);氢氧化钠(批号:20181221,国药集团化学试剂有限公司);硫酸钾(批号:20190507,国药集团化学试剂有限公司);氯化钡(批号:151015,西陇化工股份有限公司);盐酸(批号:150120044H,南京化学试剂有限公司);1640培养基(批号:8121248,美国Gibco公司);胰蛋白酶(批号:2186974,美国Gibco公司);胎牛血清(批号:2177358,美国Gibco公司)。
1.3 仪器
H03-A数显磁力搅拌器(上海梅颖浦);HWS-24恒温水浴锅(上海一恒科学仪器有限公司);IX53荧光倒置显微镜(奥林巴斯有限公司);TENSOR 27傅立叶变换红外光谱仪(德国布鲁克公司);MK-3酶标仪(赛默飞世尔科技有限公司);Forma 3111型CO2培养箱(赛默飞世尔科技有限公司)。
2 实验方法
2.1 蒲公英根多糖的制备
取蒲公英根适量,用蒸馏水洗净,70 ℃下烘干,然后将干燥的蒲公英根磨成粉末。称取一定量药材粉末,用95%乙醇回流提取2次,每次2 h,趁热抽滤,取滤渣,烘干备用;精密称取滤渣约20 g,加入500 mL蒸馏水,回流提取2次,每次4 h,合并2次的提取液,离心(4 000 rpm)15 min,收集上清液,上清液减压浓缩至适量体积,然后加入4倍体积的无水乙醇沉淀,4 ℃静置过夜,Sevag法除蛋白,样品溶液用透析袋(透析分子量3 500 Da)流水透析48 h,收集透析液并浓酸缩至适量体积,冷冻干燥得蒲公英根多糖。另取2份滤渣约20 g,按照上述提取工艺提取多糖,计算蒲公英根多糖的得率,多糖得率=(多糖质量/药材质量)×100%。
2.2 多糖含量的测定
采用苯酚-硫酸法测定蒲公英根多糖的含量。精密称取葡萄糖对照品10 mg,用蒸馏水溶解配制成约100 μg/mL的对照品溶液。精密量取不同体积(0.1、0.2、0.3、0.5、0.6、0.8 mL)的葡萄糖对照品溶液分别置于6个具塞试管中,补加蒸馏水至1 mL,摇匀。另取1 mL蒸馏水置具塞试管中,作为空白对照。每支试管中分别加入5%苯酚溶液1 mL,摇匀,迅速加入浓硫酸5 mL,充分摇匀,90 ℃下反应30 min,室温冷却30 min。于490 nm波长处测定吸光度。蒲公英根多糖按照上述方法测定吸光度,计算多糖含量。
2.3 多糖硫酸酯化工艺研究
2.3.1 硫酸酯化试剂的配制
此反应需严格无水,首先用无水硫酸钠对吡啶脱水,制得无水吡啶。取适量体积的无水吡啶置于烧瓶中,冰浴下搅拌10 min,另取适量体积的氯磺酸,缓慢加入,并不断搅拌,室温下反应30 min,制得硫酸酯化试剂,4 ℃保存备用。参照上述方法制备不同吡啶-氯磺酸体积比(2、4、6、8、10)的酯化试剂。
2.3.2 硫酸酯化反应
取0.2 g蒲公英根多糖置于烧瓶中,加入60 mL无水二甲基甲酰胺(DMF),搅拌使其溶解。逐滴加入已经制备好的酯化试剂,加完后调节至适当温度,反应一段时间,反应完成后,恢复至室温,用20%氢氧化钠溶液调节pH至中性,自来水透析1天,蒸馏水透析2天。透析液浓缩,冷冻干燥得硫酸酯化蒲公英根多糖。
2.3.3 单因素试验
2.3.3.1 反应温度对蒲公英根多糖硫酸酯化的影响
精密称取0.2 g蒲公英根多糖,置于烧瓶中,用60 mL无水二甲基甲酰胺搅拌使其溶解,平行配制5份样品溶液。分别逐滴加入15 mL酯化试剂(吡啶∶氯磺酸=6),加完后调节至不同温度(50、60、70、80、90 ℃),反应3 h,反应完成后,调pH至中性,透析,冷冻干燥。考察反应温度对蒲公英根多糖硫酸酯化的影响。
2.3.3.2 吡啶与氯磺酸比对蒲公英根多糖硫酸酯化的影响
精密称取0.2 g蒲公英根多糖,置于烧瓶中,用60 mL无水二甲基甲酰胺搅拌使其溶解,平行制备5份样品。分别逐滴加入吡啶与氯磺酸的不同比例(2、4、6、8、10)制备的酯化试剂15 mL,加完后调节温度至80 ℃,反应3 h,反应完成后,调pH至中性,透析,冷冻干燥。考察吡啶与氯磺酸比对蒲公英根多糖硫酸酯化的影响。
2.3.3.3 反应时间对蒲公英根多糖硫酸酯化的影响
精密称取0.2 g蒲公英根多糖,置于烧瓶中,用60 mL无水二甲基甲酰胺搅拌使其溶解,平行配制5 份样品溶液,分别逐滴加入15 mL酯化试剂(吡啶∶氯磺酸=6),加完后调节温度至80 ℃,分别反应不同时间(1、2、3、4、5 h),反应完成后,调pH至中性,透析,冷冻干燥。考察反应时间对蒲公英根多糖硫酸酯化的影响。
2.3.4 响应曲面实验
根据单因素试验结果,每个单因素选择取代度较高的三个水平,以反应温度、吡啶与氯磺酸比、反应时间为自变量,设计三因素三水平的响应面试验。实验因素水平编码见表1。

表1 响应面分析因素及水平表
2.3.5 取代度测定
2.3.5.1 溶液配制
明胶溶液:精密称取明胶2 g,溶于400 mL蒸馏水中,4 ℃保存备用;氯化钡-明胶溶液:称取氯化钡10 g溶于100 mL明胶溶液中,4 ℃保存备用;硫酸钾溶液的配制:精密称取硫酸钾0.362 g,置于500 mL量瓶中,用蒸馏水溶解并稀释至刻度,摇匀,得0.4 mg/mL SO42-工作液,备用;0.2 mol/L盐酸的配制:精密量取9 mL盐酸置500 mL量瓶中,加水至刻度,摇匀。
2.3.5.2 标准曲线的绘制
参考文献[16]的方法作轻微的修改,精密量取标准K2SO4溶液(0.4 mg/mL)0、0.5、1、2、3、5、7、9 mL,分别置于50 mL量瓶中,加水补足至10 mL。然后依次加入0.2 mol/L的盐酸溶液10 mL,明胶溶液1 mL,充分振荡混匀,再加入2.0 mL的氯化钡-明胶溶液,涡旋混匀。室温下反应20 min,用紫外分光光度计在360 nm波长处测得吸光度值记为A1。空白试液的吸光度值记为A2,以硫酸根的浓度为横坐标,(A1-A2)吸光度值为纵坐标,绘制标准曲线。
2.3.5.3 样品硫酸酯化取代度测定
精密称取硫酸酯化蒲公英根多糖20 mg,加入20 mL盐酸溶液(1 mol/L),沸水浴中水解6 h,使硫酸根离子游离。取5 mL样品溶液同标准曲线项下方法分析,测量氯化钡-明胶与明胶的吸光度差值。然后代入以下方程,计算取代度(degree of substitution,DS),DS=1.62S/(32-1.02S),S是样品中硫元素的百分率。
2.3.6 红外光谱分析
取硫酸酯化蒲公英根多糖约2 mg,与400 mg溴化钾研磨压片,于4 000~400 cm-1进行红外检测。
2.4 蒲公英根多糖及其硫酸酯的细胞毒性试验
取对数生长期的HepaRG细胞,用含10%胎牛血清的1640培养基,调整细胞密度为5×104个/mL,将HepaRG细胞悬液加入96孔培养板中,置于37 ℃、5%CO2培养箱中培养24 h。对照组更换新鲜培养基,其他组弃去原培养基,加入含有不同浓度(31.25、62.5、125、250、500、1 000、2 000 μg/mL)的蒲公英根多糖、硫酸酯化蒲公英根多糖。每组设8个复孔,于37 ℃,5%CO2培养箱中培养24 h。弃去培养基,每孔加入MTT溶液(1 mg/mL)100 μL,孵育4 h,吸净MTT溶液,弃上清,每孔加150 μL DMSO溶液,振荡 10 min,用酶标仪于490 nm处检测。细胞存活率计算公式如下:存活率=(实验组OD值/对照组OD值)×100%。
2.5 蒲公英根多糖及其硫酸酯对HepaRG细胞氧化损伤的保护作用
取对数生长期的HepaRG细胞,用含10%胎牛血清的1640培养基,调整细胞密度为5×104个/mL,将HepaRG细胞悬液加入96孔培养板中,置于37 ℃、5%CO2培养箱中培养24 h。H2O2造模浓度参考文献[17],选择300 μmol/L。细胞分为对照组,H2O2模型组、蒲公英根多糖组、硫酸酯化蒲公英根多糖组。对照组、模型组更换培养液,蒲公英根多糖组、硫酸酯化蒲公英根多糖组更换不同浓度(31.25、62.5、125、250、500、1 000、2 000 μg/mL)的溶液,预处理24 h。吸去96孔板中的培养液,除对照组更换培养液,其他各组更换300 μmol/L H2O2溶液预处理8 h,弃去上清,每孔加入MTT溶液(1 mg/mL)100 μL,实验设8个复孔,孵育4 h,吸净MTT溶液,弃上清,每孔加150 μL DMSO溶液,振荡10 min,用酶标仪于490 nm处检测。细胞存活率计算同上。
3 结果与讨论
3.1 多糖含量与提取率
以葡萄糖含量为横坐标,吸光度值为纵坐标,绘制标准曲线,线性回归方程为y= 0.057x+0.035,r= 0.999 2。根据标准曲线方程计算出蒲公英根多糖含量为85.2%。蒲公英根多糖的提取率为43.86%±0.65%。
3.2 单因素试验结果
3.2.1 反应温度对蒲公英根多糖硫酸酯化的影响
结果见图1a,在50~80 ℃温度范围内,随着反应温度的升高,硫酸酯化蒲公英根多糖取代度明显增加。80~90 ℃时,随着温度的升高,多糖硫酸基取代度反而有稍许降低,这可能是多糖发生降解,产生副反应的缘故。本实验在80 ℃条件下,多糖的取代度最高。因此选择80 ℃作为后续硫酸酯化反应的温度。
3.2.2 氯磺酸与吡啶的比对蒲公英根多糖硫酸酯化的影响
结果见图1b,蒲公英根多糖硫酸基取代度随吡啶用量的升高先增加后降低。多糖在吡啶溶液中溶解度较低,氯磺酸与吡啶能发生络合反应,提高多糖溶解度,使得多糖硫酸根取代度提高。本实验在吡啶与氯磺酸的比为6条件下,多糖的取代度最高,因此选择吡啶与氯磺酸的比为6作为后续硫酸酯化反应的吡啶与氯磺酸的比。
3.2.3 反应时间对蒲公英根多糖硫酸酯化的影响
结果见图1c,反应时间1~3 h,取代度由0.43增至1.05,增加趋势明显。这可能是多糖在此时间范围内,与硫酸酯化试剂不断充分接触的缘故。反应时间3~5 h,取代度由1.05降至0.89,这是因为硫酸酯化反应是可逆的,当达到反应平衡时,多糖发生了降解,取代度因而有降低的趋势。
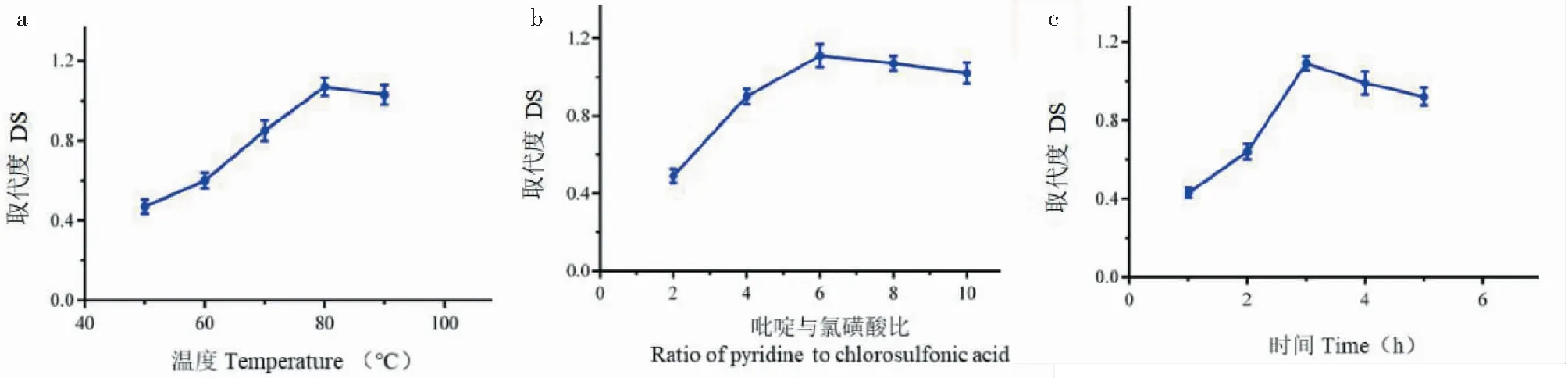
图1 单因素试验结果Fig.1 The results of single factor tests
3.3 响应面试验结果
采用Box-Behnken 设计,以反应温度、吡啶与氯磺酸比、反应时间为自变量,设计三因素三水平的响应面试验。试验设计与结果见表2。采用Design-Expert 8.0.6.1软件对数据进行分析,得二元多项回归方程:Y=1.06+0.055A+0.18B+0.06C+0.024AB+0.072AC-0.089BC-0.15A2-0.071B2-0.13C2。
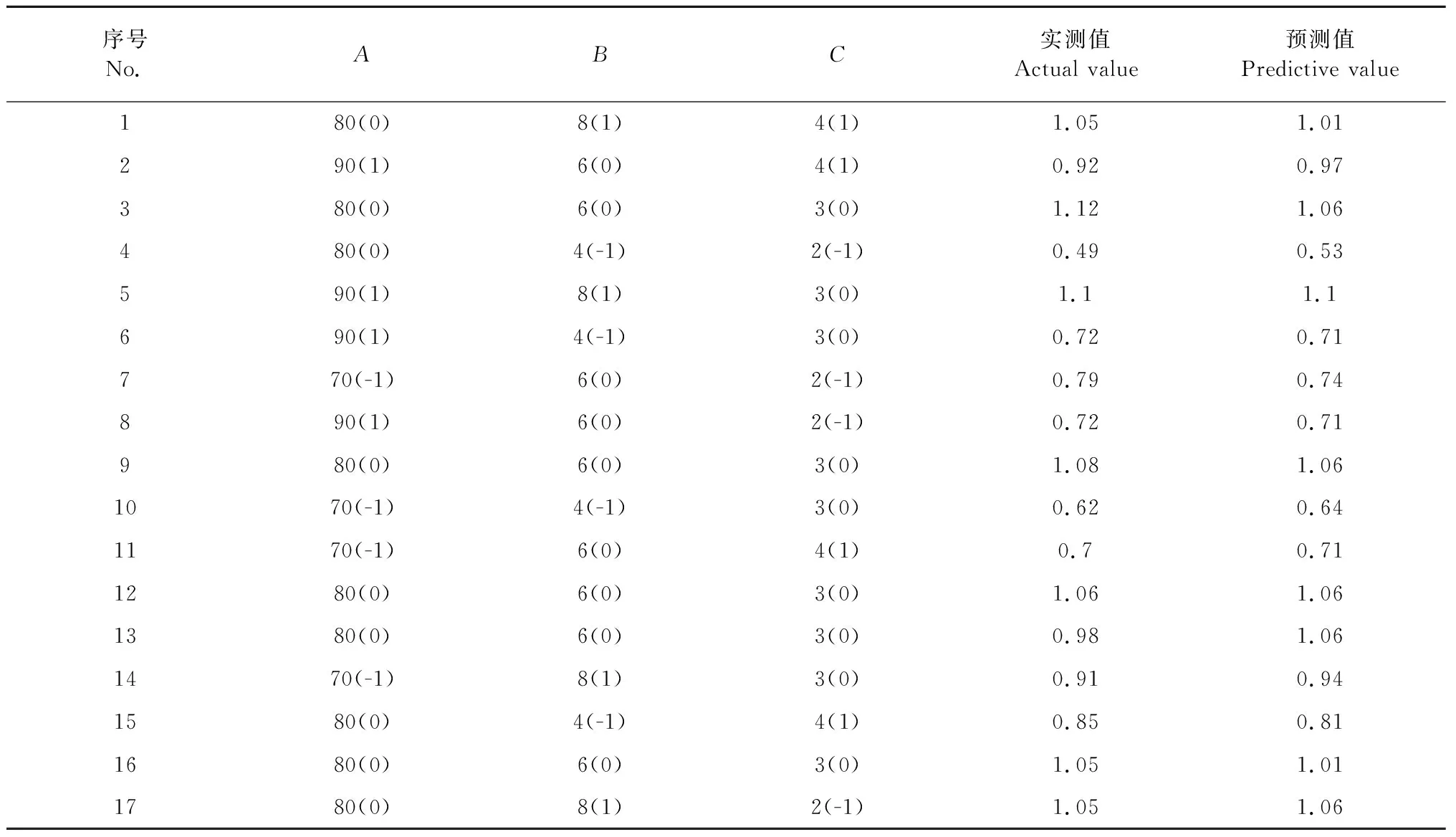
表2 Box-Behnken试验设计与结果
由表3可知,模型的一次项反应温度(P=0.025 5<0.05)具有显著性;吡啶与氯磺酸比(P<0.000 1)具有极显著性;反应时间(P=0.018 8<0.05)具有显著性。交叉项中反应温度与反应时间(P=0.035 7<0.05),吡啶与氯磺酸比与反应时间(P=0.014 9<0.05)具有显著性。二次项中反应温度(P=0.000 9<0.001)具有极显著性;吡啶与氯磺酸比(P=0.033 6<0.05)具有显著性;反应时间(P=0.002 2<0.01)具有高度显著性。整体模型的P=0.000 3,表明二次方程模型显著,模型的失拟项P=0.357 6>0.05,说明模型显著合适。
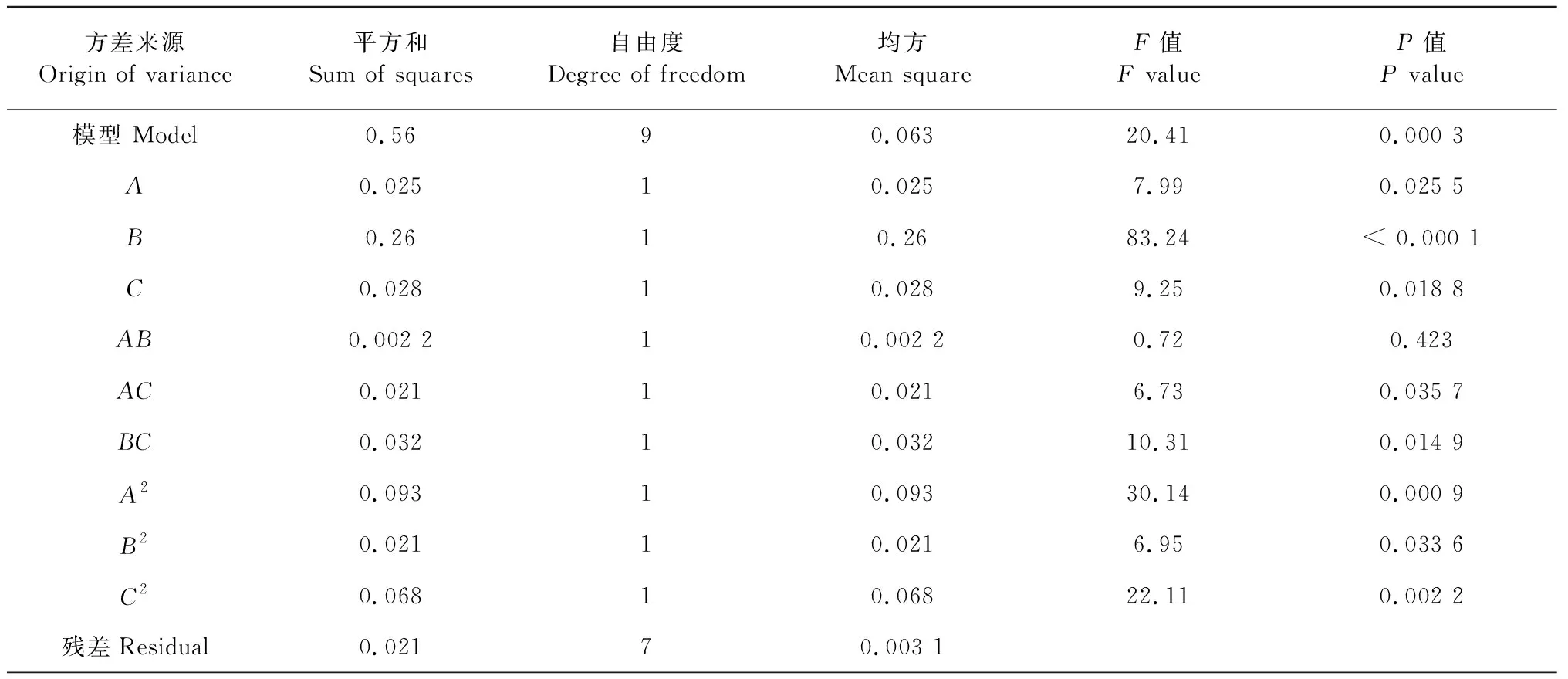
表3 回归分析结果
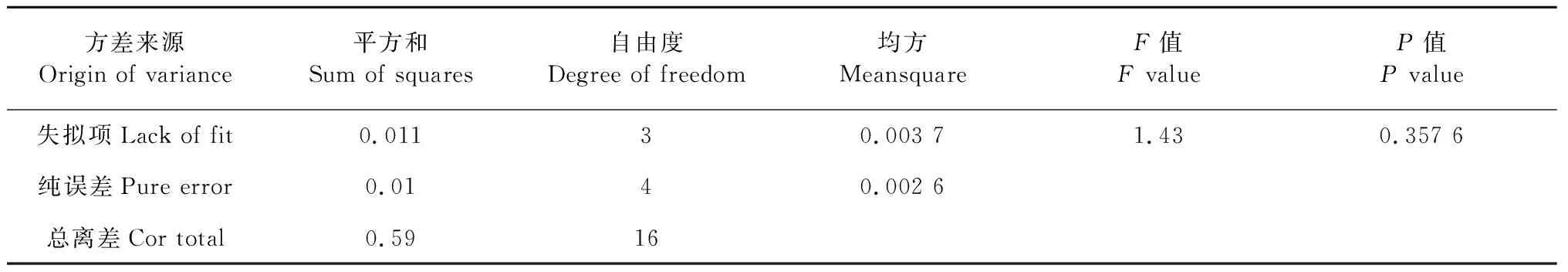
续表3(Continued Tab.3)
响应曲面及等高线分析蒲公英根多糖硫酸酯化的响应面分析见图2。等高线图反映了影响多糖硫酸酯化的各因素的交互作用。椭圆形等高线表示各因素交互作用显著,曲率半径与交互作用呈正相关,半径最大的椭圆上取值,取代度最小,半径最小的椭圆上取值,取代度最大,这些等高线可以反映取代度的变化情况。响应面的最高点同时也是等高线最小椭圆的中心点。各因素对多糖取代度的影响为:吡啶与氯磺酸比与反应时间>反应温度与反应时间>反应温度与吡啶与氯磺酸比。

图2 等高线图及响应面3D图Fig.2 Contourplots and response surface 3D plots
由Design-Expert.8.0.6.1软件分析,多糖硫酸酯化取代度最大为1.17,对应的反应条件为反应温度82.56 ℃、吡啶与氯磺酸比为8、反应时间2.96 h。为了试验操作方便,将多糖的硫酸酯化反应条件修正为反应温度83 ℃、吡啶与氯磺酸比为8、反应时间3 h。按照此反应条件重复3次,取代度分别为1.12、1.16、1.11,方法稳定,平均取代度1.13,此方法可行。
3.4 取代度检测
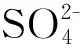
3.5 硫酸酯化蒲公英根多糖红外光谱分析
硫酸酯化蒲公英根多糖的红外光谱分析见图3,在波长为3 530 cm-1有一个比较宽的振动吸收峰即-OH的伸缩振动吸收峰;2 967.1 cm-1吸收峰是-CH的伸缩振动吸收峰;在1 656.1 cm-1存在较强的吸收峰是羰基不对称伸缩振动引起的;1 490、1 379.2 cm-1是-CH面内弯曲振动引起的;1 261.5、1 242.3 cm-1由S=O不对称振动引起;1 067.4、1 024.6、1 000.5 cm-1由C-O伸缩振动引起的;815.3 cm-1由对称的C-O-S振动引起,说明多糖硫酸酯化修饰成功。

图3 硫酸酯化多糖的红外光谱图Fig.3 Infraredspectrumof sulfated polysaccharide
3.6 蒲公英根多糖及硫酸酯的细胞毒性试验
在评估蒲公英根多糖及硫酸酯对HepaRG细胞氧化应激损伤的保护作用之前,采用MTT法考察多糖及硫酸酯对HepaRG细胞活力的影响,以确保其无细胞毒性。试验结果见图4a、4b。HepaRG细胞在含不同浓度(31.25~1 000 μg/mL)蒲公英根多糖及硫酸酯溶液中孵育24 h的细胞存活率与对照组比较,差异无统计学意义;在浓度为2 000 μg/mL时,差异有统计学意义,但是各组的细胞存活率均大于90%,这表明蒲公英根多糖及硫酸酯具有良好的生物学活性,对HepaRG细胞无显著的细胞毒性。
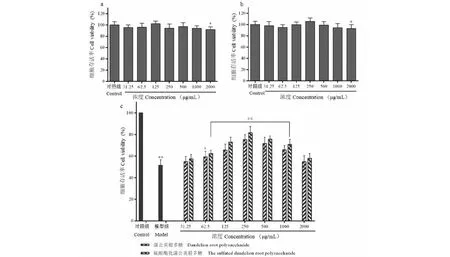
图4 蒲公英根多糖及其硫酸酯对H2O2致HepaRG细胞损伤活力的影响Fig.4 Effects of dandelion root polysaccharide and its sulfate on H2O2 induced HepaRG cell injury注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。Note: Compared with control group,*P<0.05,**P<0.01;Compared with model group,#P<0.05,##P<0.01.
3.7 蒲公英根多糖及硫酸酯对HepaRG细胞氧化应激损伤的保护作用
MTT测定结果见图4c。模型组细胞存活率为(51.38±3.92)%。与模型组比较,蒲公英根多糖及其硫酸酯在浓度(31.25~250 μg/mL)范围内,HepaRG细胞存活率与浓度成剂量依赖性,在250 μg/mL时,HepaRG细胞存活率最高。浓度(500~2 000 μg/mL)范围内,HepaRG细胞存活率随着浓度的增加,有降低的趋势,这可能是较高浓度的多糖影响细胞膜内渗透性。浓度31.25 μg/mL时,蒲公英根多糖及硫酸酯对H2O2损伤的HepaRG细胞保护无明显差异。62.5~2 000 μg/mL浓度范围内,硫酸酯化蒲公英根多糖的活性优于蒲公英根多糖。
氧化应激是指细胞暴露于高浓度氧分子或氧的化学衍生物而引起的细胞损伤,在代谢综合征中起着重要作用,它是肥胖、糖尿病、脂质沉积、慢性炎症等发生、发展的重要因素。
H2O2作为活性氧在体内的主要存在形式,其极易透过细胞膜对细胞造成损伤。在H2O2刺激下,细胞内氧化应激水平升高,细胞DNA继而受到损伤,相关基因的表达发生改变,进一步导致细胞内蛋白质的损伤,最终可以造成细胞死亡。蒲公英根多糖及其硫酸酯对H2O2致HepaRG细胞损伤具有保护作用,可能与其具有较好的抗氧化活性有关,这项研究可为蒲公英根多糖及其修饰物的开发应用提供有价值的参考。
4 结论
本试验采用氯磺酸-吡啶法对蒲公英根多糖进行硫酸酯化修饰,并用响应曲面法对硫酸酯化的工艺进行优化,得到硫酸酯化反应的最优条件为反应温度83 ℃、吡啶与氯磺酸比为8、反应时间3 h,在此条件下,硫酸酯化蒲公英根多糖的取代度为1.13。经过硫酸酯化修饰后的蒲公英根多糖对H2O2诱导的氧化损伤细胞具有较好的保护作用。本研究表明,硫酸酯化修饰有助于提高蒲公英根多糖的抗氧化能力,为蒲公英根多糖的进一步开发利用提供新的思路与方向。

