荨麻根质量标志物研究
陈 艳,李晓波,贾祎萍,胡 海,王梦月
上海交通大学药学院,上海 200240
荨麻根为荨麻科植物荨麻UrticafissaPritz、宽叶荨麻U.laetevirensMaxim.、狭叶荨麻U.angustifoliaFisch.et Hornem.、麻叶荨麻U.cannabinaL.等的干燥根。具有祛风,活血,止痛之功效,常用于风湿、类风湿、荨麻疹、湿疹,但缺乏质量评价指标研究[1,2]。因此,荨麻根的质量标志物研究具有重要意义。
前期的化学成分研究表明,裂环木脂素为荨麻根特征性成分[3-7]。其中,荨麻醇-7-O-β-D-吡喃葡萄糖苷(简称荨麻醇苷,见图1)为主要裂环木脂素成分[3,6]。本文对荨麻醇苷的生物活性进行了研究,发现其具有明显的抗炎、抗氧化、抗补体作用,可以作为荨麻质量标志物;接着,对荨麻醇苷的波谱特征进行了较系统研究,补充了UV、IR、CD、NMR等波谱数据;最后,建立了荨麻醇苷的HPLC测定方法,为荨麻根的质量评价提供了科学依据。

图1 荨麻醇苷结构式Fig.1 The chemical structure of urticoside
1 实验材料
1.1 实验材料
荨麻根采自四川、重庆、云南、新疆、广西,均经王梦月副教授鉴定,凭证标本(UR1~UT19)保存于上海交通大学药学院。
1.2 药品及试剂
荨麻醇苷(自制,经HPLC分析纯度为98.8%);RAW 264.7细胞株(中国科学院上海细胞库);甲醇、乙醇、正丁醇、二氯甲烷(分析纯,上海凌峰);乙腈、甲醇(色谱纯,上海百灵威);肝素钠、地塞米松(国药集团);MTT、LPS(Sigma);RPMI 1640 培养基、DPPH、trolox(北京伊诺凯);NO、IL-1、TNF-α、ABTS及FRAP试剂盒(南京建成);豚鼠血清、绵羊红细胞(SRBC)购自上海生物工程公司;薄层层析硅胶G板、柱色谱用硅胶(200~300目,青岛海洋);凝胶Sephadex LH-20(瑞士Amersham Pharmacia);ODS 反相硅胶(40~63 μm,德国默克);超纯水(美国Millipore)。
1.3 实验仪器
Bruker AVANCE 700 MHz核磁共振仪(德国Bruker,配有5 mm1H/13C/15N超低温探头)。Agilent 1200分析型高效液相色谱仪(美国Agilent),配有自动进样器、DAD检测器、Shim-pack VP-ODS色谱柱(250 mm × 4.6 mm,5 μm);EYELA N-101型旋转蒸发仪(东京理化); DZF-6050型真空干燥箱(上海一恒);BS300S型电子天平(北京赛多利斯);Varioskan LUX 酶标仪(美国赛默飞);Agilent 1290 UPLC-Q-TOF 质谱联用仪(美国 Agilent);Nicolet 6700 傅里叶红外光谱仪(美国Thermo Fisher);P-2000型全自动数字旋光仪、J-1500多功能圆二色谱仪(日本JASCO)。
2 实验方法
2.1 荨麻醇苷的生物活性
样品分别用RPMI 1640培养基(用于抗炎活性测试)、5%甲醇溶解(用于抗氧化、抗补体活性测定),配成0.2、1.0、5.0、20.0、100、500 μM溶液。
2.1.1 抗炎活性测定
2.1.1.1 细胞毒考察
用0.25%胰酶消化对数生长期的RAW 264.7细胞,以培养液稀释为1×105个/mL的单细胞悬液,每孔100 μL接种于96孔培养板中,置37 ℃、5% CO2培养箱中过夜,待细胞贴壁后加入各浓度药液100 μL,MTT法考察样品的细胞毒性。
2.1.1.2 炎症因子测定
RAW 264.7 细胞悬液接种96孔板,每孔100 μL,细胞数为1×105个/mL,培养24 h后,吸出培养基。加入LPS,使各组LPS终浓度为5 μg/mL。分别加入各浓度的药液100 μL,继续培养24 h,试剂盒检测上清NO、IL-1、TNF-α释放量,计算不同浓度样品的抑制率及半数抑制浓度(IC50)[8]。
2.1.2 抗氧化作用
2.1.2.1 清除DPPH活性测定
不同浓度的样品加入适量的DPPH甲醇溶液,混匀后避光放置30 min 后于517 nm 下测定吸光度(A)。同时,设置空白组(以等体积的甲醇代替DPPH溶液)和对照组(以等体积的甲醇代替样品),并以trolox代替供试品作为阳性对照组。计算不同浓度样品的DPPH清除率(清除率=[1-(A供试品-A空白)/A对照]× 100%)及半数清除浓度(EC50)。
2.1.2.2 清除ABTS活性测定
ABTS自由基清除活性测定参照试剂盒使用方法。配制过氧化氢溶液和过氧化物酶、ABTS工作液,取适量过氧化物酶工作液与不同浓度样品轻轻混匀,再加入适量ABTS工作液混匀,室温孵育6 min后在414 nm下测定A值。同时设置空白对照组(以等体积甲醇代替样品),以trolox为阳性对照。计算不同浓度样品的ABTS清除率及EC50[9]。
2.1.3 抗补体作用
2.1.3.1 经典途径
样品用BBS 缓冲液稀释,加入临界浓度的补体(1∶80稀释的豚鼠血清)、溶血素、2% SRBC。37 ℃水浴30 min,离心后取上清液在405 nm下测定A值。同时,设置对照组(等量的供试品加入BBS 缓冲液中,用于测定本底A 值)、补体组(临界浓度的补体直接加入BBS 缓冲液、溶血素和2% SRBC,用于测定临界浓度补体所造成红细胞溶血的A 值)、全溶血组(2% SRBC加入水中使之全溶血,用于观察补体组是否达到或接近全溶血水平)、阳性对照组。计算不同浓度样品的溶血抑制率(溶血抑制率=[1-(A样品-A对照)/A全溶血] × 100%)及CH50(经典途径50%抑制溶血所需供试品浓度)。
2.1.3.2 旁路途径
取临界浓度的补体(1∶4稀释的人血清)分别与不同浓度的样品混匀,加入适量的AP缓冲液和0.5%兔红细胞。37 ℃水浴30 min,离心后取上清液在405 nm下测定A。同时设置对照组、补体组、全溶血组、阳性对照组。计算不同浓度样品的溶血抑制率及AP50(旁路途径50%抑制溶血所需浓度)[10]。
2.2 荨麻醇苷的波谱特征
2.2.1 旋光度
取样品10.0 mg,溶于1.0 mL甲醇,采用旋光仪测定,测定波长589 nm。
2.2.2 紫外、CD光谱
样品分别用甲醇、无水乙醇、乙腈溶解,配成0.05 mg/mL溶液。紫外分光光度计记录样品紫外吸收曲线,并计算摩尔吸收系数;ECD 光谱仪测定CD谱。
2.2.3 红外光谱
溴化钾压片,用红外光谱仪在4 000 ~ 600 cm-1的波数范围内扫描,绘制红外图谱。
2.2.4 质谱
样品溶于甲醇,采用Agilent 1290 UPLC-Q-TOF-MS进行测定,正离子模式检测。
2.2.5 NMR谱
样品4.0 mg加入0.5 mL DMSO-d6,在Bruker 700 MHz NMR仪上测定1H谱、13C谱及二维谱(HSQC、1H-1H COSY、HMBC、NOESY)。
另取样品4.0 mg,分别加入0.5 mL CD3OD、C5D5N、Acetone-d6,在Bruker 700 NMR仪上测定1H谱、13C谱及二维谱(HSQC、1H-1H COSY、HMBC)。
2.3 荨麻醇苷的HPLC测定
2.3.1 供试品溶液的制备
取样品粉末约2 g,精密称定,置100 mL圆底烧瓶中,加入50 mL甲醇,80 ℃水浴回流提取2次,每次1 h,滤过,合并滤液,蒸干,残渣加甲醇溶解、定容至25 mL,0.22 μm微孔滤膜滤过,即得供试品溶液。
2.3.2 对照品溶液的制备
取荨麻醇苷对照品适量,精密称定,加甲醇制成每1 mL含荨麻醇苷0.285 mg的溶液。
2.3.3 色谱条件及系统适用性试验
甲醇(A)-水(B)为流动相,洗脱程序为:0~10 min 10%A、10~20 min 10%A→35%A、20~50 min 35%A→40%A;流速1.0 mL/min;柱温30 ℃;检测波长210 nm;进样量10 μL。
2.3.4 线性关系考察
将浓度为0.285 mg/mL的荨麻醇苷溶液分别稀释2倍、10倍、20倍、80倍得到不同浓度的对照品溶液,按“2.3.3”项进样分析。以色谱峰面积为纵坐标,浓度为横坐标,绘制标准曲线,进行线性回归。
2.3.5 精密度试验
精密吸取同一对照品溶液,按“2.3.3”项连续进样6次,测定色谱峰峰面积。
2.3.6 稳定性考察
取样品粉末约2 g,精密称定,按2.3.1项制备供试品溶液,按“2.3.3”项色谱条件,分别于0、2、4、6、8、10、12、16、24 h各进样10 μL,记录色谱峰面积。
2.3.7 重复性试验
取同一批次荨麻粉末6份,每份约2 g,精密称定,按“2.3.1”项制备供试品溶液,按“2.3.3”项进样分析,记录色谱峰面积。
2.3.8 加样回收率试验
精密取已知荨麻醇苷含量的样品6份,每份约1 g,精密称定,加入荨麻醇苷对照品溶液,按“2.3.1”方法制备供试品溶液,按“2.3.3”项进样分析,计算回收率。
3 实验结果
3.1 荨麻醇苷的生物活性
对荨麻醇苷进行了抗炎、抗补体、抗氧化活性评价。结果发现:荨麻醇苷对RAW 264.7细胞没有明显的毒性,浓度达250 μM时,细胞存活率超过91.3%;荨麻醇苷具有较强的抗炎作用,能明显抑制LPS诱导RAW 264.7细胞释放NO、IL-1、TNF-α等炎症介子(半数抑制浓度均低于16 μM);荨麻醇苷能显著清除DPPH、ABTS等自由基,其作用与阳性对照trolox相当,显示出良好的抗氧化作用;荨麻醇苷还具有良好的抗补体活性,对经典途径和旁路途径均有作用(见图2)。上述结果表明荨麻醇苷具有与荨麻根抗风湿作用直接相关的生物活性,可作为荨麻质量评价指标。
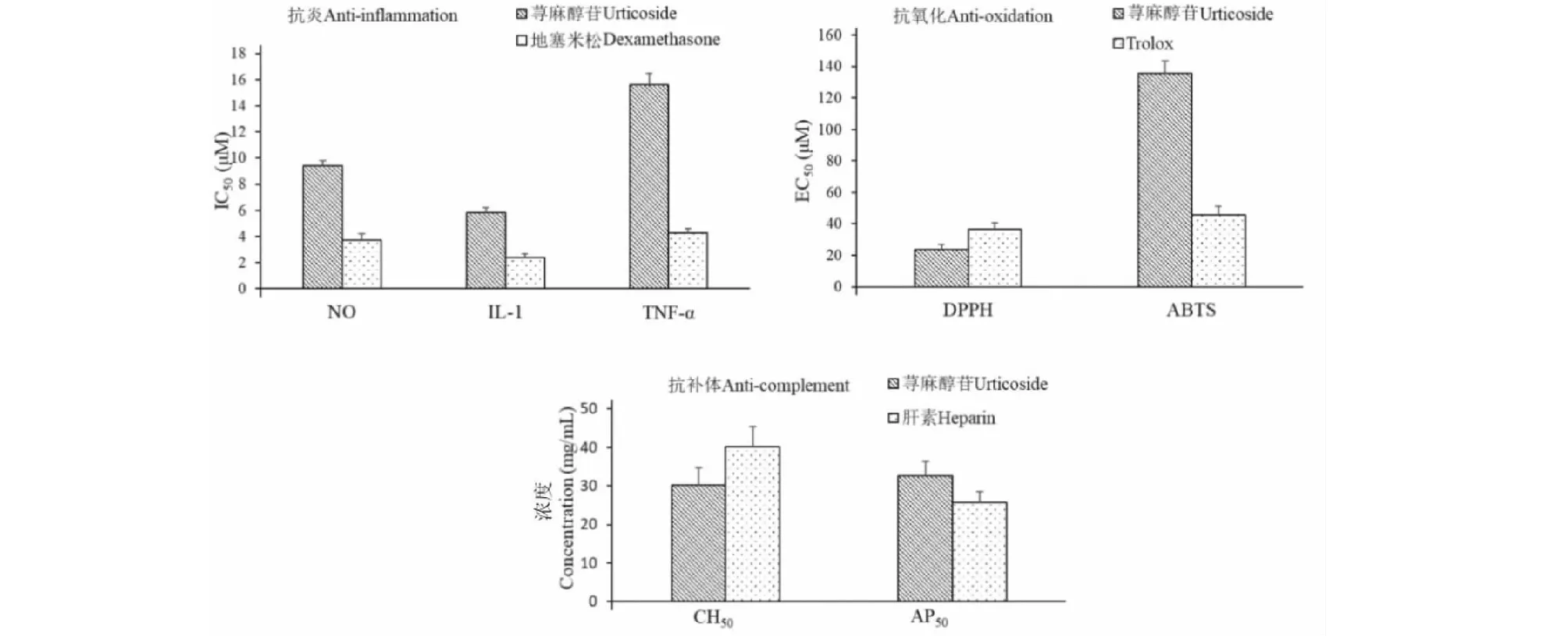
图2 荨麻醇苷生物活性Fig.2 The biological activities of urticoside
3.2 荨麻醇苷的波谱特征
3.2.1 旋光度
3.2.2 紫外光谱
样品用3种溶剂测试,结果如下UV(MeOH)λmax(ε):235(10 070),280(5 061)nm;UV(MeOH)λmax(ε):236(8 835),284(4 458);UV(MeOH)λmax(ε):235(6 378),280(3 341)。在282、240 nm左右处均显示出取代苯环的特征吸收峰。进一步比较甲醇、无水乙醇、乙腈中测试的结果,发现测试溶剂对最大吸收波长及摩尔吸收系数有明显影响。
3.2.3 红外光谱
样品在3 414 cm-1处有一宽强峰,为羟基伸缩振动峰。在2 918 cm-1处的吸收峰为亚甲基伸缩振动峰。在2 850、1 271 cm-1处分别有一尖峰、强峰,说明含有-OCH3,且-OCH3与苯环相连。1 751 cm-1处的强峰为饱和γ-饱和内酯中羰基的特征吸收峰。在1 515 cm-1处有明显吸收峰,为芳环特征峰。此外,样品在1 047、1 003 cm-1均有宽强峰,说明含有仲醇、叔醇结构。
3.2.4 质谱
HR-ESI-MS正离子模式给出准分子离子峰m/z554.223 1 [M + NH4]+(calcd for C26H36NO12,554.223 8);此外,还在m/z1 095.368 1处出现[2M + Na]+峰(calcd.for C52H64O24Na,1 095.368 5)。
3.2.5 圆二色谱
样品甲醇溶液在237、286 nm处均呈正Cotton效应(图3),与(3S,4R)荨麻醇-7-O-β-D-吡喃葡萄糖苷高斯计算结果一致。

图3 荨麻醇苷CD图Fig.3 The CD spectrum of urticoside
3.2.6 核磁共振谱
样品1H NMR(DMSO-d6,700 MHz)中出现32个氢信号,其中:芳氢6个、6个活泼氢、2个甲氧基质子;H-3和H-4之间较小的偶合常数(J< 7.0 Hz)提示C-3和C-4是反式连接。NOESY谱中未观察到H-3 和H-4之间的相关峰,进一步表明C-3和C-4是反式连接。端基质子(H-1′′′)的偶合常数(J> 7.0 Hz),提示葡萄糖为β构型。13C NMR(DMSO-d6,175 MHz)中出现26个碳信号(其中,C-4信号与溶剂重叠;葡萄糖基6个)。根据HMBC、HSQC、1H-1H COSY、NOESY等二维谱,核磁数据归属结果见表1、表2。
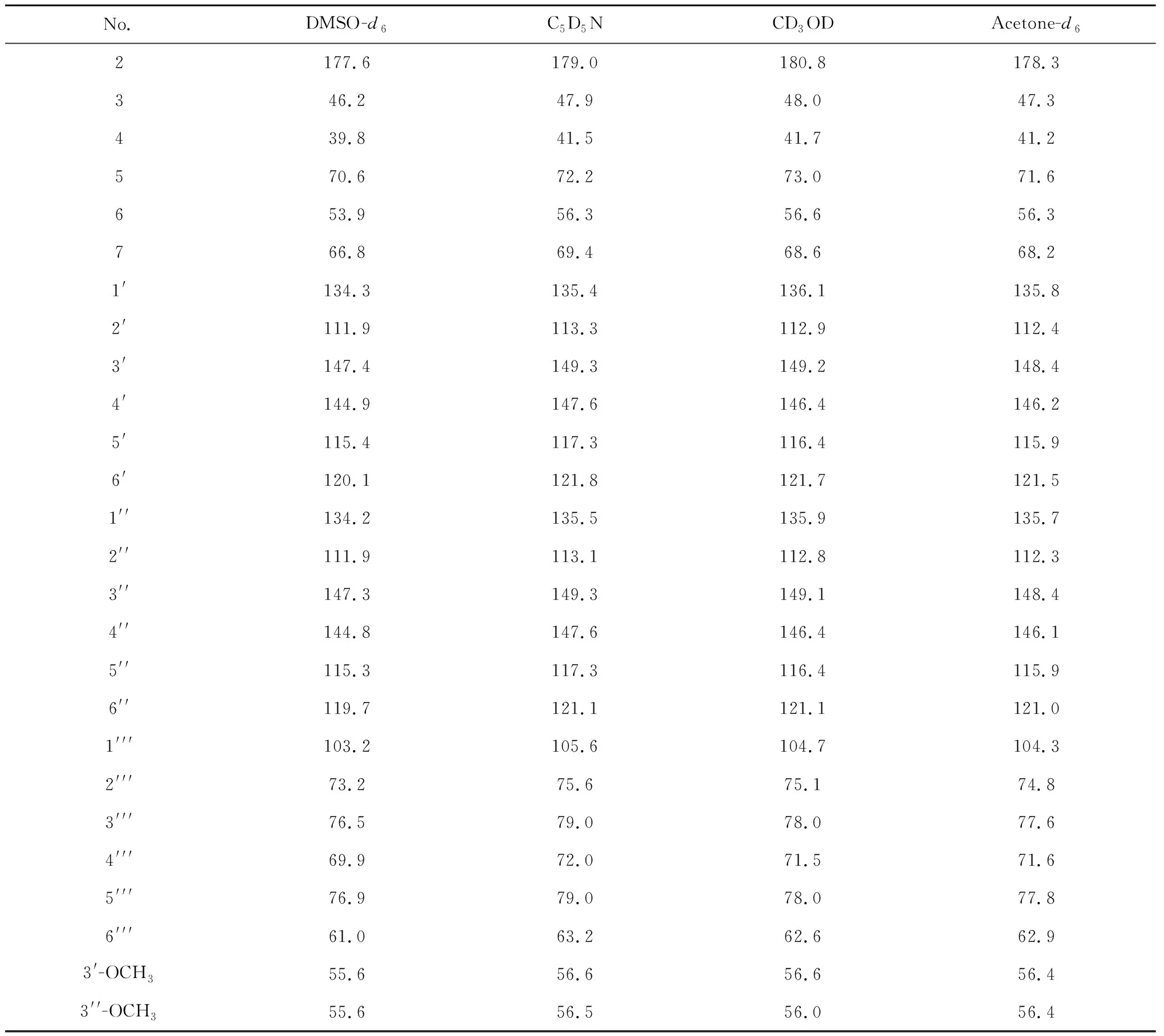
表1 测试溶剂对荨麻醇苷 13C NMR的影响(175 MHz)
进一步比较了不同溶剂对1H、13C NMR谱的影响,结果表明:不同溶剂对13C NMR谱有明显影响,部分碳化学位移相差2以上,如:羰基碳(C-2)在氘代甲醇和氘代丙酮中相差2.5 ppm;糖基上的6个碳在氘代吡啶和氘代DMSO-d6中均相差2 ppm以上(见表1)。相对于碳谱,不同溶剂对1H NMR谱影响更大,不仅影响偶合常数,且显著影响非芳环质子的化学位移(这些质子在DMSO-d6和C5D5N中化学位移甚至相差0.8 ppm以上(见表2)。
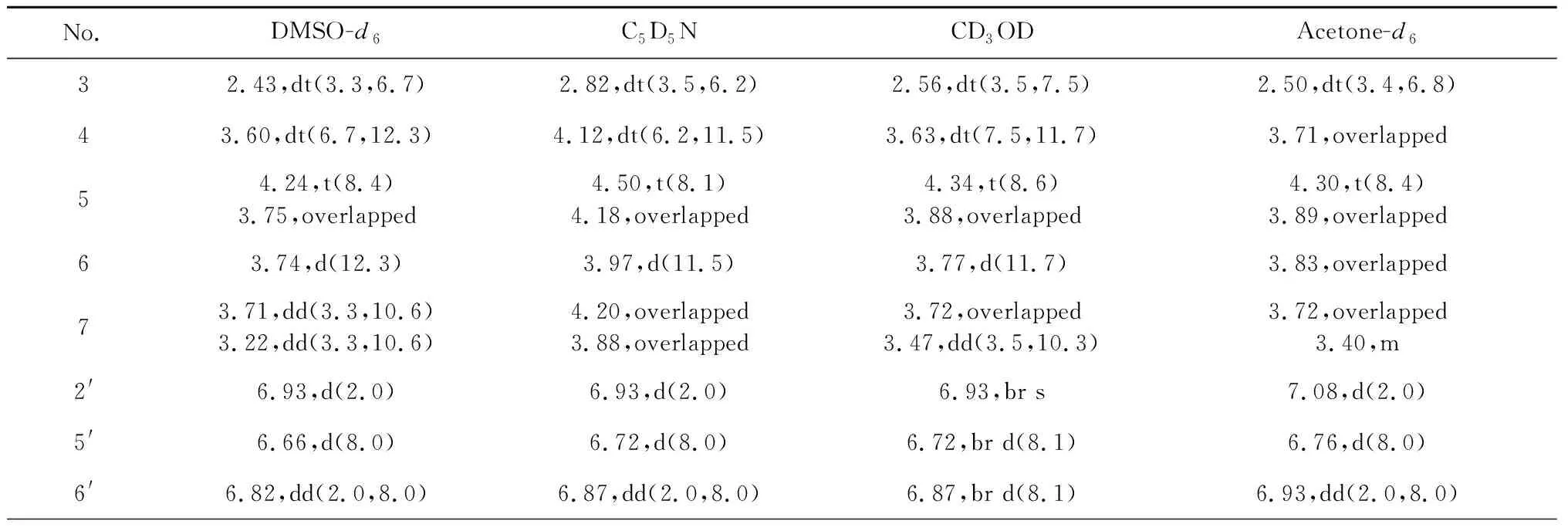
表2 测试溶剂对荨麻醇苷的1H NMR影响(700 MHz)
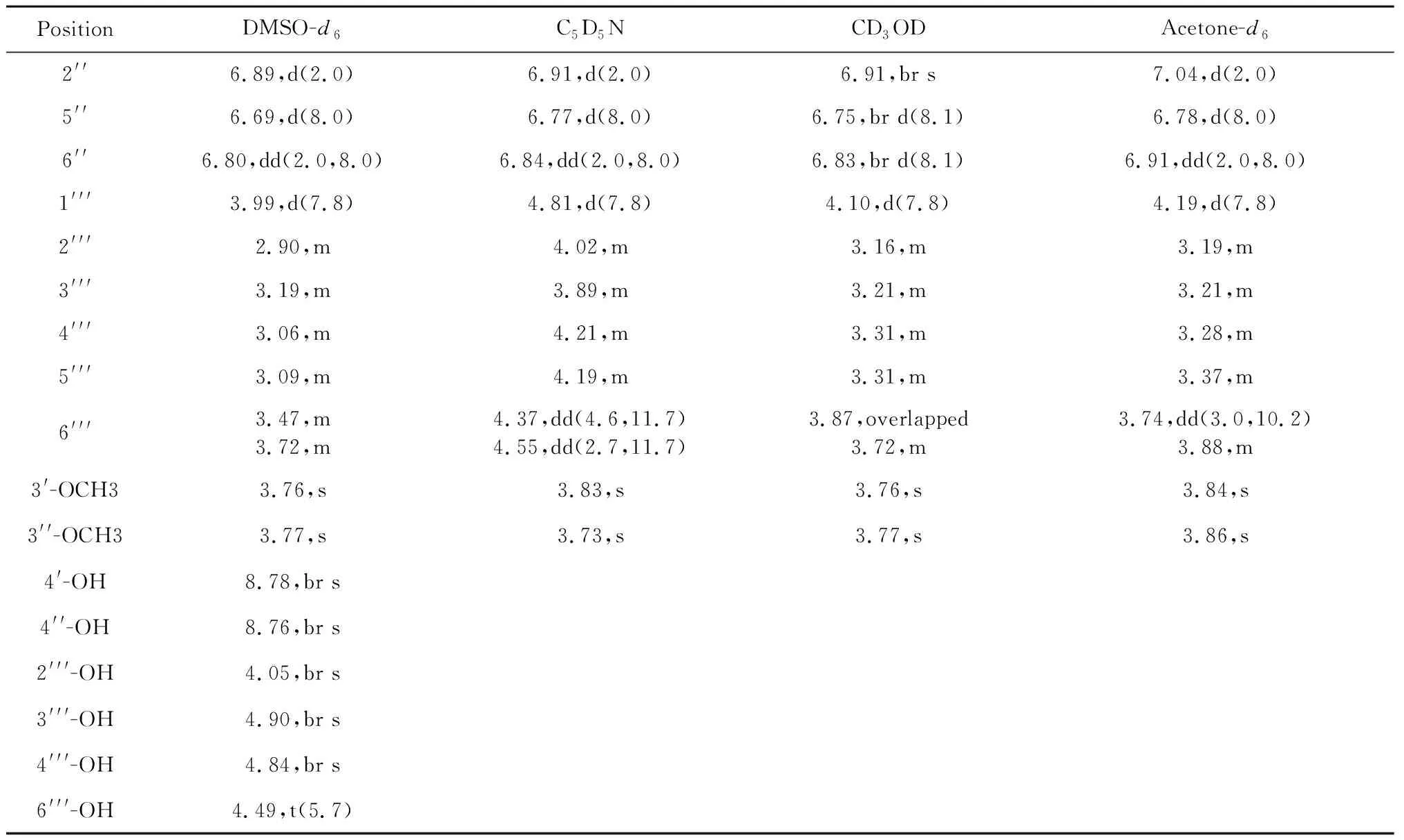
续表2(Continued Tab.2)
3.3 HPLC含量测定
3.3.1色谱条件及系统适用性试验
对照品和代表性供试品溶液的HPLC色谱图见图4,显示色谱条件及系统适用性试验结果良好。
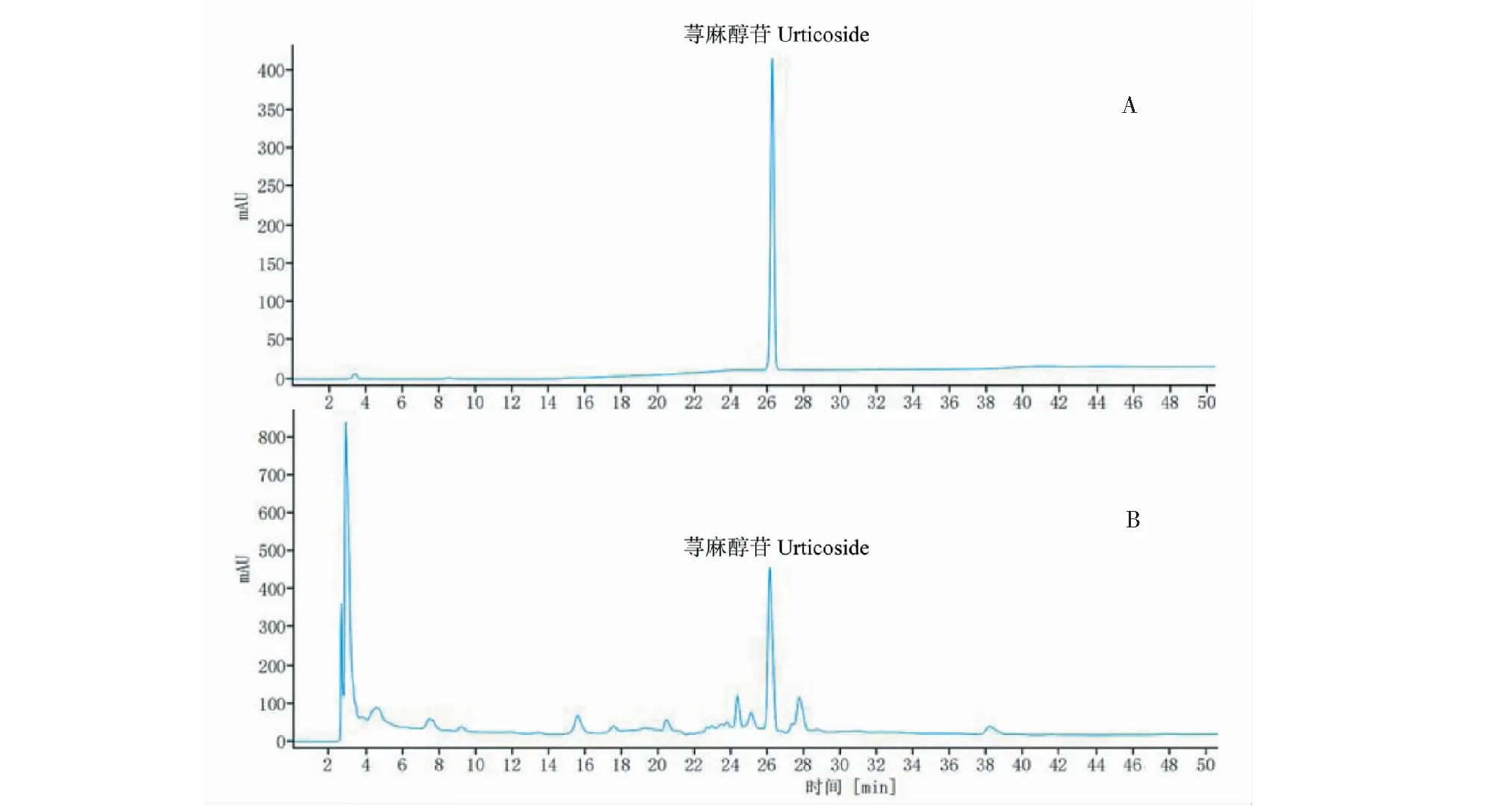
图4 对照品(A)及样品(B)HPLC图Fig.4 HPLC chromatograms of reference (A) and Urticae Rhizomae (B)
3.3.2 线性关系考察
荨麻醇苷在3.562 5×10-3~ 0.285 mg/mL线性关系良好,回归方程为Y= 34.96X-15.09(r2= 0.999 6)。
3.3.3 精密度试验
精密吸取同一对照品溶液,连续进样6次,结果峰面积的RSD为0.87%,表明精密度良好。
3.3.4 稳定性考察
结果荨麻醇苷峰面积的RSD为1.80%,表明供试品溶液在24 h内稳定性良好。
3.3.5 重复性试验
结果荨麻醇苷峰面积的RSD为0.85%,表明重复性良好。
3.3.6 加样回收率试验
平均回收率为103.72%,RSD值为1.6%,表明该方法准确度良好(见表3)。
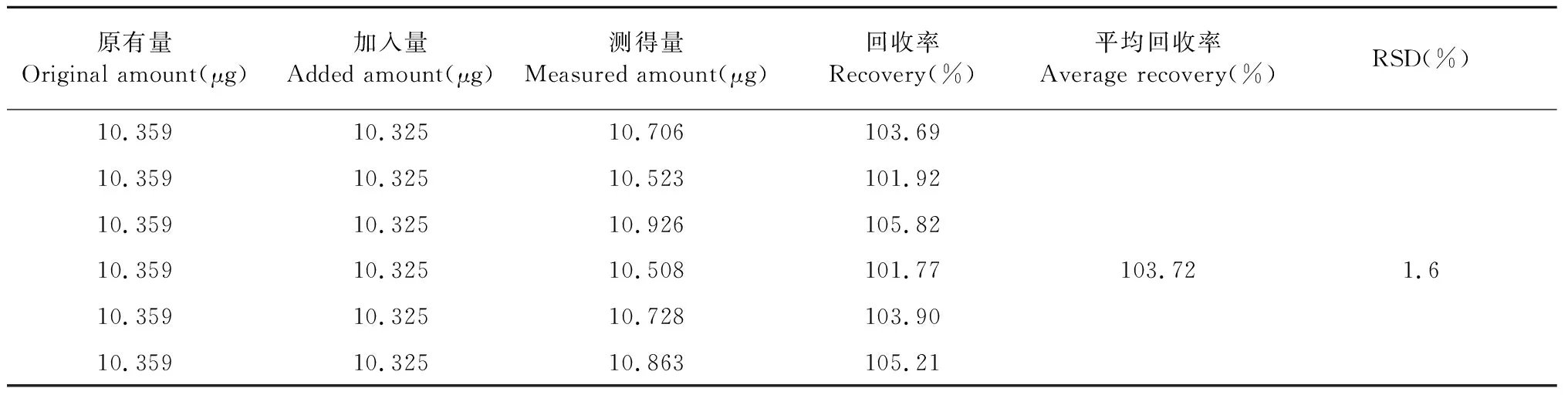
表3 加样回收率结果(n = 6)
3.3.7 样品测定结果
不同品种的荨麻根中荨麻醇苷含量有明显差异。所测定样品,麻叶荨麻根的含量明显高于其他品种。同一品种不同产地,荨麻醇苷的含量也有明显差异。荨麻科蝎子草属植物蝎子草Girardiniasuborbiculata在四川、云南等地亦作荨麻药用,但未检出荨麻醇苷(见表4)。结果表明荨麻醇苷可作为荨麻根质量评价的标志物。

表4 荨麻醇苷含量测定结果
4 讨论与结论
风湿关节炎、类风湿关节炎为常见疾病,其发病机理不清,现代研究表明多与炎症介质释放、补体过度激活、氧化应激损伤有关。荨麻根为常用民族药,在汉、藏、彝、苗、羌、土家、布依、维吾尔、瑶、傈僳、纳西族等11个民族药用,用于治疗风湿关节炎、类风湿关节炎,疗效确定,安全无毒。但其质量标志物研究未见报道。
荨麻根主要成分为1,7-裂环木脂素类成分。该类成分分布局限,是荨麻的特征性成分。其中,荨麻醇苷是荨麻的主要成分。本文根据荨麻根治疗风湿、类风湿的传统功效,对其进行了抗炎、抗补体、抗氧化等相关活性研究。结果发现荨麻醇苷具有显著的抗炎、抗氧化、抗补体,为荨麻根的主要活性成分及特征性成分,可以作为荨麻质量标志物。
在此基础上,本论文对其进行了较系统的波谱研究。首次对荨麻醇苷UV、IR、CD进行了研究,补充了相关波谱数据,考察了不同测试溶剂对NMR、UV的影响,发现不同溶剂对NMR、UV均有显著影响。
最后,论文对荨麻醇苷的HPLC测定方法进行了研究,建立的测定方法简便、快速、灵敏。不同品种、不同产地的荨麻根含量差异明显,结果进一步表明荨麻醇苷可以用于荨麻根的质量评价。
致谢:上海交通大学分析测试中心代博娜博士完成NMR测试。

