甘肃玉米镰孢茎腐病病原菌种群多样性分析
郭 成 王宝宝 王春明 张小杰 陈晓霞 周天旺 李敏权,2,* 段灿星
(1 甘肃省农业科学院植物保护研究所,甘肃 兰州 730070;2 甘肃农业大学草业学院,甘肃 兰州 730070;3 石家庄市农林科学研究院,河北 石家庄 050041;4 甘肃农业大学植物保护学院,甘肃 兰州 730070;5 中国农业科学院作物科学研究所,北京 100081)
玉米(ZeamaysL.)在许多国家是重要的粮、饲、经兼用型作物,在国民经济中占据着重要地位。然而病虫害是制约玉米高产和稳产的主要原因,我国玉米每年都会因病虫害导致减产大约1 000 万吨[1]。近年来,一种世界性的土传真菌性病害玉米茎腐病在黄淮海[2-5]、东北[6]、西南[7]和西北[8]等玉米产区均有发生和危害。自2011年起,甘肃省农业科学院植物保护研究所禾谷类病害研究室玉米病害课题组连续7年对甘肃玉米茎腐病进行系统调查,发现该病害在甘肃四大生态区(陇东地区、陇南地区、陇中地区和河西走廊)普遍发生且呈加重态势[8]。普通年份玉米茎腐病的田间病株率为5%~10%,严重发生年份为20%~30%,部分高感品种在40%以上,甚至高达100%[9]。同时,随着机械化水平的提高,籽粒直收成为玉米新的收获方向,茎腐病已成为严重阻碍玉米产业可持续发展的主要瓶颈。因此,该病害在国家玉米品种审定中被列为一票否决病害,也凸显出其重要性。
玉米茎腐病的致病菌种群结构和数量比较复杂,多达30余种,根据致病菌在属一级层面上的分类地位,可归纳成8种主要类型[8]。镰孢属(Fusarium)和腐霉属(Pythium)真菌为我国玉米茎腐病的两大主要致病菌,前者以禾谷镰孢(F.graminearum)、后者以肿囊腐霉(P.inflatum)为优势菌[10-11],两者均有占比高、分布广的特点。生态气候类型和耕作栽培模式不同,玉米茎腐病的病原菌种类呈现不同,刘树森等[2]以河北、河南和山东玉米茎腐病为研究对象,发现黄淮海夏玉米主产区茎腐病的病原镰孢菌高达11种,包括拟轮枝镰孢(F.verticillioides)、层出镰孢(F.proliferatum)、禾谷镰孢复合种(F.graminearumspecies complex, FGSC)、尖孢镰孢(F.oxysporum)、黄色镰孢(F.culmorum)、厚垣镰孢(F.chlamydosporum)、变红镰孢(F.incarnatum)、木贼镰孢(F.equiseti)、胶孢镰孢(F.subglutinans)、藤仓镰孢(F.fujikuroi)和茄病镰孢(F.solani),其中前3个为主要镰孢菌。许大凤等[3]研究发现安徽省凤阳县玉米茎腐病的病原菌有禾谷镰孢、拟轮枝镰孢、尖孢镰孢、层出镰孢和木贼镰孢。贺娟等[7]依据形态特征和核糖体内转录间隔区(rDNA-ITS)序列分析得出云南玉米茎腐病的致病菌种群由禾谷镰孢、拟轮枝镰孢、藤仓镰孢、变红镰孢、尖孢镰孢、层出镰孢、集群镰孢(F.commune)、厚垣镰孢和芳香镰孢(F.redolens)组成。
甘肃省目前尚缺乏对玉米镰孢茎腐病病原菌种群结构的系统研究,本研究通过采集甘肃省玉米茎腐病样品,对病原菌进行分离、鉴定和致病性测定,以期掌握甘肃省玉米镰孢茎腐病致病菌的结构和数量,为该病害的综合防控提供依据。
1 材料与方法
1.1 玉米茎基腐病分布范围调查和样品收集
于2015年9月和2017年9月在甘肃省10市(州)26县(区)采集到有明显发病症状的玉米茎腐病样品42份,采集地点见表1。

表1 玉米茎腐病样品采集地Table 1 Samples collection of maize stalk rot
1.2 样品分离和纯化
在样品病健交界处,用剪刀剪取约0.2 cm×0.5 cm大小的玉米茎秆及维管束组织,参考文献[12-13]进行分离、培养和纯化。
1.3 镰孢菌的单孢分离
参考文献[12]通过稀释法进行单孢分离,将分离物的孢子转移至马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基和康乃馨琼脂(carnation leaf-piece agar,CLA)培养基平板上,25℃下光暗交替培养10~30 d。
1.4 镰孢菌的种类鉴定
1.4.1 形态学及分子生物学鉴定 参考文献[14]进行镰孢菌的形态学比对和鉴定。
将所有镰孢菌菌株归类,利用上海生工生物工程技术服务有限责任公司一站式 DNA/RNA/蛋白提取试剂盒(B618003-0050)提取基因组DNA。镰孢菌种类通过特异性引物EF-1α[15]进行鉴别,TEF-F:5′-A T G G G T A A G G A R G A C A A G A C-3′;TEF-R:5′-G G A R G T A C C A G T S A T C A T G T T-3′,以25 μL反应体系[16]进行PCR扩增和测序。PCR扩增程序:94℃预变性4 min;94℃变性40 s,53℃退火40 s,72℃延伸1 min,35个循环;72℃延伸10 min。经1%琼脂糖凝胶电泳检测合格后,将PCR产物送至上海生工生物工程技术服务有限公司北京分公司进行测序。
1.4.2 系统发育树构建 将EF-1α基因序列结果测序结果与GenBank中已登录的镰孢菌序列进行Blast比对,除尖孢镰孢仅1株外,其他种各选取2个菌株为代表,利用Megalign7.1软件构建系统发育树。
1.5 菌株致病性测定
将灭菌后的蛭石装入直径10 cm×10 cm的花盆,每个花盆接种病原菌繁殖体10 g,病原菌的繁殖参考行业标准[17]。玉米品种选用甘宇301,为甘肃极早熟春玉米类型区的种植品种,高感茎腐病。先用75%酒精将甘宇301玉米种子表面消毒5 min,再经过温汤浸种处理,待出芽后播种在上述花盆,每种镰孢菌处理重复4次。材料置于常温条件下进行管理,需水时定量浇灭菌水,出苗后第20天记载发病情况,玉米幼苗胚根变褐,出现腐烂状或致死不发芽,即为发病株[18],计算发病株率。
2 结果与分析
2.1 镰孢菌种类及地域分布
本研究共获得253个镰孢菌菌株,经形态学鉴定出共10个种(图1),其中禾谷镰孢菌复合种、拟轮枝镰孢、木贼镰孢和胶孢镰孢在四大生态区均有分布,分离频率依次为59.3%、11.5%、10.3%和5.9%(图2,表2)。层出镰孢在陇南地区、陇东地区和河西走廊均有分布,分离频率为4.7%;变红镰孢在陇东地区、陇中地区和河西走廊分布,分离频率为4.0%;三线镰孢(F.tricinctum)在陇东地区崆峒区和陇中地区通渭县分离获得,分离频率为1.9%;温带镰孢(F.temperatum)分布于陇南地区张家川县,锐顶镰孢(F.acuminatum)分布于陇中地区通渭县,尖孢镰孢分布于陇东地区华池县,分离频率分别为1.2%、0.8%和0.4%。

表2 镰孢菌的地域分布Table 2 Geographical distribution of Fusarium species

注:A:禾谷镰孢;B:拟轮枝镰孢;C:木贼镰孢;D:胶孢镰孢;E:层出镰孢;F:变红镰孢;G:三线镰孢;H:温带镰孢;I:锐顶镰孢;J和K:尖孢镰孢。标尺表示100 μmNote:A: F. graminearum. B: F.verticillioides. C: F. equiseti. D: F. subglutinans. E: F. proliferatum. F: F. incarnatum. G: F. tricinctum. H: F. temperatum. I: F. acuminatum. J and K: F. oxysporum. The scale is 100 μm.图1 镰孢菌形态特征图Fig.1 Characteristics of Fusarium species
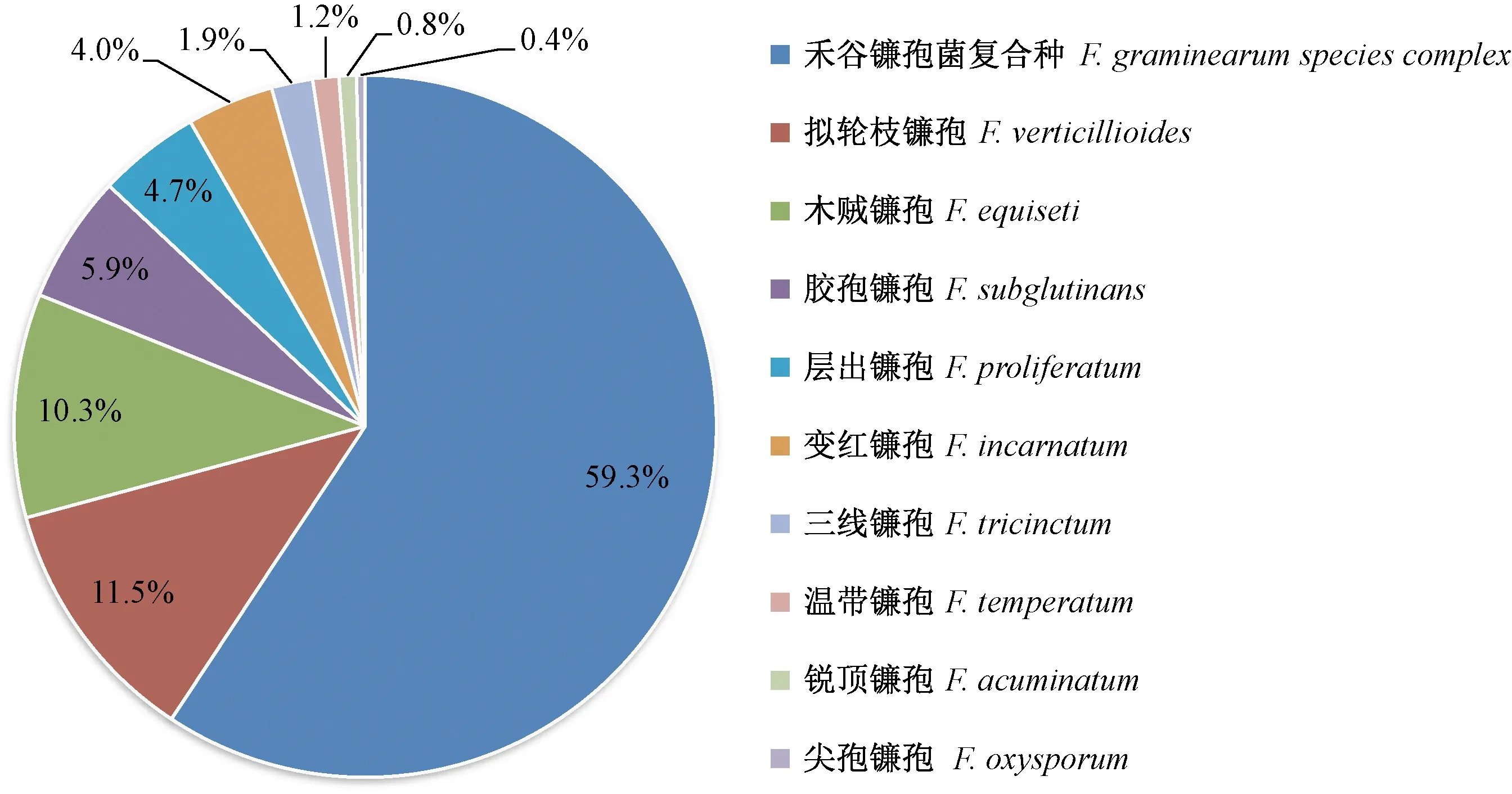
图2 镰孢菌种类和分离频率Fig.2 Fusarium species and separation frequency
2.2 EF1-α 序列分析
经对选取的19个菌株的测序结果在GenBank数据库与EF1-a序列相似度达99%以上的镰孢菌序列进行下载,采用邻接法(neighbor-joining, NJ)构建系统发育树(图3),以匍枝根霉(Rhizopusstolonifer)为外类群,茄病镰孢(Fusariumsolani)为内类群,发现TW30(登录号:MT827971)和ZY13-2(登录号:MT879692)与变红镰孢(登录号:JF270223、JF270200和GU116584)聚为一支;YJ8-1(登录号:MT879693)和ZY7-1(登录号:MT879694)与木贼镰孢(KT213320、KT213319和KT213315)聚为一支;HHXHZ15-7(登录号:MT879684)与布氏镰孢(MK896870、MH582231和KX269078)聚为一支;HCSZ4-9(登录号:MT879699)与禾谷镰孢(KY472207、KY472214和MG231090)聚为一支;KTQ16(登录号:MT879689)和KTQ19(登录号:MT879688)与三线镰孢(MG704914、MH093671和MG990939)聚为一支;TW26(登录号:MT879682)和TW40(登录号:MT879683)与锐顶镰孢(登录号:JX534391、KC175291和KC175292)聚为一支;HA-26(登录号:MT879697)和ZQDC13-3(登录号:MT879696)与层出镰孢(登录号:KM462980、KX681484和KM462938)聚为一支;HCSZ4-19(登录号:MT879698)与尖孢镰孢(JQ965444、JQ965441和MH341212)聚为一支;PC-14-1(登录号:MT879687)和ZY-2-2(登录号:MT879686)与拟轮枝镰孢(登录号:MG428708、MG734599和MG734598)聚为一支;ZJCZZC14-2(登录号:MT879691)和ZJCZZC14-5(登录号:MT879690)与温带镰孢(JX987072)聚为一支;ZY11-1(登录号:MT879695)和KTQ3-1(登录号:MT879685)与胶孢镰孢(JF270300、JF270234和KM462951)聚为一支。

图3 基于EF-1α建立的镰孢菌系统发育树Fig.3 Phylogenetic tree of Fusarium species based on EF-1α
2.3 禾谷镰孢复合种种间鉴定结果及地域分布
对分离得到的150株禾谷镰孢复合种通过镰孢菌特异性引物EF-1α扩增后进行测序和Blast比对,共获得2个种群,即布氏镰孢和禾谷镰孢,前者110株占73.3%,后者40株占24.7%,比例为2.75∶1,由此可见,布氏镰孢为FGSC的优势种群。分析发现,布氏镰孢在陇南山区、陇中地区、河西地区和陇东地区均有分布,分离频率分别占FGSC的100.0%、92.1%、89.5%和60.5%,禾谷镰孢除在陇南地区未见分布外,其在陇东地区、河西地区和陇中地区均有分布,分离频率分别占FGSC的39.5%、10.5%和8.9%。
2.4 致病性测定结果
致病性测定结果表明,11个菌株均能致病,发病株率为46.7%~100.0%,其中布氏镰孢和禾谷镰孢发病株率分别为93.3%和100.0%;拟轮枝镰孢、锐顶镰孢、木贼镰孢、三线镰孢、层出镰孢、变红镰孢、尖孢镰孢、胶孢镰孢的发病株率依次为66.7%、66.7%、73.3%、73.3%、80.0%、80.0%、80.0%和86.7%;温带镰孢的发病株率为46.7%。
3 讨论
玉米茎腐病也称青枯病,作为玉米生长后期发生的病害,其发生侵染和扩展过程都在植株体内进行,因而症状扩展较为隐蔽,一旦显症就无法进行防治,目前对该病害的主要防治措施以种植抗病品种和种子包衣处理为主,因此,开展病原学研究显得尤为重要。本研究将形态学鉴定和EF1-α序列分析进行联合比对,共获得10种镰孢菌,与郭满库等[19]研究发现甘肃玉米镰孢茎腐病病原种群为禾谷镰孢、黄色镰孢和拟轮枝镰孢相比较,本研究丰富了甘肃玉米茎腐病致病菌的种群和结构。研究结果同时表明FGSC和拟轮枝镰孢的分离频率相对较高,这与袁虹霞等[20]、贺娟等[7]和许大凤等[3]的研究结果相似,但与刘树森等[2]、孙静等[4]、范志业等[5]和刘可杰等[6]的研究结果存在差异。不同地区或同一地区玉米茎腐病病原菌的种群结构存在差异,这可能与主栽玉米品种、耕作模式及气候条件等诸多因素有关。
进一步分析发现,三线镰孢、锐顶镰孢、木贼镰孢、胶孢镰孢、层出镰孢、变红镰孢、尖孢镰孢和温带镰孢为甘肃玉米茎腐病的新病原。其中,三线镰孢和锐顶镰孢为温带地区土壤习居菌,前者寄主主要为禾本科植物,如小麦[14]、大麦[14,21-22]和禾本科牧草[23]等。后者寄主范围较广,主要分布在加拿大和欧洲的禾本类植物上,也可引起豆科植物穗腐病和根腐病[14]。二者作为玉米茎腐病新病原,鲜见相关报道。
FGSC因地域分布不同,对不同寄主造成病害的能力也不完全相同[24]。该复合种包括F.graminearum、F.gerlachii、F.louisianense、F.asiaticum、F.ussurianum、F.nepalense、F.vorosii、F.acaciae-mearnsii、F.aethiopicum、F.boothii、F.mesoamericanum、F.austroamericanum、F.cortaderiae、F.brasilicum和F.meridionale共15个种[25]。有研究表明,亚洲地区中,在年平均温度<15℃的北方地区,优势种群为F.graminearum;在年平均温度>15℃的南方地区,以F.asiaticum为优势种群[26-28]。甘肃气候类型多样,陇东地区、陇南地区、陇中地区和河西走廊年平均温度分别为7~10℃、9~15℃、5~9℃和4~9℃。四大生态区中年平均温度≤15℃,优势镰孢为布氏镰孢。该研究初步摸清了FGSC的种群结构和地理分布,这对该病害的田间预警体系构建、分区治理和抗病育种提供了技术支撑。
4 结论
本研究分析了甘肃玉米镰孢茎腐病致病菌的种群多样性,以及优势病原菌FGSC的种群结构和地域分布,为甘肃地区该病害的综合防控和抗病育种提供了科学依据。本研究随机选取不同种的代表性菌株进行了盆栽致病性测定,仅能说明10种镰孢菌均能引起玉米茎腐病,但镰孢种间菌株的致病力差异及禾谷镰孢复合种是否存在致病性分化等问题仍有待研究。另外,本研究仅针对镰孢茎腐病进行了病原菌的种群多样性研究,但腐霉茎腐病也不容忽视,其病原菌的种类和数量需要开展相关试验进行研究。

