内生真菌GG22诱导子对地黄毛状根生长和次生代谢的影响
朱畇昊 张梦佳 彭淑萍 董诚明,2,*
(1 河南中医药大学药学院,河南 郑州 450046;2 呼吸疾病中医药防治省部共建协同创新中心,河南 郑州 450046)
地黄(RehmanniaglutinosaLibosch.)为玄参科(Scrophulariaceae)多年生草本植物,主要以其新鲜或干燥块根入药[1],全国各地均有栽培,以怀地黄为佳。近年有研究发现,地黄的化学成分以萜类化合物中的环烯醚萜苷类为主,此外还含有糖类、氨基酸、微量元素以及脂肪酸等其他成分,具有强心利尿、抗炎解热、促进血液凝固和降低血糖等作用[2]。但由于连作障碍等原因,地黄的栽培品种退化严重,次生代谢产物含量也不稳定,药材的产量与质量得不到保证。因此,利用新技术手段提高活性产物含量,以及从分子水平探究地黄次生代谢产物合成通路,已成为地黄资源及活性产物的重要研究内容和新的发展方向。
毛状根(又称发状根)是整体植株或某一器官、组织(包括愈伤组织)、单个细胞,甚至原生质体受到发根农杆菌感染时产生的一种病理现象,主要是在感染部位或其附近产生大量的副产物——毛状根[3]。与药用植物植株相比,毛状根具有扩增迅速、容易培养、遗传稳定性强等优点;且正常培养条件下生长的毛状根新陈代谢活跃,能合成与原植物相同或相似的次生代谢产物[4],是一种优质的研究材料,近年来受到众多学者的关注。目前关于毛状根的研究主要集中于其在品种改良、药用植物次生代谢产物生产及基因功能研究等方面的应用[5-7]。
内生真菌存在于健康植株组织内部,不会对宿主植物造成明显伤害。最新研究发现内生真菌可以通过定殖于宿主植物根部,并产生分泌物来改善长期单一栽培土壤中的碳代谢和根际细菌群落,从而起到一定减轻土壤病的作用[8],这为内生真菌的应用研究提供了新的思路。地黄内生真菌GG22为河南省道地药材生态种植课题组前期从地黄块根中分离筛选出的内生真菌,属于镰刀菌属尖孢镰刀菌[9]。前期研究发现,将内生真菌GG22与地黄组培苗共培养后,会促进地黄组培苗的生长、显著增加次生代谢产物含量[10]。生物诱导子是指来源于微生物或动植物细胞的化合物,主要包括病原菌(真菌、细菌、病毒与酵母提取物)和细胞壁的分离物[11],目前应用最广、研究最多的是真菌类诱导子。有研究表明,真菌诱导子可通过诱导毛状根中某些基因表达量的变化[12]从而调节次生代谢产物生物合成途径中相关酶的活性, 最终诱导特定次生代谢产物的生成和积累[13-14],且内生真菌诱导子也能够对毛状根的生长起到一定的促进作用[15-16]。但关于地黄内生真菌诱导子对地黄毛状根作用的研究尚鲜见报道。
本试验以地黄毛状根为材料,通过添加不同浓度的内生真菌GG22诱导子溶液,研究其对地黄毛状根生长及次生代谢产物含量的影响,旨在为后期将内生真菌GG22诱导子用于工业化生产提供一定的理论依据和支撑。
1 材料与方法
1.1 试验材料
地黄促生内生真菌GG22菌株由河南中医药大学药学院生药学科组培实验室提供,经筛选后保存于4℃冰箱。地黄毛状根,由组织培养室前期诱导所得,培养于1/2 MS固体培养基中。
1.2 试验方法
1.2.1 诱导子溶液的制备及多糖浓度的测定 将地黄内生真菌GG22接种于马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基上活化3 d后,转移至PDA液体培养基中振摇培养3~4 d。取1 mL菌液接种至新的PDA液体培养基中,120 r·min-1、28℃摇床振摇培养2 d得到种子液[17]。抽滤收集GG22菌丝,用蒸馏水冲洗干净后研磨成泥状。称取研磨好的菌丝10 g置于150 mL锥形瓶中,加入蒸馏水,超声处理1 h,121℃高温灭菌30 min,离心所得上清液即为诱导子溶液[18]。
采用硫酸-苯酚法以无水葡萄糖为标准品绘制标准曲线,测定诱导子溶液中多糖的浓度,标准品溶液配置浓度如表1所示。

表1 标准品溶液的配制Table 1 Preparation of standard solution
精密称取无水葡萄糖标准品10 mg,溶解后定容于100 mL锥形瓶中,摇匀,配置成标准品溶液。根据表1加入显色剂,摇匀后放置室温显色20 min。以不加多糖溶液的空白组为参比,在485 nm波长下测定吸光度。以葡萄糖含量X为横坐标,吸光度Y为纵坐标绘制标准曲线,求得标准曲线方程为:Y=10.214 0X-0.000 7,R2=0.999 4。
诱导子多糖浓度的测定:取0.1 mL稀释10倍的诱导子溶液于具塞试管中,加入新配置的9%苯酚溶液1 mL及浓硫酸5 mL。摇匀后放置在室温下显色20 min,在485 nm波长下测定其吸光度平均值为0.51。根据标准曲线方程算得诱导子溶液的多糖浓度为500 mg·L-1。
1.2.2 地黄毛状根的培养及诱导处理 精密称取在1/2 MS固体培养基上黑暗培养[19]的地黄毛状根0.1 g,放入60 mL 1/2MS液体培养基中培养23 d后,将诱导子溶液加入液体培养基中,使液体培养基中多糖浓度分别为10、30、50和100 mg·L-1;以加入蒸馏水的处理组为对照组,每组设置3个重复。分别培养0、3、5、8、11 d后取样,洗净残留液体培养基,吸干多余水分,称取鲜重。50℃烘至恒重后称取干重。
1.2.3 总环烯醚萜苷含量测定 供试品溶液的制备参照曾令峰等[20]的方法。显色条件:取供试液1 mL于10 mL具塞试管中,加入70%乙醇1 mL。加入1 mol·L-1的盐酸溶液2 mL,摇匀,90℃水浴反应15 min,放冷。加二硝基苯肼乙醇试液0.5 mL摇匀,90℃水浴反应25 min,放冷。加入70%乙醇配置的3 mL 1 mol·L-1氢氧化钠,摇匀,室温下放置1 h。以等量的70%乙醇溶液为空白组,在463 nm处测定吸光度值。
1.2.4 毛蕊花糖苷含量测定 根据《中华人民共和国药典》(2015版一部)[1]地黄项下含量测定方法。采用1260型高效液相色谱仪(Agilent Technologies Inc., 美国)分析地黄毛状根中毛蕊花糖苷的含量在内生真菌GG22诱导子作用下的变化。色谱条件为:色谱柱:Aichrombond-AQ C18(5 μm,4.6 mm×250 mm);流动相:乙腈∶0.1%醋酸溶液(16∶84,v/v);检测波长:334 nm;流速:1 mL·min-1;进样量:20 μL。
1.2.5 数据处理 使用DPS数据处理系统对原始数据进行处理分析,采用Duncan新复极差法对试验数据进行统计分析。
1.2.6 变异系数权重法分析诱导子溶液对地黄毛状根的促生效果 具体计算步骤如下:
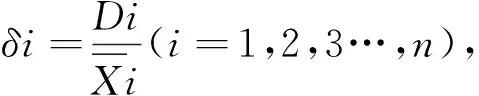
根据以上公式求得鲜重、干重、毛蕊花糖苷含量、总环烯醚萜苷含量的权重系数分别为0.182、0.169、0.214、0.435。将计算得到的权重系数带入,可得到以下公式,用以计算不同浓度诱导子溶液对地黄毛状根促生作用的综合得分:
F=0.182X鲜重+0.169X干重+0.214X毛蕊花糖苷+0.435X总环烯醚萜苷
2 结果与分析
2.1 菌株GG22诱导子对地黄毛状根生物量的影响
如图1所示,对照组地黄毛状根的生物量随着培养天数的增加呈现增长趋势,在第11天达到最高值。GG22诱导子溶液的多糖浓度为10 mg·L-1时,地黄毛状根生物量相比相同培养时间下的对照组均有提高,且随着共培养天数的增加,地黄毛状根生物量也不断增加并在第11天达到最高,此时地黄毛状根鲜重是相同培养时间下对照组的1.47倍,干重是相同培养时间下对照组的1.32倍。诱导子溶液多糖浓度为30 mg·L-1时,地黄毛状根生物量呈现先增加后降低的变化趋势,在第5天最高。诱导子溶液多糖浓度为50 mg·L-1时,地黄毛状根在第3、第8和第11天的生物量高于对照组;但在第5天时毛状根干重相较对照组无明显变化,鲜重较对照组略微降低。诱导子溶液多糖浓度为100 mg·L-1时,自第3天起试验组毛状根的生物量始终高于对照组,其干重随培养时间的增加呈递增趋势,11 d达最大值;鲜重的变化趋势与多糖浓度为50 mg·L-1的试验组一致。
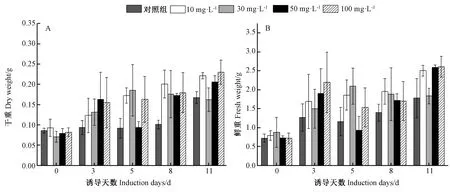
图1 GG22诱导子对地黄毛状根生物量的影响Fig.1 Effect of GG22 elicitor on biomass of hairy roots of Rehmannia glutinosa
2.2 菌株GG22诱导子对地黄毛状根总环烯醚萜苷含量的影响
如图2所示,不同浓度的GG22诱导子溶液对地黄毛状根中总环烯醚萜苷含量的积累均表现出一定的促进作用。对照组中总环烯醚萜苷的含量随着培养天数的增加逐渐增加。诱导子溶液的多糖浓度为100 mg·L-1时,与对照组相比,试验组在第3、第5和第8天时总环烯醚萜苷含量更高且随着培养天数的增加呈上升趋势,但在第11天时总环烯醚萜苷含量较对照组略微降低。诱导子溶液浓度为10 mg·L-1及50 mg·L-1时,随着培养天数的增加试验组总环烯醚萜苷含量逐步积累,在第11天时含量达到最高;诱导子溶液的多糖浓度为10 mg·L-1在第11天时总环烯醚萜苷含量为相同培养天数下对照组含量的1.5倍。诱导子溶液的多糖浓度为30 mg·L-1时,在第3和第5天总环烯醚萜苷含量变化不明显,但在第0~第3天有快速积累,且在第5天后也有快速积累,并在第11天时含量达到最高,在诱导子多糖浓度为30 mg·mL-1时,第11天总环烯醚萜苷的含量与对照组差异显著,较对照组增加约89%。

注:*表示差异显著(P<0.05)。下同。Note: * means significant difference at 0.05 level. The same as following.图2 GG22诱导子对毛状根中总环烯醚萜苷含量的影响Fig.2 Effect of GG22 elicitor on the contents of total iridoid glycosides in hairy roots
2.3 菌株GG22诱导子对地黄毛状根毛蕊花糖苷含量的影响
对照组毛蕊花糖苷的含量随着培养天数的增加呈现明显降低的趋势,而试验组的毛蕊花糖苷含量的变化趋势与空白对照组不同,且不同浓度诱导子对地黄毛状根中毛蕊花糖苷含量的积累有不同的影响。在共培养第3天时,诱导子溶液的多糖浓度为10、50和100 mg·L-1的试验组的毛状根中毛蕊花糖苷含量比对照组高,且诱导子溶液的多糖浓度为50 mg·L-1的试验组在培养第3天时毛蕊花糖苷含量最高,与对照组具有显著性差异,是对照组含量的1.5倍,而诱导子溶液的多糖浓度为30 mg·L-1时试验组的毛蕊花糖苷含量略低于对照组。诱导子溶液的多糖浓度为100 mg·L-1的试验组随着共培养天数的增加,毛蕊花糖苷的含量没有显著变化,与第0天相比,在共培养第3天其含量略有提高,随后略微下降并保持稳定。

图3 GG22诱导子对毛状根中毛蕊花糖苷含量的影响Fig.3 Effect of GG22 elicitor on the contents of verbascoside in hairy roots
2.4 不同浓度诱导子对地黄毛状根促生效果比较分析
本试验通过综合评分评价不同浓度诱导子对地黄毛状根的促生效果[21]。权重系数是综合评价的关键[22],以评价指标变异系数计算其权重系数,评价指标的变异系数越大,所赋的权重越大[23]。通过计算得到总环烯醚萜苷含量的权重系数最高为0.435,可知总环烯醚萜苷的含量在不同浓度诱导子对地黄毛状根促生作用的评价中具有重要意义。
综合得分结果显示(表2),加入诱导子的试验组的综合得分均比对照组高,表明内生真菌GG22诱导子对地黄毛状根的生物量及次生代谢产物含量有一定的促进作用,且以诱导子溶液的多糖浓度为50 mg·L-1,共培养11 d为最优诱导条件;诱导子溶液的多糖浓度为100 mg·L-1,共培养11天的试验组较优。

表2 不同浓度诱导子溶液对地黄毛状根促生作用综合得分Table 2 Comprehensive score of different concentrations of elicitor solution on promoting growth of R. glutinosa hairy root
3 讨论
3.1 地黄内生真菌GG22诱导子对地黄毛状根生长及次生代谢产物的影响
根据性质不同可将诱导子分为生物诱导子和非生物诱导子两类,而在生物诱导子中应用最广、研究最多的是真菌诱导子[24]。王瑜等[25]研究表明酵母提取物对王不留行毛状根的生长影响作用不明显,但能明显促进王不留行黄酮苷的产生。本研究发现GG22诱导子溶液对地黄毛状根的生物量及次生代谢产物含量有一定影响,一般表现为促进作用。在毛蕊花糖苷的含量的测定中发现,对照组毛蕊花糖苷含量随着培养天数的增加,呈现明显的下降趋势,推测可能为毛状根中的毛蕊花糖苷随着培养天数的增加,从毛状根浸出到液体培养基中。前人研究也发现在毛状根培养过程中,培养液中存在次生代谢产物的积累[26],后续需要进一步对液体培养基进行分析。在试验过程中还发现高效液相色谱仪检测的几组供试品中未出现与梓醇标准品相同保留时间的色谱峰。Piatczak等[27]分析地黄毛状根中有效成分的含量时,使用质谱法检测到了梓醇的存在。这可能是由于检测器不灵敏或梓醇含量过少;也可能是地黄毛状根在内生真菌GG22诱导子的作用下促进了一些特定酶的表达,使毛状根中总环烯醚萜苷更多转化为其他环烯醚萜苷类物质,较少转化为梓醇。
3.2 地黄毛状根与真菌诱导子共培养的培养条件的优化选择
齐香君等[28]研究发现黑曲霉诱导子在培养液中质量浓度为40 mg·L-1时,黄芩苷的含量最高,但随着培养液质量浓度的增加,对毛状根的生长呈抑制状态。但明乾良[18]研究发现丹参毛状根对D16诱导子溶液有一个短暂的适应期,在适应期内高浓度诱导子溶液表现出一定的抑制作用,在适应期后则表现出对丹参毛状根生物量的促进作用。由此可见,随着浓度和共培养天数的增加,部分真菌诱导子并不表现出特定的诱导规律,真菌诱导子能够起到促进作用所需的浓度根据内生真菌种类及毛状根种类的不同而有所变化[29-30],因此需要通过进一步的研究来确定某一种真菌诱导子最适的浓度及培养天数。本试验通过变异系数权重法来分析不同多糖浓度的内生真菌GG22诱导子溶液在诱导不同的时间后对地黄毛状根的作用效果。发现使用多糖浓度为50 mg·L-1的地黄内生真菌GG22诱导子,共培养11 d 时对于地黄毛状根的生长及次生代谢产物积累的促进效果最好。
4 结论
本试验以地黄毛状根为试验材料,通过制备GG22菌丝水溶性提取物作为诱导子的方法,研究不同GG22诱导子溶液多糖浓度在不同诱导天数下对地黄毛状根生长及次生代谢产物的影响。结果表明,加入诱导子溶液对于地黄毛状根的生物量及总环烯醚萜苷、毛蕊花糖苷含量的积累有一定的促进作用,且通过变异系数权重法分析综合得分,得出最适宜诱导条件为诱导子多糖浓度为50 mg·L-1,共培养11 d。本研究为进一步研究内生真菌GG22诱导子对地黄毛状根中次生代谢产物合成相关基因表达的影响提供了一定的基础。

