浙贝母淀粉、蔗糖代谢相关基因的克隆与表达分析
李梓铭 泮仪晨 范小平 江建铭 王志安 王忠华,*
(1 浙江万里学院生物技术研究所,浙江 宁波 315100;2 浙江省中药研究所有限公司,浙江 杭州 310023)
浙贝母为百合科贝母属多年生草本植物,其鳞茎中所含甾体类生物碱贝母甲素和贝母乙素具有非常广泛的生物学活性[1],可清热润肺、解毒散结。每年3—5月份为浙贝母鳞茎发育时期,此期间鳞茎随时间推移迅速膨大,鳞茎大小是衡量浙贝母是否成熟的主要标志。鳞茎的品质直接决定浙贝母的药用功效及市场价值,所以获取高品质的浙贝母鳞茎是当今浙贝母产业的关注焦点。民间常施加钾肥促进鳞茎发育,宋健琴[2]发现释放钾肥可有效提升浙贝母鳞茎中碳物质的积累,从而推断浙贝母鳞茎的发育与其他鳞茎类植物类似,伴随着碳水化合物的积累,鳞茎逐渐膨大[3]。碳水化合物含量对鳞茎发育影响的研究屡见不鲜,尤其是可溶性糖及淀粉等。例如在百合[4]、唐菖蒲[5]、郁金香[6]、石蒜[7]、水仙[8]中发现,糖含量的变化影响着鳞茎的休眠及发育。植物中常见可溶性糖为果糖、葡糖糖、蔗糖,其中蔗糖是植物中糖的主要可运输形式,其主要在光合组织的细胞质中被合成后运输到非光合作用组织中[9]。高等植物中蔗糖的合成与众多酶密切相关,其中蔗糖合成酶(sucrose synthase,SS)和蔗糖磷酸合成酶(sucrose phosphatesynthase,SPS)是蔗糖调节合成中的关键酶[10-11]。SS是一种胞质酶,可促使蔗糖进入各种代谢途径,催化如下可逆反应[12]:蔗糖+二磷酸尿苷(uridine diphosphate,UDP)-果糖+尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)。SS酶可调动蔗糖参与调节植物生长过程,为淀粉合成提供底物及能量[13]。SPS活性直接反映了植物体内蔗糖合成的能力[14-15],可通过降低SPS活性减少其同化物向蔗糖的分配,从而降低蔗糖合成的效率[16]。
淀粉是植物体中碳水化合物的主要储存形式,主要储存于块根、块茎、鳞茎、种子中,在鳞茎类植物发育过程中提供大量能源,夏宜平等[17]通过放射性同位素14C法和扫描电镜探测到淀粉颗粒的数量随郁金香鳞茎的发育快速增加,百合[18]中也有通过类似结果,在马铃薯种植中也有通过释放膨大剂增加块茎中淀粉含量进而增加产量的方法。由于植物生长发育周期较长,近年研究中常使用分子手段干预淀粉合成[19]。淀粉合成通路中腺苷二磷酸葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase,AGP)作为限速酶,参与淀粉合成的第一步反应,颗粒结合淀粉合酶[20](granule-bound starch synthase,GBSS)参与直链淀粉合成,可溶性淀粉合酶[21](soluble starch synthase,SSS)和淀粉分支酶[22](starch branching enzyme,SBE)协作合成支链淀粉。
目前关于浙贝母蔗糖、淀粉代谢调控基因的研究较少。本研究通过克隆8条淀粉、蔗糖代谢相关基因,并对其开展不同组织及发育期基因表达量分析,推测各基因在浙贝母鳞茎淀粉、蔗糖代谢中的作用,以期为浙贝母分子调控技术提供理论基础。
1 材料与方法
1.1 试验材料
选择浙贝3号的根、茎、叶、鳞茎为试验材料,于2019年3—5月采自浙东宁波章水浙贝母基地,每隔20 d 取样一次,共5次。样品获得后用无菌水进行清洗,吸水纸擦净后放入液氮中速冻,贮存于-80℃超低温冰箱。
1.2 发育期鳞茎性状测量
使用游标卡尺、天平测量鳞茎的直径、质量。
1.3 可溶性总糖,蔗糖、淀粉含量测定
使用优化的蒽酮[23]法测量可溶性总糖含量。使用淀粉测试盒(A148-1-1, 南京建成生物工程研究所)测量淀粉含量;使用高效液相法(high performance liquid chromatography, HPLC)测定蔗糖含量;参照刘欣等[24]的方法,色谱柱为ACQUITY UPLC BEHAmide,2.1 mm×100 mm,l.7 μm(美国沃特世公司),流动相为75%乙腈(内含0.2%三乙胺),流速0.2 mL·min-1,柱温35℃,进样量5 μL,所用标样为色谱纯级蔗糖。
1.4 总RNA提取质量与产率检测
使用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,北京),参考试剂盒说明方法提取总RNA。使用NanoDropTM2000微型分光光度计(上海美谱达仪器有限公司)测定所提取RNA浓度以及吸光度比值(A260/280和A260/230),取1 μL RNA溶液与 5 μL 6×RNA Loading Buffer混匀,通过1.2%琼脂糖凝胶电泳检测。
1.5 引物设计及5′/3′序列克隆
选取GenBank中已注册物种序列进行多序列比对,通过Primer软件设计上下游克隆所需基因保守端序列,使用 Oligo软件设计5′/3′引物并通过Clontech SMARTer RACE 5′/3′试剂盒[Code No.634858, 宝日医生物技术(北京)有限公司]获取5′/3′序列,引物见表1,其中各基因5′/3′引物为该基因5′/3′端RACE引物,F-,R-引物为该基因保守区上下游引物。

表1 浙贝母淀粉、蔗糖代谢相关基因克隆引物Table 1 Cloning primers of ORF region of starch and sucrose metabolism-related genes of F. thunbergii
1.6 荧光引物设计
根据已克隆出的浙贝母淀粉、蔗糖代谢相关基因序列,使用Primer软件设计荧光引物见表2,试验所用引物均由北京擎科公司合成。

表2 浙贝母淀粉、蔗糖代谢相关基因荧光引物Table 2 Fluorescent primers for genes related to starch and sucrose metabolism in F. thunbergii
1.7 淀粉、蔗糖合成基因的克隆及序列分析
首先通过NCBI进行同源序列比对并设计保守端引物,按照RNAprep Pure Plant Kit[DP432, 天根生化科技(北京)有限公司]说明书操作提取浙贝母鳞茎中的总RNA,使用SuperRT cDNA Synthesis Kit [CW0741, 北京康为生物科技有限公司]反转录合成cDNA,以该cDNA为模板,各基因保守端上下游引物进行PCR扩增,50 μL反应体系为:2×EasyTaq PCR SuperMix[AS111, 北京全式金生物技术有限公司]25 μL、ddH2O 19 μL、cDNA模板2 μL、上下游引物各2 μL。PCR反应条件为:94℃预变性2 min,94℃变性30 s,55.2℃退火30 s,72℃延伸1 min,35 个循环; 72℃延伸4 min。按照Clontech SMARTer RACE 5′/3′试剂盒,说明书分别反转录合成5′-RACE cDNA和3′-RACE cDNA,以各基因5′/3′引物进行PCR扩增,50 μL反应体系:Buffer 25 μL、ddH2O 15.5 μL、UPM引物5 μL、5′/3′引物1 μL、5′-RACE/3′-RACE cDNA模板2.5 μL、DNA聚合酶1 μL。PCR反应条件为:94℃变性30 s, 72℃ 延伸2 min,5 个循环;94℃变性30 s,70℃退火30 s,72℃延伸2 min,5个循环;94℃变性30 s,68℃退火30 s,72℃延伸2 min,25个循环,其中UPM通用引物序列为5′-C T A A T A C G A C T C A C T A T A G G G C A A G C A G T G G T A T C A A C G C A G-3′。使用(EasyPure® Quick Gel Extraction Kit(EG101, 北京全式金生物技术有限公司),回收目的片段,PMD 18-T载体(Code No.6011, 宝日医生物技术(北京)有限公司)进行连接,将重组载体转入到大肠杆菌感受态细胞DH5α[CB101, 天根生化科技(北京)有限公司]中,操作步骤均按说明书进行。将转化后的大肠杆菌涂布在含有氨苄的LB(luria-bertani)培养基上,37℃培养16 h,然后筛选阳性克隆,接种于含氨苄的LB液体培养基中震荡培养5 h,菌液交由北京北京擎科生物科技有限公司进行重组载体测序,测得的重组载体序列减去空载体序列即可得插入的目的DNA片段序列。对测序结果进行拼接并进行全长分析及生物信息学分析,通过NCBI网站上的BLAST进行序列同源性比较。通过DNAMAN进行氨基酸序列同源性分析,使用NCBI网站上的Orf Finder进行基因序列的开放阅读框预测、ProtParam预测蛋白质的理化性质、ProtComp进行亚细胞定位预测、TMHMM进行跨膜区进行预测、SignalP-5.0进行信号肽预测并使用CDD Search 进行保守结构域预测。
1.8 淀粉、蔗糖合成基因荧光表达量及相关性分析
以幼苗至成熟期鳞茎,盛花期根、茎、叶、鳞茎为模板,表2中上下游引物为荧光引物,使用Bio-RAD CFX96(美国伯乐公司)进行实时荧光定量PCR(real-time quantitative PCR, qRT-PCR),选择β-Actin[25]为内参基因。反应体系共20 μL:启动酶TransStart® Tip Green qPCR SuperMix(AQ141,北京全式金生物技术有限公司)10 μL,上、下游引物以及DNA模板各0.4 μL,无菌水8.8 μL。扩增程序为:94℃预变性30 s,94℃变性5 s,60℃退火30 s,共40个循环;qRT-PCR结果使用BIO软件直接进行分析。
1.9 数据分析
使用SPSS 24.0软件进行相关性分析。
2 结果与分析
2.1 鳞茎性状测量
如图1所示,浙贝母鳞茎随时间推移逐渐增大,鳞茎从幼苗期至成熟期共需经历80 d,每20 d取样一次,直径依次为2.0、2.8、3.5、4.0、4.5 cm,质量依次为3、10、14、21、45 g,两项性状指标均在80 d时达到最高。

图1 发育期浙贝母鳞茎性状变化Fig.1 Changes in bulb traits of F. thunbergii during development
2.2 可溶性糖、蔗糖、淀粉含量测定
可溶性总糖、蔗糖、淀粉含量如图2所示。淀粉含量随着鳞茎发育逐渐上升,80 d达到最高值(23.6%),蔗糖与可溶性总糖变化趋势相同,皆为下降-上升-下降,分别在0 d和60 d达到最大。
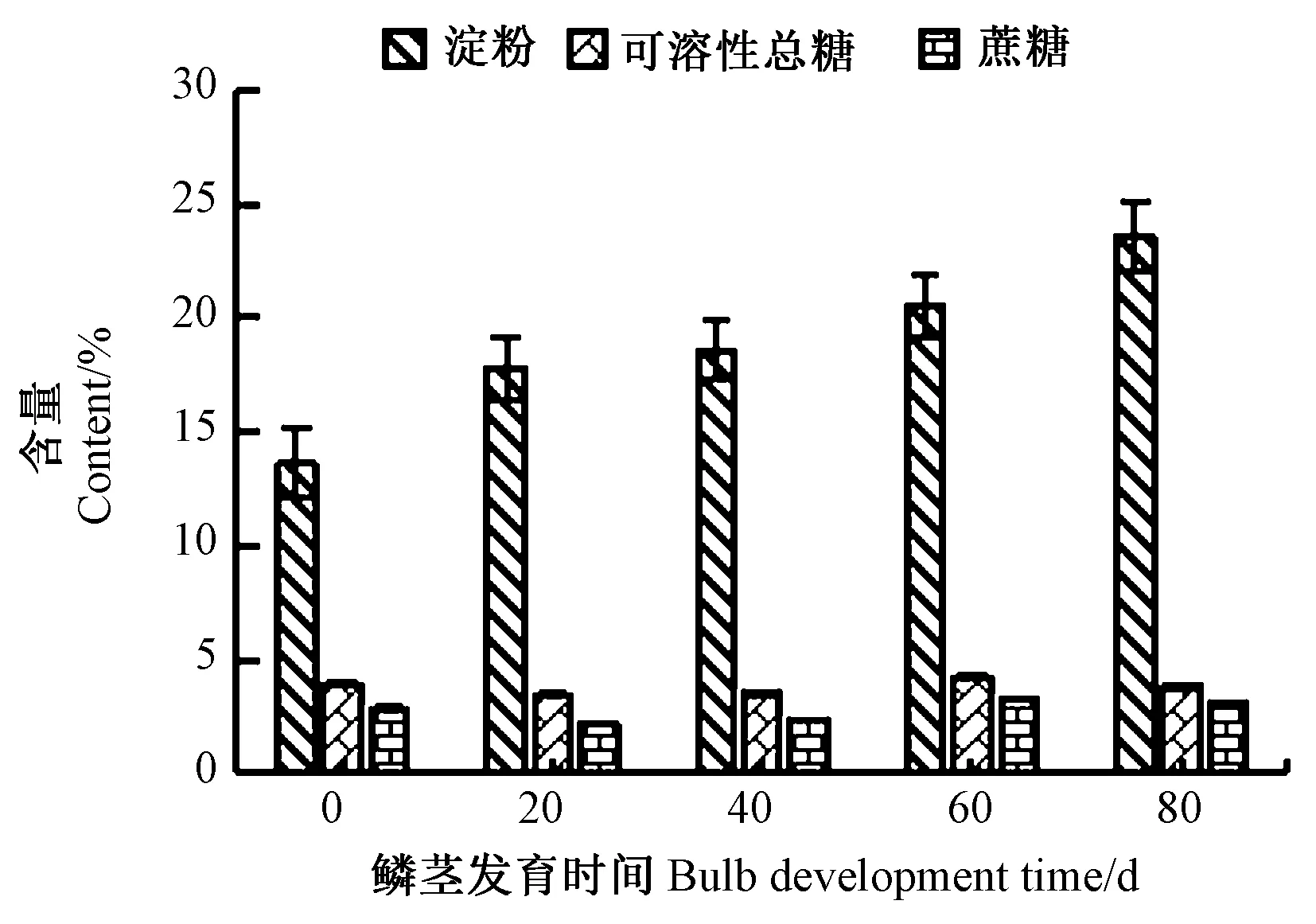
图2 不同时期浙贝母鳞茎中可溶性总糖、蔗糖、淀粉含量Fig.2 The total soluble sugar, sucrose and starch content in bulbs of F. thunbergii in different periods
2.3 总RNA的提取
浙贝母总RNA的琼脂糖凝胶电泳结果如图3,可清晰地看到2条RNA条带(28S和18S)其中28S条带亮度大约是18S的2倍,说明总RNA具有较好的完整性,可用于下一步试验。

图3 浙贝母总RNA琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis of total RNA of F. thunbergii
2.4 淀粉、蔗糖代谢相关基因序列克隆
以浙贝母鳞茎cDNA为模版,使用同源克隆和5′、3′-RACE末端克隆法对AGP1、AGP2、AGP3、GBSS、SSS、SBE、SS、SPS基因全长进行克隆,如图4所示,AGP15′端约750 bp、保守端约1 000 bp、3′端约1 000 bp;AGP2 5′端约500 bp、保守端约900 bp、3′端约500 bp;AGP3 5′端约500 bp、保守端约1 000 bp、3′端约1 200 bp;SSS5′端约500 bp、保守端约3 000 bp、3′端约1 000 bp;GBSS5′端约750 bp、保守端约500 bp、3′端约600 bp;SBE5′端约300 bp、保守端约1 500 bp、3′端约2 000 bp;SS5′端约1 200 bp、保守端约2 000 bp、 3′端约750 bp;SPS5′端约1 500 bp、保守端约1 000 bp、 3′端约2 000 bp。

注:A为5′端;B为保守端;C为3′端;M1为Marker2000;M2为Marker2000Plus;M3为Marker5000;Ⅰ为样品。Note: A is part 5′. B is conservative part. C is part 3′. M1 is Marker2000. M2 is Marker2000plus. M3 is Marker5000 and Ⅰ is sample.图4 浙贝母鳞茎中淀粉、蔗糖代谢相关基因琼脂凝胶电泳Fig.4 Agarose gel electrophoresis of genes related to starch and sucrose metabolism in bulbs of F. thunbergii
2.5 蔗糖、淀粉代谢基因全长及生物信息学分析
AGP1基因全长1 936 bp,氨基酸序列与兰州百合(Liliumdavidii)(AJG44462.1)、龙舌兰(Agavetequilana)(QED40916.1)、芦笋(Asparagusofficinalis)(XP_020251522.1)、 博落回(Macleayacordata)(OVA08754.1)、白杨(Populusalba)(XP_034919752.1)、胡杨(Populuseuphratica)(XP_011028874.1)、毛果杨(Populustrichocarpa)(XP_002300758.1)以及无油樟(Amborellatrichopoda)(ERM94645.1)AGPase氨基酸全长或部分序列一致性分别达到95%、76%、80%、79%、78%、78%、78%和75%。AGP1基因包含一个完整的开放阅读框,长度1 539 bp,编码513个氨基酸。理论pI为7.55,属碱性蛋白;不稳定系数39.05,为稳定蛋白;疏水性-0.135,为亲水蛋白;亚细胞定位在叶绿体中,不存在跨膜区,属于非跨膜蛋白;不存在信号肽,属于分泌性蛋白;保守结构域预测为cd02508,属于cl11394(Glyco_tranf_GTA_type)超家族,该结构域代表ADP-葡萄糖焦磷酸化酶。
AGP2基因全长1 898 bp,氨基酸与杂种百合(Liliumhybrid)(AQZ41944.1)、龙牙百合(Liliumbrownii)(QFV20493.1)、芦笋(XP_020273691.1)、紫苏(Perillafrutescens)(AAF66434.1)、胡杨(XP_011008185.1)、黄连木(Pistaciavera)(XP_031283997.1)、温州柑橘(Citrusunshiu)(GAY55156.1)、葡萄(Vitisvinifera)(XP_002263255.1)AGPase氨基酸全长或部分序列一致性分别达到96%、95%、90%、88%、90%、91%、91%和90%。AGP2基因包含一个完整开放阅读框,长度1 539 bp, 编码513个氨基酸。理论pI为6.06,属碱性蛋白;不稳定系数38.71,为稳定蛋白;疏水性-0.126,为亲水蛋白;亚细胞定位在叶绿体中,不存在跨膜区,属于非跨膜蛋白;不存在信号肽,属于非分泌性蛋白;保守结构域预测为cd02508,属于cl11394(Glyco_tranf_GTA_type)超家族,该结构域代表ADP-葡萄糖焦磷酸化酶。
AGP3基因全长2 152 bp,氨基酸与兰州百合(AJG44463.1)、海枣(Phoenixdactylifera)(XP_008800701.1)、油棕(Elaeisguineensis)(XP_019701499.1)、芭蕉(Musaacuminata)(XP_009416548.1)、芦笋(XP_020249339.1)、凤梨(Ananascomosusce)(XP_020106094.1)、唐菖蒲(Gladiolushybrid)(AIO11223.1)、龙舌兰(QED40916.1)AGPase氨基酸全长或部分序列一致性分别达93%、77%、77%、76%、76%、74%、76%和78%。AGP3基因包含一个完整开放阅读框,长度1 554 bp,编码518个氨基酸。理论pI为7.00,属中性蛋白;不稳定系数32.89,为稳定蛋白;疏水性-0.175,为亲水蛋白;亚细胞定位在叶绿体中,不存在跨膜区,属于非跨膜蛋白;不存在信号肽,属于非分泌性蛋白;保守结构域预测为cd02508,属于cl11394(Glyco_tranf_GTA_type)超家族,该结构域代表ADP-葡萄糖焦磷酸化酶。
SSS基因全长3 843 bp,氨基酸与杂种百合(AVZ24768.2)、油棕(XP_010909122.1)、板栗(Castaneamollissimace)(KAF3967760.1)、芦笋(XP_020268802.1)、云杉(Quercuslobata)(XP_030968629.1)、酸枣(Ziziphusjujuba)(XP_024927563.1)、欧洲栓皮栎(Quercussuber)(XP_023887385.1)SSS氨基酸全长或部分序列一致性分别达到90%、66%、63%、61%、62%、62%和62%。SSS基因包含一个完整的开放阅读框,长度3 531 bp,编码1 177个氨基酸。理论pI为5.55,属酸性蛋白;不稳定系数42.30,为不稳定蛋白;疏水性-0.507,为亲水蛋白;亚细胞定位在细胞外,不存在跨膜区,属于非跨膜蛋白;不存在信号肽,属于非分泌性蛋白;保守结构域预测为cd03791,属于cl10013(Glycosyltransferase_GTB-type)超家族,该结构域代表淀粉合成酶。
GBSS基因全长2 003 bp,氨基酸与杂种百合(AVZ24769.2)、川百合(Liliumdavidii)(AJG44453.1)、海枣(XP_008775302.1)耧斗菜(Aquilegiacoerulea)(PIA34528.1)、油棕(XP_010940833.1)、唐松草(Thalictrumthalictroides)(KAF5206692.1)、芭蕉(XP_009415991.1)、龙舌兰(QED40917.1)GBSS氨基酸全长或部分序列一致性分别达到90%、90%、71%、68%、69%、68%、69%和69%。GBSS基因包含一个完整的开放阅读框,长度1 833 bp, 编码611个氨基酸。理论pI为5.51,属酸性蛋白;不稳定系数31.07,为稳定蛋白;疏水性-0.107,为亲水蛋白;亚细胞定位在细胞外,不存在跨膜区,属于非跨膜蛋白;不存在信号肽,属于非分泌性蛋白;保守结构域预测为cd03791,属于cl10013(Glycosyltransferase_GTB-type)超家族,该结构域代表淀粉合成酶SBE基因全长2 878 bp,氨基酸与兰州百合(AJG44456.1)、油棕(XP_010940323.1)、芦笋(XP_020244979.1)、凤梨(XP_020112024.1)、龙舌兰(QED40919.1)、博落会(OVA05948.1)、蓝果树(Nyssasinensis)(KAA8516686.1)、水芙蓉(Nelumbonucifera)(XP_010243937.2)SBE氨基酸全长或部分序列一致性分别达到94%、77%、77%、77%、77%、76%、74%和76%。SBE基因包含一个完整的开放阅读框,长度2 493 bp, 编码831个氨基酸。理论pI为5.59,属酸性蛋白;不稳定系数35.39,为稳定蛋白;疏水性-0.405, 为亲水蛋白;亚细胞定位在叶绿体中,不存在跨膜区,属于非跨膜蛋白;不存在信号肽,属于非分泌性蛋白;保守结构域预测为cd02854,属于cl28984(Eset)超家族,该结构域代表淀粉分支酶。
SS基因全长2 849 bp,氨基酸与川百合(AGW23638.1)、郁金香(Tulipagesner)(Q41607.1)、深圳拟兰(Apostasiashenzhenica)(PKA64018.1)、白及(Bletillastriata)(ANW09660.1)、油棕(XP_010939862.1)、蝴蝶兰(Phalaenopsisequestris)(XP_020587352.1)海枣(XP_008800466.1)SS氨基酸全长或部分序列一致性分别达到98%、94%、88%、89%、88%、88%和88%。SS基因包含一个完整的开放阅读框,长度1 959 bp,编码653个氨基酸。理论pI为5.69,属酸性蛋白;不稳定系数32.48,为稳定蛋白;疏水性-0.213,为亲水蛋白;亚细胞定位在细胞核中,不存在跨膜区,属于非跨膜蛋白;不存在信号肽,属于非分泌性蛋白;保守结构域预测为pfam00862,属cl10013(Glycosyltransferase_GTB-type)超家族,该结构域代表蔗糖合成酶。
SPS基因全长3 501 bp,氨基酸与兰州百合(AJG44459.1)、油棕(XP_010927691.1)、海枣(XP_008794597.1)、凤梨(OAY76704.1)、芭蕉(THU72924.1)、芦笋(XP_020260962.1)、睡莲(Nymphaeacolorata)(XP_031476251.1)SPS氨基酸全长或部分序列一致性分别达到96%、84%、83%、83%、80%、80%、79%和79%。SPS基因包含一个完整的开放阅读框,长度3 243 bp,编码1 081个氨基酸。理论pI为6.18,属酸性蛋白;不稳定系数43.30,为不稳定蛋白;疏水性-0.438,为亲水蛋白;亚细胞定位在细胞质中,不存在跨膜区,属于非跨膜蛋白;不存在信号肽,属于非分泌性蛋白;保守结构域预测为cd03800,属于cl10013(Glycosyltransferase_GTB-type)超家族,该结构域代表蔗糖磷酸合成酶。
2.6 淀粉、蔗糖合成相关基因不同部位表达量分析
采用qRT-PCR法检测蔗糖合成相关基因在浙贝母不同部位的表达量,结果见图5,其中AGP1基因在根中表达量最高,AGP2、AGP3、GBSS和SSS在鳞茎中的表达量最高。SBE基因在叶片中的表达量最高。SS在鳞茎中表达量最高,SPS在叶片中表达量最高。

图5 不同部位浙贝母淀粉、蔗糖代谢基因表达量Fig.5 Starch and sucrose metabolism gene expression levels of F. thunbergii in different parts
2.7 淀粉、蔗糖合成相关基因不同发育时间表达量分析
由图6可知,除AGP3在40 d时表达量稍有降低外,AGP1、AGP2、AGP3表达量都随着鳞茎发育而逐渐增加并在80 d达到最大值,AGP2在鳞茎发育过程表达量增加最为明显。GBSS和SSS在鳞茎中的变化趋势基本一致,均在60 d达到最大值。SBE在鳞茎发育初期和末期表达量较高,中间时期则较低且平稳。SS、SPS基因表达量均在60 d达到最高值。

图6 不同发育阶段浙贝母淀粉、蔗糖代谢基因表达量Fig.6 Starch and sucrose metabolism gene expression levels of F. thunbergii in different periods
2.8 浙贝母淀粉、蔗糖含量与相关代谢基因相关性分析
采用SPSS 24.0软件对淀粉、蔗糖代谢基因表达量与淀粉、蔗糖含量进行相关性分析,结果如表3、表4所示。其中浙贝母鳞茎中3条AGP基因表达量均与淀粉含量呈极显著正相关,GBSS、SSS基因表达量与淀粉含量呈显著正相关,SBE表达量与淀粉含量不具有相关性,SS、SPS基因表达量与蔗糖含量呈显著正相关。
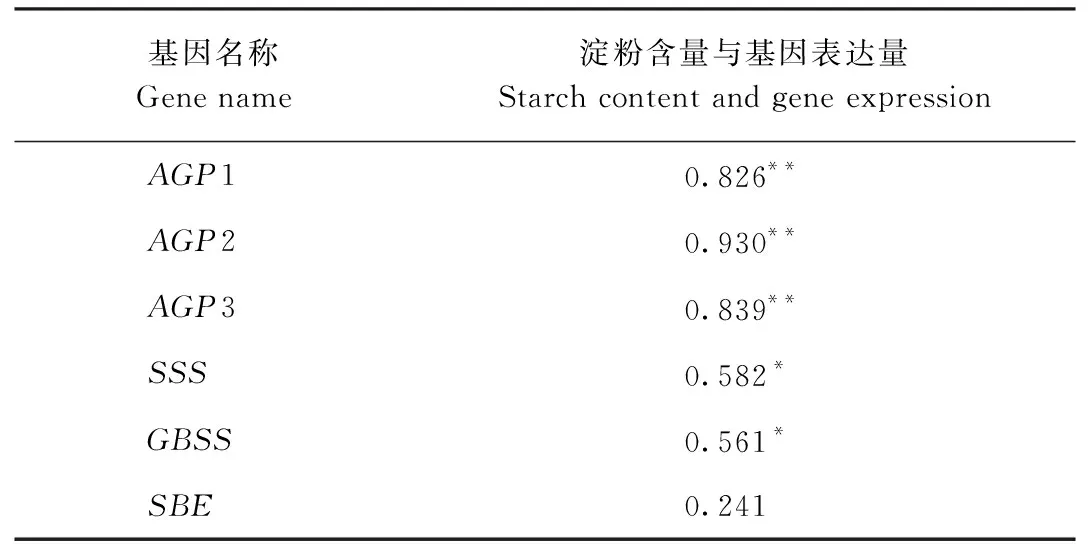
表3 浙贝母淀粉含量与相关代谢基因表达量的相关性分析Table 3 Correlation analysis between starch content and the expression of related metabolic genes of F.thumbergii
3 讨论
碳水化合物作为植物体中主要储能及供能物质,对植物发育至关重要。多项研究发现[3-8],碳水化合物可促进鳞茎类植物鳞茎发育,也可影响鳞茎类植物解除休眠,因此,了解碳水化合物在鳞茎的动态变化,对鳞茎类植物的生长发育具有重要作用。本试验发现,鳞茎发育过程中淀粉、蔗糖为浙贝母鳞茎发育的主要影响因素。淀粉、蔗糖代谢与途径中的多种酶密切相关,研究相关基因可为使用基因工程调控淀粉、蔗糖含量从而促进浙贝母鳞茎膨大的后续研究提供理论基础。
蔗糖作为光合作用的主要产物,支持着植物的生长和发育[26]。植物中蔗糖合成主要受SS、SPS、INV三类酶影响。SS酶作为一个双向酶,既可合成蔗糖,也可将蔗糖分解为葡萄糖和果糖[27],浙贝母中SS基因在鳞茎中表达量明显高于其他部位,这与其在牛大力[27]、白及[28]、木薯[29]在块茎中表达量最高的结果一致,甜菜[30]中SS基因在根部大量表达,柑橘[31]中SS基因高表达部位为果汁囊,以上结果说明SS基因主要在蔗糖积累部位高表达。浙贝母鳞茎中SS基因的表达量与蔗糖含量变化一致,为初期降低、中期升高、末期降低,推测原因可能为浙贝母鳞茎发育初期新老鳞茎营养转化,鳞茎的主要积累成分为淀粉,蔗糖合成速率较低,糖类配合淀粉合成促使鳞茎迅速膨大;发育中期鳞茎发育趋势平稳,蔗糖淀粉共同增加,此时SS主要行使蔗糖合成功能;末期植株发育基本停滞,鳞茎为进入休眠期储存能量,SS则行使蔗糖分解功能,分解蔗糖为葡萄糖并输送至淀粉体用于淀粉合成。Liu 等[32]通过转录因子ERF72影响木薯块茎中SS基因表达进而调控淀粉积累,以及Fan等[33]通过超表达SS基因提高水稻中淀粉积累,都证明了SS基因可分解蔗糖,从而为淀粉合成提供底物。
蔗糖合成过程中SPS酶的生化功能是催化果糖-6-磷酸和UDP葡萄糖转化为蔗糖-6-磷酸, 再由蔗糖磷酸化酶(sucrose phosphate phosphatase, SPP)水解脱去磷酸基团后形成蔗糖[34]。叶片为SPS酶的主要工作场所,本研究中SPS基因在浙贝母叶片中表达最高进一步证明了这一观点。甜根子[35]、龙眼[36]、烟草[37]中也有相似结果,浙贝母鳞茎中SPS基因的表达量与蔗糖含量呈显著正相关,且在蔗糖含量最高的时期达到最高值这一特点与Gnansounou等[38]在甜高粱、魏清江等[39]在金桔中的结果一致。SPS可调控光合产物在淀粉、蔗糖之间的分配比例[40],且会影响蔗糖与淀粉间的转化,在稻叶中可通过降低SPS表达提升淀粉含量[41],玉米和马铃薯[42]的研究发现,可通过增加SPS表达来提高产量。使用RNA干扰技术降低SPS的表达,可抑制淀粉降解的过程,使烟草叶片中淀粉含量增加3~8倍[37],可见SPS对植物淀粉、蔗糖代谢极其重要,且具有功能差异性。目前有研究发现低温[43]、干旱[44]胁迫可提升SPS表达进而提高蔗糖含量,在浙贝母鳞茎中蔗糖淀粉转化关键时期使用这一特性,可为浙贝母种植技术提供新思路。
ADP-葡萄糖焦磷酸化酶将1- 磷酸葡萄糖(glucose 1-phosphate, G1P)催化形成淀粉的前体腺苷二磷酸葡萄糖 (adenosine diphosphate glucose, ADPG),这是一种异四聚体酶[45],由2个大的和2个小的亚基组成,具有典型的NTP转移酶结构域[46]。试验发现,水稻中的OsAPL2和OsAPS2中的突变导致其淀粉合成速率显著降低[47-48],在玉米研究中,转座子衍生的AGPase基因敲除突变agps-m1可使田间玉米种子产量降低30%[49]。浙贝母鳞中AGP1、AGP2、AGP3三条家族基因均与淀粉含量呈极显著正相关,除AGP1基因根部表达量较高于鳞茎,AGP2、AGP3基因鳞茎中表达量远超过其他部位,郭丽君[50]发现在葛根块根膨大期,AGP基因在块根中表达量远高于其他部位,小麦、水稻、玉米中AGP基因在胚乳[51]中具有高表达量。这些结果都说明了AGP基因表达量影响着淀粉积累。
淀粉由直链淀粉和支链淀粉组成,GBSS基因可直接影响直链淀粉含量[52]。研究发现转入反义GBSS基因可中止相应器官合成直链淀粉进而降低淀粉含量。荸荠[53]中GBSS基因在块茎中表达量较高,黄芪[54]中GBSS基因在毛状根及根中表达量高于茎和叶,木薯[55]中GBSS基因只在块茎成长时期表达,百合[56]中GBSS基因在鳞茎表达量较高,浙贝母中GBSS基因在鳞茎中表达量也远高于其他部位,可见GBSS基因在鳞茎发育中具有重要作用。SSS、SBE基因共同参与支链淀粉合成,在水稻、小麦、玉米、马铃薯、大麦、拟南芥中将SSS基因表达敲低后作物中支链淀粉及总淀粉含量明显降低[57-61]。水仙[62]中SSS基因在花器发育期高表达,莲藕[63]根状茎伸长过程中SSS基因表达量不断变化,表明SSS基因与植物发育密切相关。浙贝母发育过程中GBSS和SSS基因均在鳞茎中高表达,且与淀粉含量呈显著正相关,表达量随鳞茎发育逐渐增大,仅在发育末期下降,原因可能为鳞茎在成熟时发育速率减慢且需降低生理活性为进入休眠期做准备。
浙贝母鳞茎中的淀粉合成与多种基因有关,这与侯夫云等[64]在甘薯中的研究结果相同;百合[65]中也发现AGP、SSS、GBSS基因均与淀粉含量及鳞茎发育成正相关,淀粉合成相关基因的克隆研究可为浙贝母分子育种及鳞茎膨大调控提供理论基础。
4 结论
试验首先使用同源克隆方法克隆出AGP1、AGP2、AGP3、SSS、GBSS、SBE、SPS、SS基因保守端,然后通过RACE技术获取全长序列,通过BLAST对比后发现各基因与百合中同名基因同源度均在90%以上,且与其他物种同名基因同源度达62%~90%。试验首次在浙贝母中克隆到AGP1、AGP2、AGP3、GBSS、SSS、SBE、SPS、SS基因,上传NCBI后获取登录号MT990627、MT990628、MT990629、MT996229、MT996230、MT996231、MT996232和MT996233。试验还发现AGP1、AGP2、AGP3、GBSS、SSS对浙贝母鳞茎中的淀粉积累至关重要,SS、SPS共同参与鳞茎中的蔗糖合成。本研究为浙贝母后续相关基因的功能研究奠定了基础,也为浙贝母分子育种及鳞茎膨大调控技术提供了依据。

