谷子SiPSY1基因与米色形成相关性分析
禾 璐 贾苏卿 赵芳玉 刘 晶 张 彬 侯思宇 韩渊怀,*
(1 山西农业大学玉米研究所,山西 忻州 034000;2 山西农业大学农学院,山西 晋中 030801)
类胡萝卜素是一种天然色素,常积累于高等植物花、果实的成色母细胞中,使其表现出黄色、红色或橙色。此外,类胡萝卜素也是某些植物根和种子中的重要色素[1]。类胡萝卜素在植物光合作用及光保护作用中具有重要作用[2-3],在增强人体免疫、延缓衰老、预防心血管慢性疾病以及防癌抗癌方面也具有重要功效[3-5]。类胡萝卜素作为重要的功能性成分受到广泛关注。
目前,类胡萝卜素生物合成途径已基本明确,是类异戊二烯代谢体系中的一个分支,过程包括缩合、脱氢、环化、羟基化以及环氧化反应[6]。在类胡萝卜素生物合成途径中,多种酶发挥关键作用,其中,八氢番茄红素合成酶(phytoene synthase, PSY)是第一个限速酶,可催化两分子牻牛儿基牻牛儿基二磷酸(geranylgeranyl diphosphate, GGPP)产生第一个类胡萝卜素分子——八氢番茄红素[6-8]。研究者已利用cDNA 3′末端快速扩增技术(rapid amplification of cDNA 3′ ends, 3′ RACE)、逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)等技术在玉米[9]、拟南芥[10-11]、番茄[12]、油菜[13]、小麦[14]、枸杞[15]、甘薯[16]、鸡爪槭[17]等植物中分离克隆了PSY基因,对基因的序列特征开展了一系列生物信息学分析[18-19],并通过超表达载体的构建对该基因在多种植物中的功能进行了研究,获得了一些具有特殊颜色的转基因植物,如胚呈橙黄色的转基因油菜[20]、胚乳呈金黄色的“金大米”[21]等。
谷子[Setariaitalica(L.)Beauv]是我国北方重要的杂粮作物,去壳后的小米具有较高的营养价值,深受消费者的青睐,而米色是评价小米品质的重要指标。小米中富含类胡萝卜素,平均含量为1.2 mg·kg-1,是玉米的2倍[22]。从不同米色品种的小米中提取黄色素,并进行成分分析,发现米色与类胡萝卜素的成分及含量具有一定的相关性[23-24],但目前关于米色形成的分子机制仍不明确,且对控制谷子类胡萝卜素生物合成关键酶基因及其功能的研究较少。基于此,本研究以不同米色谷子为试验材料,分离克隆了SiPSY1的cDNA全长,通过对基因结构以及该基因在谷子米色形成过程中表达特性差异的分析,初探SiPSY1基因与谷子米色形成的相关性,以期为进一步开展谷子类胡萝卜素调控机制的研究以及明确谷子米色形成分子机制提供理论依据。
1 材料与方法
1.1 材料种植及取材
选择黄色(七月黄、三变黄)和白色(白谷白米谷、白米糙)2种不同米色品种的谷子为试验材料,材料均为山西农业大学玉米研究所谷子课题组收集的农家种,种植于山西农业大学玉米研究所试验田,试验田肥力均匀,地势平坦。采用随机区组试验设计,设置3次重复。行长3 m,行距40 cm, 三行区。取材时,各品种每个重复选择中间行3株生长一致健康植株的籽粒进行混合,用镊子快速准确地剥下相同灌浆状态下的籽粒,在液氮中速冻后于-80℃低温保存。3个取样时期分别为:S1(米色形成初期,胚乳呈粉状),S2(米色形成中期,胚乳质地硬化),S3(米色形成后期,籽粒成熟)。
1.2 总RNA提取和cDNA合成
将低温保存的籽粒取出,去壳后置于液氮中研磨成粉末,参照EZ-10 Total RNA Mini-Preps Kit RNA提取试剂盒(上海生工生物)说明书提取籽粒总RNA,RNA浓度及质量分别通过Nanodrop 2000c超微量核酸蛋白测定仪(美国赛默飞)和1%琼脂糖凝胶电泳进行检测。cDNA合成按照M-MuLV 第一链cDNA合成试剂盒(上海生工生物)说明书的步骤进行,获得的cDNA利用内参引物进行PCR扩增验证。
1.3 引物设计
参考玉米ZmPSY1基因序列,在谷子基因组数据库中查找同源性最高的基因序列,分别以cDNA和CDS序列为模板,利用Primer 5软件设计克隆引物和定量引物,如表1所示,其中SiActin是内参基因。引物合成由上海生工生物工程股份有限公司完成。

表1 本研究所用的引物Table 1 Primers used in this study
1.4 PCR扩增及测序
以上述获得的谷子籽粒cDNA为模板,PCR扩增SiPSY1基因cDNA全长。采用50 μL反应体系,PCR程序为:95℃预变性2.5 min;95℃变性15 s,58℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min后4℃保存。利用1%琼脂糖凝胶电泳检测并分离PCR产物,使用胶回收试剂盒对目标片段进行回收后送至上海生工生物工程股份有限公司进行测序。
1.5 生物信息学分析
利用DNAMAN软件进行序列开放阅读框的翻译、同源性比对以及系统进化树的构建,通过ProtParam(http://web.expasy.org/protparam/)网站进行蛋白质理化特性分析,分别采用SOPMA(http://www.compbio.dundee.ac.uk/www-jpred/index.html)和SWISS-MODEL(https://swissmodel.expasy.org/)在线网站预测蛋白质二级结构和三级结构,应用MultAlin网站(http://multalin.toulouse.inra.fr/multalin/multalin.html)进行多序列比对。
1.6 实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)
使用SGExcel FastSYBR qPCR预混液(含 ROX)试剂盒进行qRT-PCR,采用50 μL反应体系:25 μL 2×SGExcel FastSYBR Mixture(含ROX), 2 μL cDNA,上、下游引物(10 μmol·L-1)各1 μL,最后加入RNase-Free ddH2O至50 μL。使用CFX96 TouchTM荧光定量PCR检测系统(美国伯乐),反应程序为:95℃预变性3 min;95℃变性5 s,60℃退火20 s,40个循环。每个反应设置3次技术重复。采用2-ΔΔCT法,通过Bio-Rad CFX Manager 3.1软件计算基因相对表达量。利用SPSS 17.0软件进行统计学分析。
2 结果与分析
2.1 SiPSY1基因的克隆与序列差异分析
以黄色和白色2种不同米色谷子为材料,提取籽粒总RNA,进一步反转录成cDNA,以cDNA为模板,通过PCR扩增获得了约1 500 bp的目标片段(图1)。将产物送至公司进行测序,对不同品种SiPSY1基因的编码序列(coding sequence, CDS)进行比对,发现该基因序列在不同品种间无差异(图2),说明其在不同品种中编码相同的氨基酸。利用DNAMAN软件对基因序列进行翻译,结果表明SiPSY1基因CDS全长为1 248 bp, 共编码415个氨基酸(图3)。

注:M:DNA分子量标准Marker S;1~4:不同品种中的PCR产物,其中1、2表示2个黄色米色品种(七月黄、三变黄),3、4表示2个白色米色品种(白谷白米谷、白米糙)。Note: M: Marker S. 1-4: PCR products in different varieties, including 1 and 2 refer to two yellow millets, Qiyuehuang and Sanbianhuang. 3 and 4 refer to two white millets, Baigubaimigu and Baimicao.图1 各品种中SiPSY1基因的克隆Fig.1 Cloning of SiPSY1 gene in different varieties
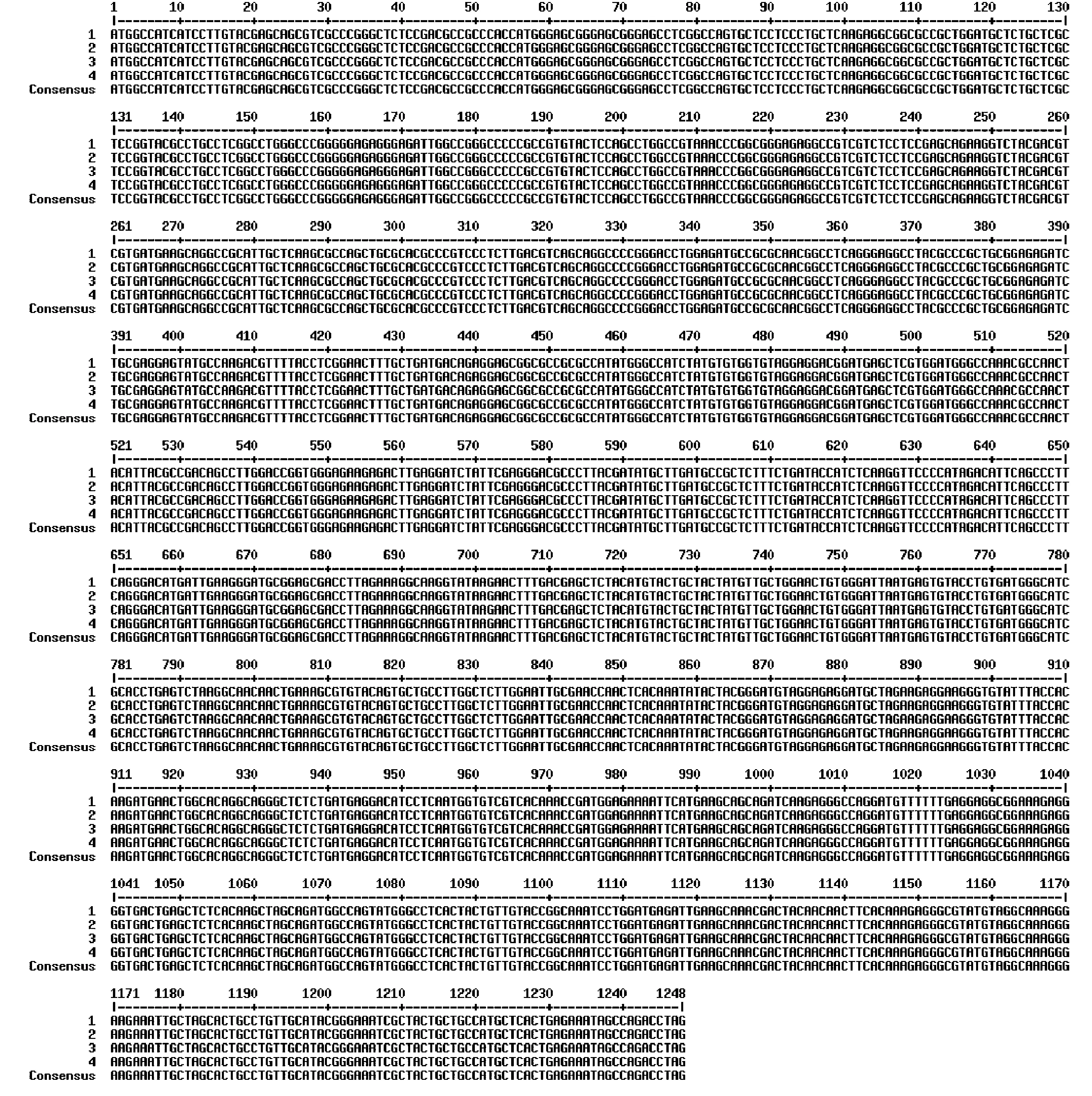
注:1、2表示2个黄色米色品种(七月黄、三变黄);3、4表示2个白色米色品种(白谷白米谷、白米糙)。Note: 1 and 2 refer to two yellow millets, Qiyuehuang and Sanbianhuang. 3 and 4 refer to two white millets, Baigubaimigu and Baimicao.图2 不同品种SiPSY1基因CDS序列比对Fig.2 Comparison of CDS of SiPSY1 gene among different millet varieties

图3 SiPSY1基因CDS序列及编码的氨基酸序列Fig.3 The CDS and amino acid sequence of SiPSY1 gene
2.2 SiPSY1基因生物信息学分析
2.2.1 蛋白质理化性质分析 利用ProtParam在线分析SiPSY1的氨基酸序列,结果表明其理论分子量为46.866 kDa,等电点为8.97,分子式为C2072H3308N592O605S21,构成该蛋白的氨基酸中,亮氨酸含量最高,占11.6%,其次为丙氨酸和精氨酸,均占9.9%,组氨酸含量最低,仅为0.5%。不稳定系数为62.61,属于不稳定蛋白。其亲水性平均系数(grand average of hydropathicity,GRAVY)为-0.284,属于亲水性蛋白。
2.2.2 蛋白质结构预测 利用SOPMA网站在线预测SiPSY1蛋白质的二级结构,结果表明(图4),该蛋白质由α螺旋(238个氨基酸残基,占57.35%)、不规则卷曲(123个氨基酸残基,占29.64%)、延伸链结构(41个氨基酸残基,占9.88%)和β转角(13个氨基酸残基,占3.13%)构成。通过SWISS-MODEL网站获得了SiPSY1蛋白质的三级结构模型,如图5所示,与二级结构预测结果基本一致。

注:h:α螺旋;e:延伸链;c:不规则卷曲;t:β转角。Note: h: α helix. e: Extended strand. c: Random coil. t: β turn.图4 SiPSY1蛋白质二级结构预测Fig.4 Predicted secondary structure of SiPSY1 protein
图5 SiPSY1蛋白质三级结构预测Fig.5 Predicted tertiary structure of SiPSY1 protein
2.2.3 同源序列与系统进化分析 利用DNAMAN软件对克隆获得的谷子SiPSY1氨基酸序列与NCBI GeneBank中其他植物的PSY1氨基酸序列进行比对,分析了它们的同源性和进化关系,如图6所示。谷子SiPSY1编码氨基酸与多种植物PSY1编码氨基酸具有同源性,有多个保守区域,其中,与玉米ZmPSY1的同源性最高,达到84.77%,其次为水稻OsPSY1,同源性为77.5%,与小麦TaPSY1的同源性为73.86%,此外,与拟南芥AtPSY1、辣椒CaPSY1的同源性相同,均为62.95%,与番茄SlPSY1、木薯MePSY1和油菜BnPSY1的同源性相同,为62.73%。
基于以上多重序列比对结果,进一步构建了系统进化树(图7),结果表明,谷子SiPSY1与玉米ZmPSY1的亲缘关系最近,与另外2个禾本科作物水稻和小麦的PSY1亲缘关系次之,而与其他植物的PSY1亲缘关系较远。
2.3 SiPSY1基因在不同谷子品种米色形成过程中的表达特性分析
通过qRT-PCR的方法,测定分析了SiPSY1基因在不同米色谷子品种中的表达差异以及在谷子米色形成过程中表达水平的变化情况,如图8所示。SiPSY1基因在谷子籽粒中的相对表达量存在品种差异,具体表现为,在米色形成初期(S1)和中期(S2),SiPSY1基因在2个黄色米色品种中的表达水平均显著高于在白色米色品种中的表达水平。在米色形成后期(S3),SiPSY1基因在2个白色米色品种中的表达水平,高于在黄色米色品种中的表达水平。
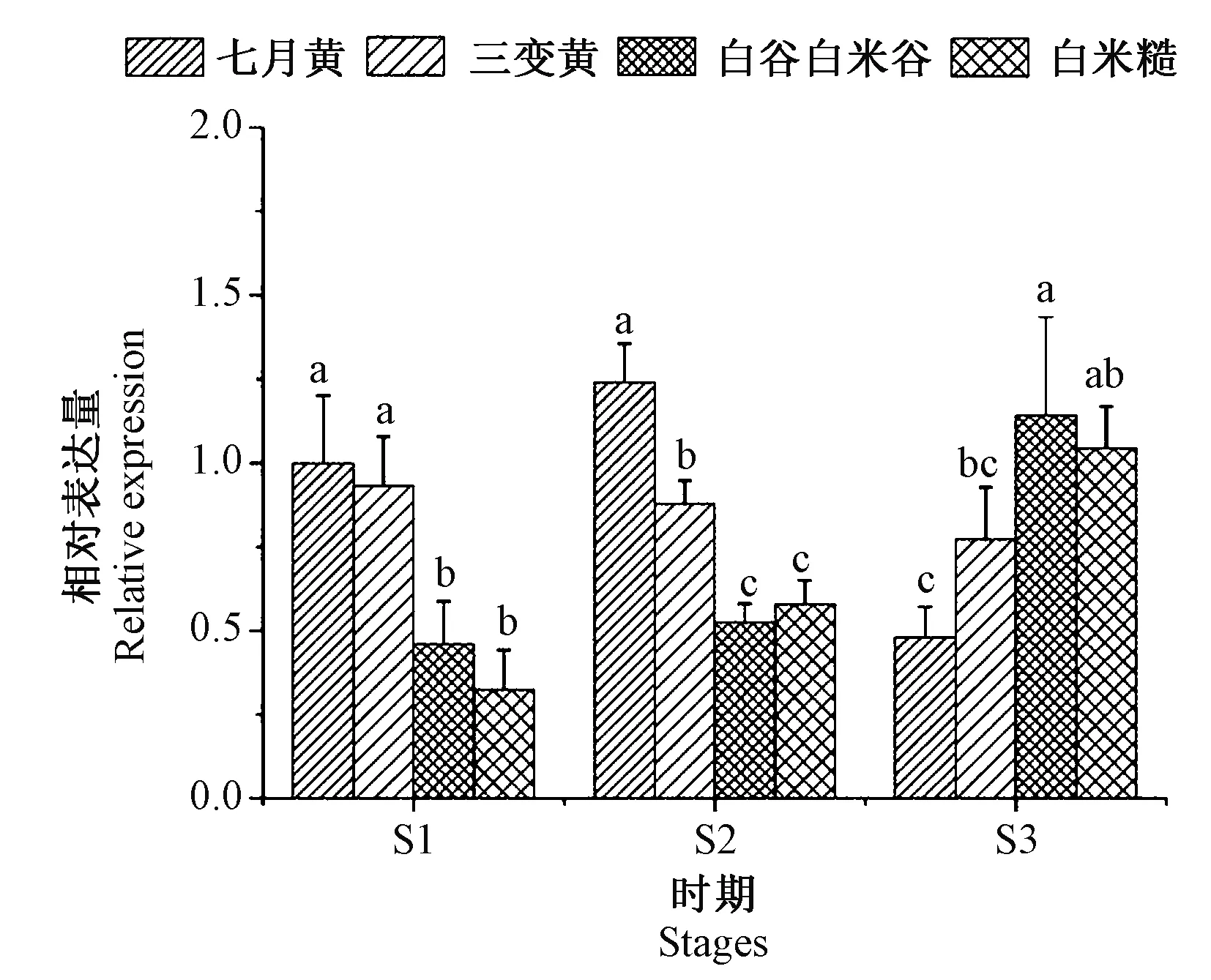
注:不同小写字母表示同一时期不同品种间SiPSY1基因的相对表达量在0.05水平上差异显著。Note: Different lowercase letters indicate that the relative expression level of SiPSY1 are significantly different at 0.05 level among different varieties at the same stage. 图8 SiPSY1在不同谷子品种中的表达差异Fig.8 Relative expression of SiPSY1 in different foxtail millet varieties
在谷子米色形成过程中,SiPSY1基因在黄色米色品种七月黄中的相对表达量表现为先上升后显著下降的趋势,在三变黄中呈下降趋势,但3个时期的变化并不显著。而在2个白色米色品种中,SiPSY1的相对表达量均表现为逐渐上升的趋势,其中,在白谷白米谷米色形成后期(S3),表达量显著升高,在白米糙米色形成各时期的变化均达到显著水平(图9)。
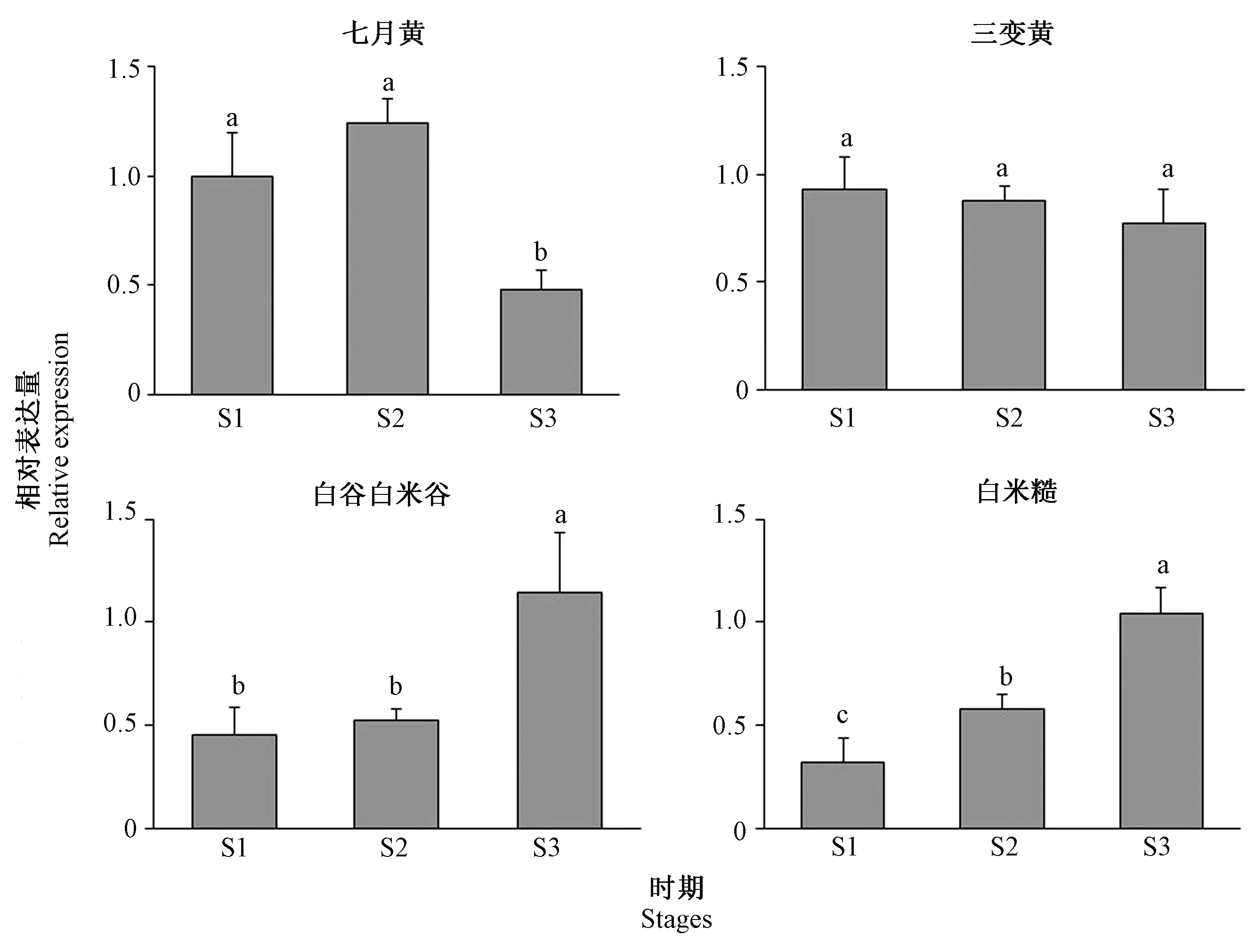
注:不同小写字母表示同一品种在不同时期间差异显著(P<0.05)。Note: Different lowercase letters indicate significant difference among different stage of the same varieties at 0.05 level.图9 SiPSY1在米色形成过程中的表达变化情况Fig.9 Relative expression of SiPSY1 during the formation of millet colors
3 讨论
在植物类胡萝卜素生物合成途径中,两分子GGPP在八氢番茄红素合成酶(PSY)作用下生成第一个类胡萝卜素分子——八氢番茄红素。PSY作为第一个限速酶,其编码基因成为研究类胡萝卜素生物合成机制以及利用基因工程技术提高植物类胡萝卜素含量的首选目的基因[25]。目前,在多种植物中已经成功克隆分离出PSY基因,并鉴定出PSY基因家族中的3个成员,分别为PSY1、PSY2和PSY3,3个基因具有器官或质体表达特异性。其中,PSY1主要在含有有色体的花、果实和种子中调控类胡萝卜素的合成[25-28]。本研究以不同米色谷子品种籽粒为研究材料,利用同源克隆技术,获得了谷子SiPSY1基因的cDNA全长,其开放阅读框(open reading frame, ORF)包含1 248个碱基,共编码415个氨基酸。谷子SiPSY1蛋白与同属于C4禾本科作物玉米的ZmPSY1同源性最高,为84.77%,二者亲缘关系最近。
在其他植物中,研究者对类胡萝卜素生物合成调控机制及PSY基因的功能开展了一系列研究。研究发现,PSY1基因突变影响玉米胚乳中类胡萝卜素的合成,导致玉米种子出现浅黄色表型[6,26],PSY基因的遗传变异在辣椒成熟果色的形成中起着重要的调控作用[29],此外,通过转基因技术获得的胚呈橙黄色的油菜和胚乳呈金黄色的“金大米”均与PSY基因表达有关[20-21]。本试验分析了SiPSY1基因在不同米色谷子品种籽粒中的表达情况,结果发现,在谷子米色形成的初期和中期,黄色米色品种籽粒中SiPSY1基因的表达水平显著高于白色米色品种,表明谷子黄色米色表型与SiPSY1基因表达有关,这与上述其他植物中的研究结果一致。Li等[26]分析了玉米授粉后10~28 d胚乳成熟过程中PSY1基因的表达变化,发现该基因的表达量呈先上升后下降的趋势,这与本试验中黄色米色品种七月黄米色形成过程中SiPSY1基因的表达变化趋势一致。此外,本研究还发现,SiPSY1基因在白色米色品种米色形成过程中,其表达水平呈逐渐上升趋势,且在米色形成后期,高于在黄色米色品种中的表达水平。以上结果可能与类胡萝卜素产物反馈抑制有关,SiPSY1基因的表达量上升,类胡萝卜素不断合成,黄色米色品种中类胡萝卜素终产物不断积累,积累到一定程度开始抑制SiPSY1基因的表达;而在白色米色品种中,类胡萝卜素的积累量并不足以产生反馈抑制作用,使SiPSY1基因表达量呈持续上升趋势。
本研究从基因结构和表达特性两个方面对SiPSY1基因与谷子米色形成相关性进行了探讨,但对SiPSY1基因的功能研究还不够深入,需要进一步通过基因编辑、基因沉默、转基因技术等基因工程手段进行更深入的基因功能分析及相关的应用途径研究,从而明确该基因在谷子米色形成分子机制中的作用。
4 结论
本研究从黄色和白色两种不同米色谷子籽粒中克隆出SiPSY1基因的cDNA全长序列,该基因的CDS全长为1 248 bp,共编码415个氨基酸。通过qRT-PCR分析表明,在谷子米色形成初期和中期,SiPSY1基因在黄色米色品种籽粒中的表达水平显著高于白色米色品种,由此推测谷子SiPSY1基因的表达特性与谷子米色形成具有一定的相关性。

