性成熟期辽宁绒山羊与子午岭黑山羊睾丸发育比较
梁维炜,李明娜,罗玉柱,王继卿,柯 娜,沈继源,郝志云,金夏阳,鲁玉洁,黄兆春
(甘肃农业大学动物科学技术学院 甘肃省草食动物生物技术重点实验室,兰州 730070)
辽宁绒山羊主要分布于辽宁省东部山区,是绒肉兼用型山羊品种,具有体型大、产绒量高、绒毛品质好、遗传性能稳定等优点,常被引入我国多地用于改良体型小、产绒低的地方山羊品种[1-3]。子午岭黑山羊主要分布于陕西和甘肃东部地区,体格中等偏小,被毛以黑色为主,以盛产黑猾皮和紫绒而著称,耐粗饲,适应性好,抗病力和抓膘能力强。自1965年以来,甘肃庆阳引进辽宁绒山羊对子午岭黑山羊产绒性能进行改良[4]。有研究表明,辽宁绒山羊杂交改良子午岭黑山羊,能够显著提高子午岭黑山羊的产绒量和绒纤维品质,各代杂交羊的体重、体高、体长和胸围较同龄子午岭黑山羊均显著提高[5]。近期有报道研究了两品种山羊的产肉性能和肉品质,发现子午岭黑山羊的产肉性能低于辽宁绒山羊,而其肉品质和营养成分高于辽宁绒山羊[6]。然而有关两品种繁殖性能的系统对比相对较少。
睾丸是雄性动物所特有的器官,在家畜的正常繁育过程中发挥着重要的作用,其能够产生精子,分泌雄激素。睾丸内含有大量的精细管,内壁衬有生精上皮,内嵌有支持细胞和各级生精细胞,各级生精细胞从精细管上皮的基底膜向管腔迁移的过程中持续分裂和变化,最终形成精子。精细管之间为睾丸间质,其中有间质细胞,雄激素由间质细胞合成和分泌,对于雄性动物维持第二性征、产生精子及促进精子成熟具有重要作用。雄激素能够直接或间接促进生殖细胞的生长和发育[7];浓度较高时可提高精子的数量和质量[8],浓度较低时将会导致睾丸生殖细胞凋亡率增加[9]。因此,生精细胞数量、质量及雄激素浓度影响雄性动物精液品质,进而影响其繁殖潜力[10-11]。
死盒多肽4(DEAD box polypeptide 4,DDX4)基因为DEAD-box基因家族成员,1986年在果蝇中被发现[12]。DDX4在精子发生过程中的减数分裂全过程中持续高表达,直至形成精子细胞,表达产物是精子发生的必需蛋白[13-14]。在小鼠中敲除DDX4后,雌鼠的生殖细胞发育正常,而雄鼠不育,其原因是雄性生殖细胞未能完成减数分裂而凋亡,不能产生精子[15]。与牦牛相比,在减数分裂阻滞、雄性不育犏牛睾丸组织中DDX4基因表达量较低[14],这与小鼠等哺乳动物雄性不育个体睾丸中DDX4基因表达模式一致。
类无精症缺失基因(deleted in azoospermia-like gene,DAZL)为DAZ(deleted in azoospermia)基因家族成员,编码RNA结合蛋白,在生殖细胞中高度表达,并参与调节其发育和分化,同时调控精子发生中减数分裂过程[16-17]。DAZL基因在犏牛睾丸组织中表达水平低于黄牛和牦牛,参与犏牛精子发生过程中减数分裂调控[18]。DAZL表达量在湖羊性成熟时达到高峰,DAZL在睾丸发育中发挥重要作用[19]。李讨讨等[20]发现,绵羊不同发育阶段各级生精细胞数量不同,与DAZL基因表达量高低有关。
基于以上研究背景,本研究采集性成熟、健康的纯种辽宁绒山羊和子午岭黑山羊睾丸,通过大体解剖、石蜡包埋结合HE染色等方法分析两品种间睾丸发育程度;同时采用ELISA测定雄激素含量,RT-qPCR、Western blot方法测定生殖标记基因(DDX4和DAZL)在两品种山羊睾丸组织中表达水平,旨在比较两品种山羊繁殖性能是否存在差异,为将来在生产实践中辽宁绒山羊改良子午岭黑山羊繁殖性能提供参考依据。
1 材料与方法
1.1 试验动物和样品采集
本试验选取相同饲养管理条件下,生长发育正常,健康的9月龄纯种辽宁绒山羊和子午岭黑山羊公羔(各5只,共10只)为试验动物,饲养过程中所有羊均未进行配种。相同饲养管理条件下,9月龄辽宁绒山羊的宰前活重和胴体重分别为31.09和14.10 kg,分别极显著高于同龄子午岭黑山羊的18.21和7.45 kg(P<0.01)[6],解剖分离出两侧睾丸,用磷酸盐缓冲盐水(PBS)冲洗除血后称量两侧睾丸总重,右侧睾丸用于测量睾丸长、短周径,左侧睾丸用于试验指标检测的取样:沿睾丸长轴纵向剖开,取横切面中间部位相同大小的睾丸组织分别储存于液氮和4%多聚甲醛溶液中,用于后续试验。
1.2 试验方法
1.2.1 睾丸表观参数测定 参考《羊生产学》[21],测量山羊的两侧睾丸总重。测量睾丸长周径、睾丸短周径[22],计算睾丸脏体比和睾丸胴体比。睾丸脏体比=睾丸总重/宰前活重,睾丸胴体比=睾丸总重/胴体重。
1.2.2 雄激素浓度测定 准确称取新鲜睾丸组织,0.9%生理盐水按1∶9(w/v)稀释后匀浆,5 000 r·min-1离心10 min,取上清液,制成10%的匀浆待测。用山羊雄激素ELISA试剂盒(ZC-51511,茁彩)测定睾丸组织中雄激素浓度,具体操作步骤参照试剂盒使用说明书。
1.2.3 石蜡切片的制作及HE染色 将固定于4%多聚甲醛溶液溶液中的睾丸组织,经洗涤、脱水、透明、浸蜡、包埋、切片、贴片、烤片、脱蜡、水化、苏木精-伊红(Hematoxylin -eosin,HE)染色、脱水、透明和封片制成切片。采用荧光扫描显微镜(P250 Flash,丹吉尔)观察切片。
1.2.4 总RNA提取及cDNA合成 将睾丸组织分别加入液氮充分研磨后,YransZol RNA提取试剂盒(ET101,全式金)提取睾丸组织总RNA。采用FastKing一步法除基因组cDNA第一链合成预混试剂盒(KR118,天根)对提取的总RNA进行反转录,具体操作步骤参照试剂盒使用说明书。获得的cDNA产物于-80 ℃保存备用。
1.2.5 引物设计与合成 从 GenBank 数据库中检索山羊DDX4基因(XM_005694694.3)、DAZL基因(JX273761.1)和内参基因β-actin(NM_001314342.1)mRNA 序列,利用Primer Premier 3.0 软件设计引物,并进行BLAST检测后,将引物序列信息(表1)发送至杨凌天润奥科生物科技有限公司进行引物合成。

表1 引物序列信息Table 1 Information of primer sequence
1.2.6 实时荧光定量PCR(RT-qPCR)技术 采用实时荧光定量PCR仪(Thermo Fisher,USA)对睾丸组织中DDX4和DAZLmRNA表达水平进行检测,以β-actin为内参。在八联管的每个孔中先加入10 μL 2×SYBR®Green Premix Pro Taq HS qPCR Kit(AG11720,艾科瑞),各0.4 μL上、下游引物和7.2 μL ddH2O,最后加入2 μL cDNA,每个样做3次重复。将八联管置于实时荧光定量PCR仪中,先95 ℃预变性3 min;再95 ℃变性10 s,60 ℃ 退火30 s,72 ℃延伸30 s,进行40个循环;最后95 ℃变性15 s,60 ℃退火60 s,95 ℃变性15 s。采用2-ΔΔCt计算方法对RT-qPCR结果进行计算。
1.2.7 免疫印迹(Western blot)分析 采用全蛋白提取试剂盒(BC3711,索莱宝)提取睾丸组织总蛋白,采用BCA蛋白浓度测定试剂盒(P0012,碧云天)检测睾丸组织总蛋白浓度,定量后按比例加入4× 十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,煮沸10 min使蛋白变性,于-20 ℃保存。每孔上样8 μL变性蛋白,以GAPDH (D110016,生工)为内参,12%的十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamidegel electrophoresis,SDS-PAGE)进行电泳,转膜,封闭后,分别加入兔源DDX4一抗(1∶300)(D161611,生工)、兔源DAZL一抗(1∶300)(bs-12245R,博奥森)和兔源GAPDH一抗(1∶1 500)(D110016,生工)4 ℃孵育过夜。磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗膜,用山羊抗兔二抗(1:5 000)(D111018,生工),37 ℃孵育1.5 h,PBS洗膜。用底物化学发光液(electrochemi-luminescence,ECL)显影曝光,并观察实验结果。
1.3 统计分析
使用Image J图像分析软件测定Western blot结果。采用SPSS 20.0软件对数据进行独立样本T检验和显著性分析,结果用“均值±标准差(Mean±SD)”表示。
2 结 果
2.1 两品种山羊睾丸表观参数比较
由表2可知,辽宁绒山羊的睾丸总重和睾丸长周径极显著高于子午岭黑山羊(P<0.01);辽宁绒山羊的睾丸短周径、睾丸脏体比和睾丸胴体比,与子午岭黑山羊差异不显著(P>0.05)。

表2 辽宁绒山羊和子午岭黑山羊睾丸表观参数测定结果Table 2 Testicular apparent parameters of Liaoning cashmere goat and Ziwuling black goat
2.2 睾丸组织形态学观察
石蜡包埋结合HE染色观察两品种睾丸组织(图1),发现精细管横切面均为中空的同心圆状结构,辽宁绒山羊生精上皮内细胞层数较子午岭黑山羊多且排列紧密。进一步测定生精上皮厚度、精细管的面积、直径和单位面积内精细管数量等指标(表3),结果表明,辽宁绒山羊睾丸生精上皮厚度显著高于子午岭黑山羊(P<0.05),而两品种间精细管的面积、直径及睾丸单位面积内精细管数量没有显著差异(P>0.05)。

图1 辽宁绒山羊(A、B)和子午岭黑山羊(C、D)睾丸HE染色石蜡切片Fig.1 HE staining of Liaoning cashmere goat (A,B)and Ziwuling black goat (C,D)testes
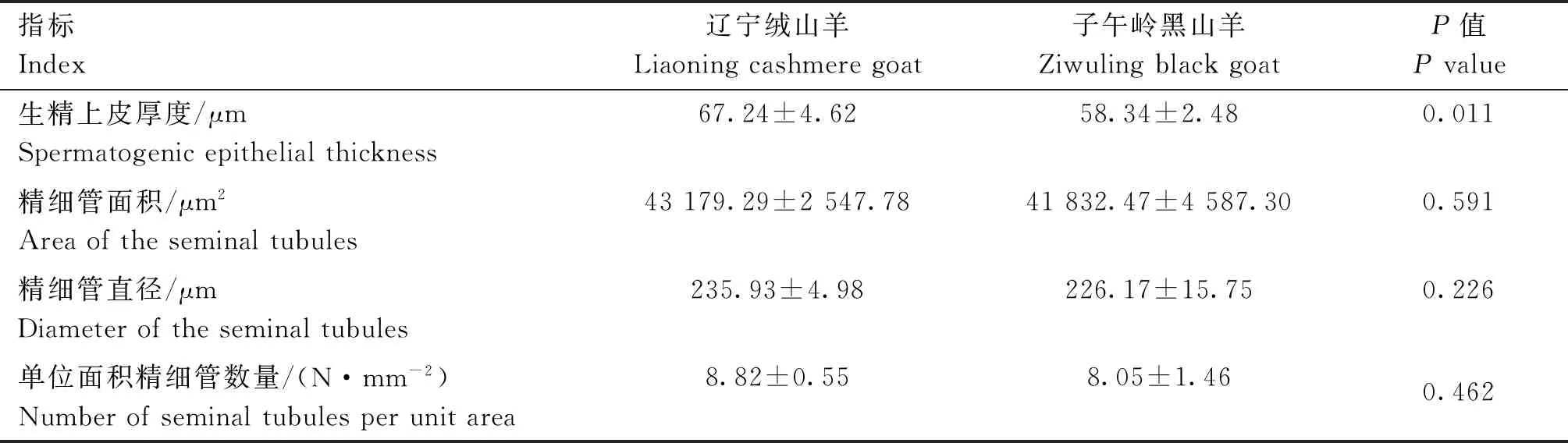
表3 辽宁绒山羊和子午岭黑山羊睾丸组织形态学比较切片结果Table 3 Comparision of testicular histomorphology between Liaoning cashmere goat and Ziwuling black goat
2.3 两品种山羊睾丸雄激素浓度结果
采用ELISA检测睾丸内雄激素浓度,结果发现,辽宁绒山羊睾丸内雄激素浓度高于子午岭黑山羊睾丸内雄激素浓度,但没有显著差异(P>0.05,图2)。

LC.辽宁绒山羊;ZB.子午岭黑山羊;**.差异极显著(P<0.01);*.差异显著(P<0.05)。下同LC.Liaoning cashmere goat;ZB.Ziwuling black goat;**.Extremely significant difference;*.Significant difference.The same as below图2 辽宁绒山羊和子午岭黑山羊睾丸中雄激素浓度Fig.2 Androgen concentration in testis of Liaoning cashmere goat and Ziwuling black goat
2.4 DAZL 和DDX4基因表达结果分析
DAZL和DDX4是重要的生殖细胞标记基因,采用RT-qPCR检测辽宁绒山羊和子午岭黑山羊睾丸组织中DDX4和DAZLmRNA的相对表达量,结果如图3,两基因在辽宁绒山羊中的相对表达量均极显著高于子午岭黑山羊(P<0.01)。

图3 辽宁绒山羊和子午岭黑山羊睾丸中DDX4和DAZL mRNA相对表达量Fig.3 Relative expression levels of DDX4 and DAZL mRNA in testis of Liaoning cashmere goat and Ziwuling black goat
2.5 DDX4和DAZL蛋白表达量结果分析
采用Western blot技术检测辽宁绒山羊和子午岭黑山羊睾丸组织中DDX4和DAZL蛋白的相对表达量,结果如图4A所示,DDX4和DAZL蛋白在辽宁绒山羊和子午岭黑山羊睾丸组织中均有表达,但其表达丰度略有差异。灰度值分析结果表明,辽宁绒山羊睾丸组织中DDX4蛋白相对表达量显著高于子午岭黑山羊(P<0.05),而DAZL蛋白相对表达量在两品种间无差异,但有上调趋势(P>0.05)(图4B)。

A.DDX4和DAZL蛋白的Western blot分析;B.DDX4和DAZL蛋白的相对表达量A.Western blot analysis for DDX4 and DAZL protein;B.The relative level of DDX4 and DAZL protein expression图4 辽宁绒山羊和子午岭黑山羊睾丸组织中DDX4和DAZL蛋白的表达结果Fig.4 Expression of DDX4 and DAZL protein in testicular tissue of Liaoning cashmere goat and Ziwuling black goat
3 讨 论
3.1 辽宁绒山羊和子午岭黑山羊睾丸发育程度分析
据《羊志》[23]记载,辽宁绒山羊公、母羊5~7月龄性成熟,15~18月龄进行初配;子午岭黑山羊公、母羊均6月龄左右性成熟,8月龄配种。本研究选取9月龄辽宁绒山羊和子午岭黑山羊作为研究对象,此时两品种均已达到性成熟,生殖器官已发育成熟,表明两品种的繁殖性能基本趋于稳定,可用于睾丸发育程度分析。同时比较两品种睾丸发育,可作为将来评定其繁殖潜力的基础资料。
宰前活重和胴体重等指标因动物品种不同而存在显著差异[24]。辽宁绒山羊的宰前活重和胴体重均极显著高于子午岭黑山羊(P<0.01)[6],表明辽宁绒山羊生长发育较子午岭黑山羊快,这与其他文献中的报道相一致,即辽宁绒山羊生长发育比当地山羊快[25-26]。不同品种猪睾丸重量和大小存在显著差异[27],本研究发现,辽宁绒山羊双侧睾丸较子午岭黑山羊重,睾丸长周径较子午岭黑山羊长,而睾丸短周径、睾丸脏体比和睾丸胴体比无差异,表明辽宁绒山羊生长发育快,性腺也相应较大且重,但从睾丸器官指数相关指标来看,9月龄的辽宁绒山羊和子午岭黑山羊性腺发育程度基本一致。
3.2 辽宁绒山羊和子午岭黑山羊睾丸组织形态学比较
精子发生是一个高度复杂的生物学过程,涉及一系列细胞增殖和分化,如精原细胞有丝分裂、精母细胞减数分裂、功能精子的形成等[28-29]。精细管是精子发生的主要场所,精子发生始于精细管上皮的基底膜处,逐渐向管腔移动,最终形成蝌蚪状的精子,头部嵌于支持细胞近腔端,尾部游离于管腔中。本研究中对睾丸组织形态学的检测发现,辽宁绒山羊精细管面积、直径和单位面积精细管数量与子午岭黑山羊无显著差异;然而辽宁绒山羊睾丸生精上皮厚度显著高于子午岭黑山羊。生精上皮中嵌合各级生精细胞,由此推测,两品种生殖上皮厚度的差异可能是由生精细胞数量差异引起的,这有待于进一步通过分子生物学方法验证。
睾丸间质细胞合成和分泌雄激素[30],对雄性生殖器官的生长、精子发生和雄性第二性征的维持有着促进作用[31]。有研究表明,雄激素水平与睾丸生殖细胞凋亡密切相关[9];同时,雄激素又参与调控间质细胞的发育和分化[32]。因此,为进一步分析两品种睾丸间质细胞的数量是否有差异,本研究采集相同部位的睾丸组织测定雄激素浓度。结果发现,辽宁绒山羊睾丸组织中雄激素浓度与子午岭黑山羊无显著差异,表明两品种山羊睾丸间质细胞数量及细胞分泌激素的能力差异不显著,且雄激素对睾丸生殖细胞凋亡的影响也不显著。
3.3 辽宁绒山羊和子午岭黑山羊睾丸内生殖标记基因的表达分析
精子发生过程中生殖细胞的发育受DAZL基因调控,该基因是提高雄性动物繁殖能力所必需的[33]。DAZL在湖羊不同发育阶段睾丸中的表达量不同,特别是在性成熟后睾丸中的表达最高[34]。付永[18]发现,犏牛雄性不育,与DAZL在犏牛睾丸组织中低表达有关。DDX4表达的开始与精原细胞的形成有关[13],DDX4 基因特异表达于生殖细胞系[35],是调控哺乳动物生殖细胞增殖和分化必不可少的[36],同时,哺乳动物生殖细胞的形成可能取决于其与性腺体细胞的相互作用[37]。本研究发现,DAZL和DDX4 mRNA在辽宁绒山羊睾丸中表达量显著高于子午岭黑山羊。DDX4蛋白在辽宁绒山羊睾丸中的表达量高于子午岭黑山羊,这与DDX4 mRNA的表达趋势一致。DAZL蛋白在两品种间表达无差异,但呈上调趋势,这与Yuan等[19]研究结果一致,即大睾丸中DAZL丰度高于小睾丸,但差异不显著。因此生殖细胞标记基因在精子发生过程中发挥重要作用,生殖细胞标记基因的差异表达能够反映出辽宁绒山羊的生殖细胞数量可能较子午岭黑山羊多,进而影响生精能力,这也印证了两品种生精上皮厚度存在显著差异。然而,本研究未针对两品种山羊精液品质及精子活率等指标做详细比对,下一步本课题组将采集适配公羊的精液进行比对分析,深入剖析两品种公羊的繁殖力。
3.4 辽宁绒山羊和子午岭黑山羊繁殖潜力比较
辽宁绒山羊成年母羊产羔率110%~120%,断奶羔羊成活率95%以上[38],产双羔率21.28%[39];子午岭黑山羊产羔率103.57%[40],产双羔率2%~4%[41]。同时,根据《羊志》[23]中关于辽宁绒山羊和子午岭黑山羊性成熟月龄及初配年龄的记载,推测辽宁绒山羊繁殖性能较子午岭黑山羊高。生产实践中利用辽宁绒山羊改良子午岭黑山羊,不仅对子午岭黑山羊的产绒性能和生长性能有所提升,推测杂交后代的繁殖性能也会得到改良。
4 结 论
性成熟的辽宁绒山羊生长发育速度较子午岭黑山羊快,睾丸器官指数无显著差异。组织形态学研究发现,辽宁绒山羊精细管上皮厚度较子午岭黑山羊厚,生殖标记基因表达量存在显著差异。推测性成熟后辽宁绒山羊生精能力较子午岭黑山羊高,生产实践中引进辽宁绒山羊杂交改良子午岭黑山羊,对其繁殖性能可能会有所提升。

