多肽PDSORBS2对缺氧/复氧诱导的H9C2细胞凋亡的影响
陈露露,徐勋龙,陈婉岚,邱朝晖
上海交通大学医学院附属同仁医院心内科,上海 200336
心血管疾病(cardiovascular diseases,CVD)包括缺血性心脏病(ischemic heart disease,IHD)、心力衰竭、卒中等一些心脏和血管相关的疾病,是全球人口死亡的主要原因,也是导致生活质量下降的主要因素[1]。在2017 年,CVD 导致全球约1 780 万人死亡[2],而其中中国死亡人数为437.8 万人[3],约占全世界CVD 致死人数的1/4,致使我国CVD 的防治工作仍然面临着巨大的挑战[4]。因动脉粥样硬化引起的冠状动脉狭窄导致心肌供血不足是IHD 的重要病因[5],其中心肌梗死(myocardial infarction,MI)是指冠状动脉阻塞引起的冠状动脉血流中断从而导致心肌缺血性坏死[6]。因此针对急性心肌梗死(acute myocardial infarction,AMI),临床上以尽早开通血管、血运重建为主要策略来挽救濒死的心肌,其中包括经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)和冠状动脉旁路移植(coronary artery bypass grafting,CABG) 已在临床上得到了广泛的应用[7]。但长期的临床应用发现,虽然介入手术恢复了心肌供血,显著提升了患者的生存率[8],但在心脏的血运重建过程中,通常会导致另一种不可避免的损伤,即心肌再灌注损伤, 也称为缺血再灌注(ischemic reperfusion,I/R)损伤[9],诱导心肌细胞凋亡,并由此继发心肌瘢痕乃至心力衰竭及恶性心律失常等[10]。
心脏I/R 损伤的发病机制包括多个复杂的过程,已经明确氧化应激、炎症与凋亡、线粒体功能障碍是心脏I/R损伤引发心脏功能受损的重要因素[11]。由氧自由基引起的氧化应激导致心肌细胞的异常凋亡一直以来被认为是心肌I/R 损伤的关键机制[12]。在心脏再灌注过程中,由于突然恢复血流,大量的氧气和营养物质持续进入细胞,导致心肌细胞线粒体中活性氧(reactive oxygen species,ROS)呈爆炸式的激增[13]。然而,过量的ROS 不仅会触发氧化应激,还会破坏蛋白质、脂质、DNA 等生物大分子,随后导致心肌细胞的异常凋亡,并由此引发心脏功能障碍[14]。由于I/R 损伤复杂的病理机制,目前针对I/R损伤的保护策略仍十分有限,需要我们去寻找更加积极有效的干预手段[15]。
多肽在体内是一类重要的生物分子,具有多样性,并且多肽是具有选择性的高效信号分子,能够结合特定的细胞表面受体[16]。此外,多肽还具有相对分子质量小、生物活性高、不良反应少及临床转化率高等良好的成药特性[17]。研究表明多肽在缓解细胞病理损伤、促进组织修复中展现出良好的功能:①抗菌肽LL-37能够调节细胞增殖,并且能够促进血管生成[18]。②Humanin 肽能够保护心肌细胞免受氧化应激诱导的损伤[19]。此外,众所周知,由心脏分泌的B 型钠尿肽(B-type natriuretic peptide,BNP)和A 型钠尿肽(A-type natriuretic peptide,ANP)都具有心脏保护特性,这些肽在心肌缺血的早期释放,并对心肌缺血性损伤产生保护作用[20]。我们在前期的工作中,从缺血后的大鼠心肌细胞中发现了37 条表达上调的肽[21]。其中有1 条肽的序列为LPASLNS,这条肽上调倍数是1.41,P值为0.001,差异具有统计学意义。由于其前体蛋白名为SORBS2,我们将此肽命名为PDSORBS2。因此,我们猜测在缺血应激下,由心肌细胞分泌的多肽PDSORBS2 可能对心脏也存在一定的保护作用,可从多肽的角度探寻I/R损伤治疗的新方向。
1 材料与方法
1.1 主要仪器
无菌超净台、细胞培养箱、生物安全柜(Thermo Fisher Scientific,美国),倒置显微镜(Leica,德国),流式细胞仪(BD,美国),纯水仪(Merk Millipore,美国),垂直电泳仪和膜转移装置(Bio-Rad,美国),低温水平离心机(HITACHI,日本),全自动化学发光/荧光图像分析系统(天能,中国),激光共聚焦显微镜(Zeiss,德国),Gemini XPS荧光型酶标仪(Molecular Devices,美国)。
1.2 主要试剂与材料
大鼠胚胎心脏来源的H9C2细胞购于美国模式菌种保藏中心(American Type Culture Collection,ATCC);高糖细胞培养基DMEM、1%的链霉素/青霉素和10%胎牛血清(fetal bovine serum,FBS)均购于美国Gibco 公司;ROS 检测试剂盒和Hoechst 33342 染色试剂(碧云天,中国);细胞计数试剂盒8 (cell counting kit-8,CCK-8)(Dojindo,日本);细胞凋亡与细胞周期检测试剂盒(爱必信,中国);细胞裂解液(Solarbio,中国);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(Millipore,美国); 聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶快速制备试剂盒(雅酶,中国);β-肌动蛋白(β-actin)、细胞外信号调节激酶(extracellular regulated protein kinases,ERK)、磷酸化细胞外信号调节激酶(phospho-extracellular regulated protein kinases,P-ERK)、磷酸化蛋白激酶B(phosphoprotein kinase B,P-AKT)及蛋白激酶B(protein kinase B,AKT)等一抗均购自美国的CST公司;所有的二抗购自Biosharp 公司;所有的肽均由上海科肽生物技术有限公司(中国)合成,肽的纯度高于95%。
1.3 实验方法
1.3.1 细胞的培养 将大鼠心脏来源的H9C2 细胞接种在10 cm 的培养皿中,在含有10%FBS 和1%青霉素/链霉
素的完全DMEM 中孵育。并在37 ℃和5%二氧化碳的条件下培养,每隔1 d更换1次新鲜的培养基。H9C2细胞根据实验需要被随机分成正常对照组(NC 组)、NC+PDSORBS2 组(仅接受多肽PDSORBS2 处理)、H/R 组(仅接受H/R 处理) 和PDSORBS2+H/R 组(多肽PDSORBS2预处理后再接受H/R处理)。
1.3.2 细胞缺氧/复氧(hypoxia/reoxygenation,H/R)损伤模型的建立 正常培养细胞,当细胞生长到60%~70%的密度时,更换新鲜的无糖无血清培养基,再将培养皿放入三气培养箱(94%N2、5%CO2、1%O2)中,缺氧6 h后将细胞取出,更换新鲜完全培养基后再放入正常孵箱(95%空气+5%CO2的混合气体)复氧2 h。根据细胞活力值,选择细胞活性约为50%的处理时间作为后续造模的处理时间。
1.3.3 多肽浓度的确定 在H/R 处理之前,提前30 min分别采用10、 20、 50、 100 μmol/L 浓度的多肽PDSORBS2 处理H9C2 细胞。以NC 组为对照,然后根据细胞活力值,选择多肽PDSORBS2 作用效果最显著的最低浓度进行后续实验。
1.3.4 H9C2 细胞活性的检测 采用CCK-8 检测H9C2 细胞的活性。将处于对数期且状态良好的细胞按照每孔1 000 个细胞的密度接种于96 孔板中,孵育24 h,用多肽PDSORBS2 预处理30 min 后,再让细胞接受H/R 处理。然后在每孔中加入10 μL CCK8试剂,避光下孵育3 h。根据酶标仪测量出450 nm 波长下的吸光度值并按如下公式计算细胞的活力: 细胞活力 = [D(450 nm)值加药组 -D(450 nm)值空白组]/[D(450 nm)值对照组-D(450 nm)值空白组]×100%。
1.3.5 细胞内ROS 含量的检测 按照各组要求处理细胞后,去除细胞培养基,PBS洗涤2遍,加入2′,7′-二氯二氢荧光素(2′,7′-dichlorodihydrofluorescein,DCFH)染色30 min,PBS洗涤后使用荧光酶标仪检测480 nm激发光下的荧光强度,并分析各组细胞内的荧光强度。
1.3.6 Hoechst 33342 染色 将造模完毕的细胞,用PBS洗涤后加入Hoechst 33342 染色工作液,室温避光孵育5 min后PBS洗涤3次,荧光显微镜下观察。
1.3.7 细胞凋亡和细胞周期的检测 为了探究多肽PDSORBS2 对H/R 诱导的H9C2 细胞凋亡程度和细胞周期的影响,利用流式细胞术对细胞的凋亡程度和细胞周期进行检测。将处于对数期且状态良好的细胞按照以5×105个/皿的密度接种在直径6 cm 的培养皿中,孵育24 h后细胞密度达到70%,按照分组的要求分别处理细胞。
将细胞收集在1.5 mL 的离心管中,用细胞计数器计数,保证每管中细胞数量大于106。去除细胞上清液,加入195 μL 绿色荧光标记的Annexin V 蛋白(Annexin V-fluorescein isothiocyanate,Annexin V-FITC)结合液轻轻重悬细胞,然后分别加入5 μL Annexin VFITC 和10 μL 碘化丙啶(propidium iodide,PI) 染色液,避光染色20 min。使用流式细胞仪检测并分析细胞的凋亡率。
将细胞收集在1.5 mL 的离心管中,用预冷的PBS 洗涤细胞,用细胞计数器对细胞进行计数,保证每管中细胞数量>106个。去除细胞上清液,并用70%乙醇固定细胞2 h。用预冷的PBS 冲洗掉多余的乙醇后,用细胞周期染色工作溶液对细胞染色30 min。使用流式细胞仪检测细胞周期,并分析处于各周期中细胞的数量。使用FlowJo软件分析所有流式细胞图。
1.3.8 细胞内蛋白质表达水平的检测 为进一步探究多肽PDSORBS2 对H/R 诱导的大鼠心肌细胞凋亡的影响,采用蛋白质免疫印迹(Western blotting,WB)技术检测细胞中的蛋白表达水平。按照各组要求处理细胞后,用细胞刮板将细胞收集在1.5 mL 离心管中。将含有0.1%PMSF 的RIPA 添加到细胞沉淀的离心管中以提取细胞中的蛋白质,按照4∶1 的比例加入5×SDS 上样缓冲液后置于沸水浴中加热10 min。
将上述提取的蛋白样品摇匀并且上样在10%的PAGE凝胶中进行电泳,直至溴酚蓝置底,将PVDF膜用甲醇激活1 min 后进行转膜。转膜结束后将PVDF 膜置于5%的脱脂牛奶中常温下封闭1 h,一抗孵育,4 ℃过夜。次日回收一抗,TBST 洗膜3 次,每次10 min。二抗室温下孵育1 h,TBST 洗膜3次,每次10 min。洗膜结束后用化学发光/荧光图像分析系统进行蛋白条带的曝光,并通过条带的灰度值分析蛋白的表达水平。
1.4 统计学方法
所有定量数据均使用GraphPad Prism 8.0 软件分析,以±s表示。2组间比较使用t检验,多组间比较采用单向方差分析。所有的实验重复3 次以上,P<0.05 表示差异具有统计学意义。
2 结果
2.1 多肽PDSORBS2 对H/R 诱导的H9C2 细胞活性的影响
利用CCK-8 检测细胞的活性。结果显示:随着H/R处理时间的增加,H9C2细胞活性逐渐下降,H/R处理6 h的H9C2 细胞活性下降至空白对照组的50%左右(P=0.000),因此选择H/R 处理6 h 来建立细胞损伤模型(图1A);H9C2细胞的活性与多肽的浓度在50 μmol/L 范围内呈正相关(P=0.000),且50 μmol/L 浓度与100 μmol/L 浓度的多肽PDSORBS2 干预的细胞活性的差异并不显著(P>0.05)(图1B),说明多肽的起效浓度为10 μmol/L,而效果最显著的最低浓度为50 μmol/L。随后验证,PDSORBS2+H/R 组细胞活性远远高于H/R 组的H9C2 细胞活性(P=0.004)(图1C),进一步说明50 μmol/L 浓度的PDSORBS2能够增加H/R诱导的H9C2细胞活性。

图1 多肽PDSORBS2对H/R诱导的细胞活性的影响Fig 1 Effect of PDSORBS2 peptide on cell viability induced by H/R
2.2 多肽PDSORBS2 对H/R 诱导的H9C2 细胞氧化应激损伤的影响
荧光显微镜观察结果显示:NC 组、NC+PDSORBS2组和H/R+PDSORBS2 组的H9C2 细胞,细胞核呈近圆形,且染色质均匀分布,而H/R 组中H9C2 细胞核明显缩小,染色质凝集呈颗粒状分布,说明H/R 诱导H9C2 细胞发生凋亡(图2A)。同时通过酶标仪对细胞内ROS 含量的检测结果显示(图2B),多肽PDSORBS2 的干预明显降低了H/R 诱导的H9C2细胞内ROS 的含量(P=0.005)。这些结果说明多肽PDSORBS2能够减轻H/R诱导的H9C2细胞的氧化应激损伤。
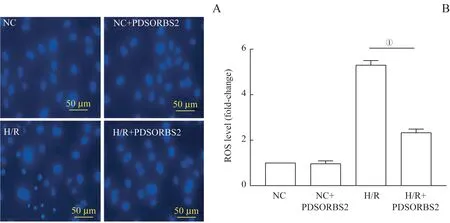
图2 多肽PDSORBS2对H/R诱导的H9C2细胞氧化应激的影响Fig 2 Effect of PDSORBS2 peptide on H/R-induced oxidative stress in H9C2 cells
2.3 多肽PDSORBS2 对H/R 诱导的H9C2 细胞凋亡和细胞周期阻滞的影响
利用流式细胞术分析细胞的凋亡和细胞周期。细胞凋亡检测结果显示:与H/R 组相比,PDSORBS2+H/R 组和NC+PDSORBS 组的细胞凋亡程度显著降低(P=0.000)(图3A、C);细胞周期的分析结果显示:H/R+PDSORBS2 组中处于G1 期的细胞数量明显低于H/R 组中处于G1 期的细胞数量,而处于S 期的细胞数量明显高于H/R 组(P=0.000)(图3B、D)。这些结果提示多肽PDSORBS2 的干预可以降低H/R 诱导的H9C2 细胞的凋亡程度并且可以抑制H/R 诱导的细胞周期阻滞,促进细胞转入S期。
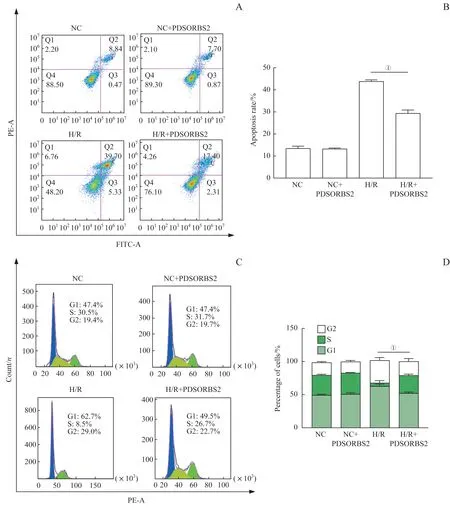
图3 多肽PDSORBS2对H/R诱导的H9C2细胞凋亡和细胞周期阻滞的影响Fig 3 Effect of PDSORBS2 peptide on H/R-induced apoptosis and cell cycle arrest in H9C2 cells
2.4 多肽PDSORBS2 对H/R 诱导的H9C2 细胞凋亡相关蛋白表达水平的影响
WB 检测结果显示(图4):在NC+PDSORBS2 组中, 细胞的促凋亡蛋白(PARP、 Bax 和cleavedcaspase3)的表达量明显低于H/R 组,而Bcl-2 的表达量却明显高于H/R 组(均P<0.05)。该结果提示:与H/R组相比,多肽PDSORBS2 的干预能够下调促凋亡蛋白(PARP、Bax 和cleaved-caspase3) 的表达水平,上调Bcl-2 的表达水平。
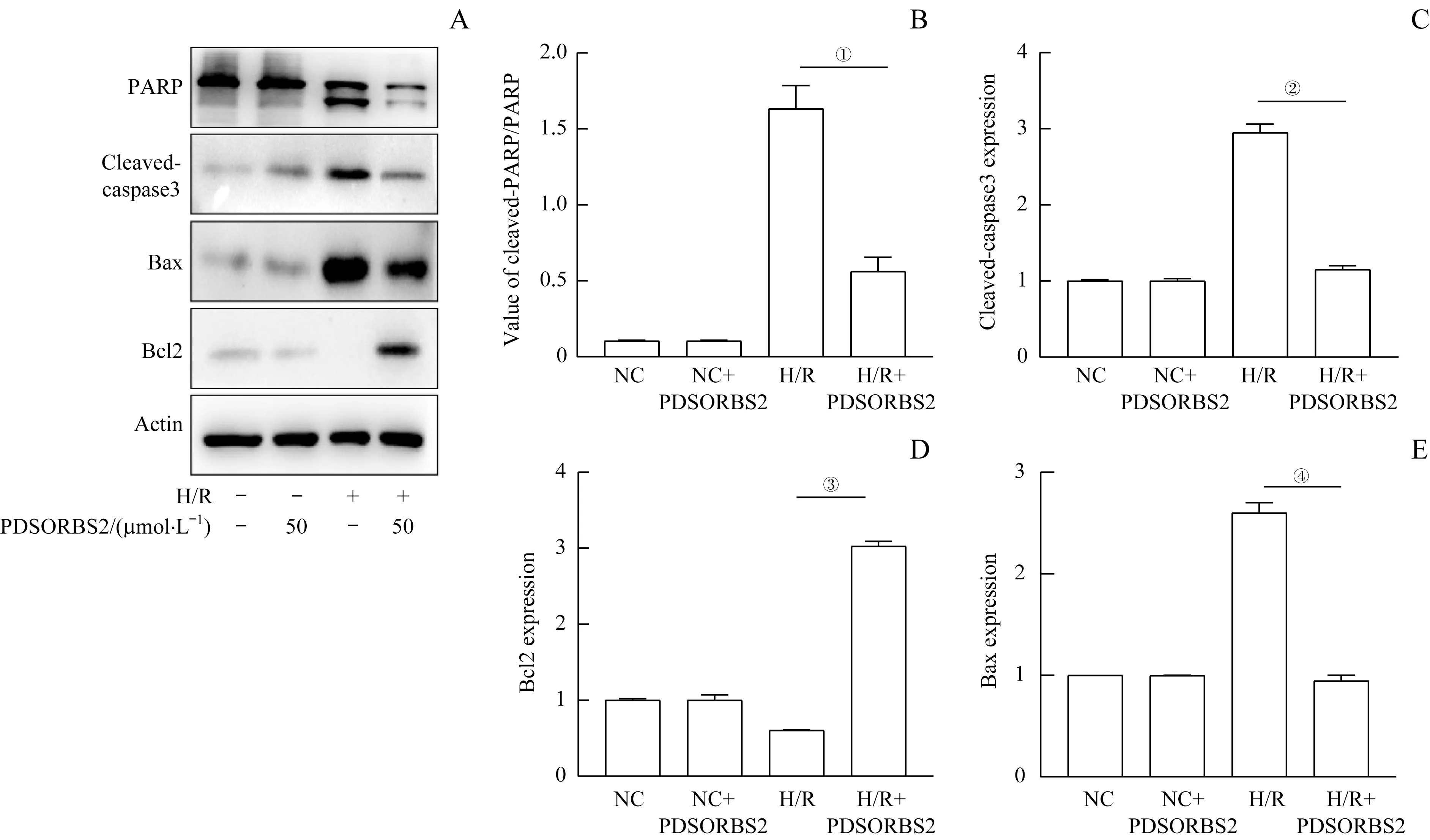
图4 WB检测H9C2细胞中凋亡相关蛋白的表达Fig 4 Detection of the expression of apoptosis-related proteins in H9C2 cells by WB
2.5 多肽PDSORBS2 对H/R 诱导的H9C2 细胞中ERK/AKT/CDK2/p27Kip1蛋白水平的影响
WB 结果显示: H/R+PDSORBS2 组的P-AKT 和P-ERK 的表达量远远高于H/R 组(图5A~C)(均P<0.05),这说明与H/R 组相比,多肽PDSORBS2 的干预能够使P-AKT 和P-ERK 的表达水平增高。此外,在H/R+PDSORBS2 组,CDK2 的表达量明显高于H/R 组,而p27Kip1的表达量却明显低于H/R 组(图5D~F)(均P<0.05)。
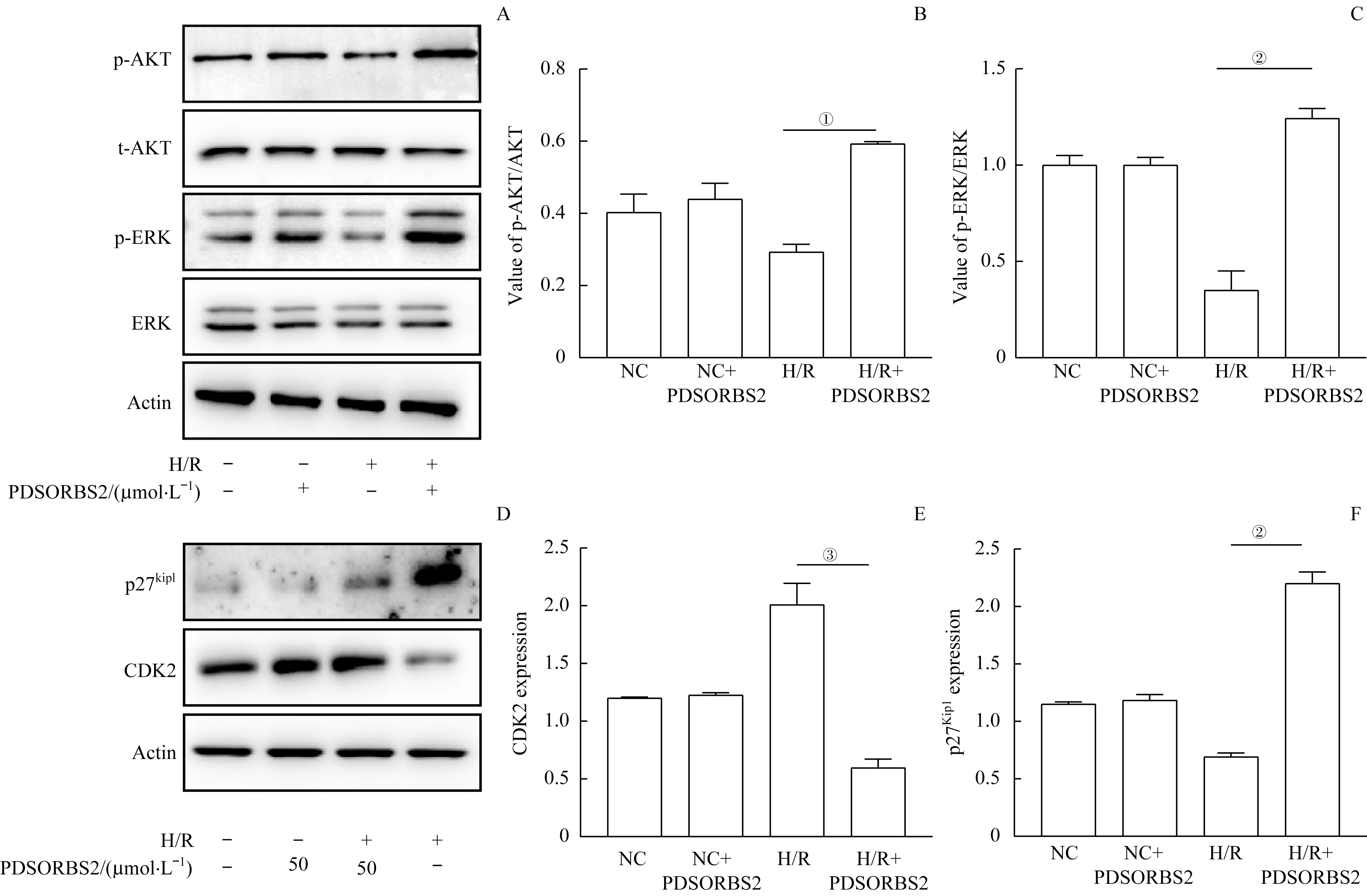
图5 多肽PDSORBS2对H/R诱导的H9C2细胞中ERK/AKT/CDK2/p27Kip1蛋白水平的影响Fig 5 Effect of PDSORBS2 peptide on the protein levels of ERK/AKT/CDK2/p27Kip1 in H9C2 cells induced by H/R
3 讨论
由I/R 损伤引起的心肌损伤目前仍然是医学界尚需攻克的难题之一[22]。因此,如何有效地预防心肌I/R 损伤依然能够令研究人员产生浓厚的兴趣。在本研究的前期工作中,我们在梗死后大鼠心肌细胞中,发现了一条表达上调肽为PDSORBS2。并且,目前尚无文献报道关于多肽PDSORBS2 是否能够对H/R 诱导的心肌细胞损伤产生保护作用。因此,我们通过H/R 诱导H9C2 细胞损伤建立体外H/R 损伤模型,并在体外实验中进行了关于多肽PDSORBS2 对于H/R 诱导的心肌细胞损伤的功能研究。
在本研究中,通过CCK-8、流式细胞术以及对凋亡相关蛋白的WB 分析,我们发现多肽PDSORBS2 不仅能够增加H/R 诱导的H9C2 细胞的活性,还能够降低H/R 诱导的H9C2 细胞内ROS 的含量,并且抑制H/R 诱导的H9C2 细胞凋亡程度和细胞周期阻滞。此外,根据细胞活力值,我们观察到多肽PDSORBS2 的起始有效浓度为10 μmol/L,但是在50 μmol/L时效果达到最佳。起效浓度并不是特别低,并且只采用50 μmol/L 的浓度进行了后续的实验,这是本实验的一些不足之处。10 μmol/L 的起效浓度可能与多肽的不稳定性有关,未来仍然需要我们探索,对多肽进行进一步的修饰以加强肽的稳定性;并且,也需要研究不同浓度的多肽PDSORBS2 对H/R 诱导的不同心肌细胞的影响,以进一步验证多肽PDSORBS2 的心脏保护功能。
作为MAPK 的一个亚家族成员,ERK 途径还参与了多种细胞应答的调节[23]。ERK 途径的激活参与了心肌细胞的增殖和存活过程[24],对于保护心肌细胞免受缺氧诱导的细胞凋亡至关重要[25]。AKT 信号通路是细胞存活的关键因素,AKT 通路的激活能够减轻心脏局部缺血引起的心肌细胞凋亡和心脏功能障碍[26]。有研究已经发现ERK/AKT 通路的激活可以减轻H/R 诱导的细胞损伤,这意味着ERK/AKT 信号通路的激活可能参与心肌细胞在I/R过程中的修复过程,能够对抗心肌细胞的异常凋亡[27]。因此,我们猜想由心肌细胞分泌的多肽PDSORBS2 可能会通过影响ERK/AKT 通路的激活来减少心肌细胞的凋亡。在本研究中,WB 检测结果显示,与NC 组相比,H/R 诱导的H9C2 细胞的P-ERK、P-AKT 的表达水平显著降低,而多肽PDSORBS2 的干预使P-ERK、P-AKT 的表达水平明显高于H/R组。这些数据表明:H/R可能会通过抑制ERK/AKT 的激活来诱导大鼠心肌细胞的凋亡,而多肽PDSORBS2 的干预可能会通过促进ERK/AKT 的激活来抑制H/R诱导的H9C2细胞的凋亡。
CDK2的激活是细胞凋亡和细胞周期途径中的关键结合点,它可以促进细胞从G1 期转入到S 期[28],抑制CDK2 的激活可将细胞阻滞在G0/G1 期并诱导细胞凋亡[29]。p27Kip1是一种细胞周期蛋白依赖性激酶抑制剂,抑制其活性有利于CDK2 的及时激活,能够诱导细胞从G1期进入到S期[30]。此外,ERK 途径的激活能够通过下调p27Kip1、上调CDK2 来促进H9C2 细胞周期的进程,从而抑制心肌细胞的凋亡[31]。在本研究中我们发现:与NC组相比,H/R组CDK2的表达量明显下降,p27Kip1的表达量明显上升;而多肽PDSORBS2 的干预使CDK2 的表达水平显著增高,使p27Kip1的表达水平明显降低。这些结果说明多肽PDSORBS2 可能会通过调节CDK2/p27Kip1途径来抑制H/R 诱导的细胞周期阻滞,加快细胞周期的进程,进而减轻H9C2细胞的凋亡程度。
综上所述,本研究结果表明,多肽PDSORBS2 可能是通过ERK/AKT/CDK2/p27Kip1的信号通路减少H/R 刺激下H9C2 细胞内ROS 的产生,从而抑制了由H/R 引起的H9C2 细胞的异常凋亡,进而产生心肌细胞保护作用。该结果为PDSORBS2成为一种心肌保护肽提供了实验依据。但是本研究仅在体外探究了多肽PDSORBS2 对H/R 诱导的心肌细胞损伤的影响,关于多肽PDSORBS2 在体内是否能对I/R 诱导的心肌损伤产生保护作用,仍需进一步研究。随着研究的不断深入,多肽PDSORBS2 或许有望为临床上I/R损伤的治疗提供新的方向。

