特发性中枢性性早熟女童血清不饱和游离脂肪酸谱的变化及其与体质量指数、性激素水平的相关性分析
黎琳琳,胡韶华,尹小琴,李 嫔
1.上海交通大学附属儿童医院/上海市儿童医院内分泌科,上海 200062;2.上海交通大学附属儿童医院/上海市儿童医院检验科,上海 200062
青春期是儿童从幼年到成人的一个过渡时期,受遗传、神经内分泌、营养状况、环境内分泌干扰物等多种因素的影响,是一个复杂的、互相协调的生理过程[1]。性早熟是指女童在8 岁前、男童在9 岁前出现第二性征发育[2],为儿童常见的内分泌疾病之一。目前,根据下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis,HPGA)功能提前启动的发病机制,将性早熟分为中枢性性早熟(central precocious puberty,CPP)、部分性性早熟和外周性性早熟三大类,其中CPP 以女童居多。根据病因,又将CPP 分为特发性CPP (idiopathic central precocious puberty,ICPP)和继发性CPP[2]。大量流行病学研究[3-5]发现:肥胖儿童普遍存在青春期提前发育,与性早熟有密切的关系,而女童比男童表现得更为显著,这可能严重影响儿童的身心健康。
目前,在肥胖的评价体系中,体质量指数(body mass index,BMI)是最常用的评价指标,在一定程度上能反映全身脂肪的比例,广泛应用于肥胖与性发育的相关研究[6]。BMI 可在一定程度上反映机体的营养状态;然而,虽然其特异度高,但灵敏度较差,只反映了体内脂肪的堆积,并不能准确判断身体内脏脂肪具体成分含量的变化。因此,BMI 不能更具体地反映营养状态对儿童青春期性发育的影响[7-8]。
脂肪摄入量是儿童营养评估的一个重要指标,分解后形成的脂肪酸参与机体的能量代谢。游离脂肪酸(free fatty acids,FFA)是非酯化的脂肪酸,按碳氢键是否饱和,将FFA 分为饱和游离脂肪酸和不饱和游离脂肪酸,其中不饱和游离脂肪酸按脂肪酸分子结构中碳原子间双键的数目分为单不饱和脂肪酸(monounsaturated fatty acids,MUFA) 和多不饱和脂肪酸(polyunsaturated acids,PUFA)[9]。不饱和游离脂肪酸依据第1 个双键距离甲基端碳原子数不同分为“n-3”“n-6”“n-7”“n-9”4个系列。不饱和游离脂肪酸是体内重要的营养物质,多方面参与体内的生理功能,对人体健康起着十分重要的作用[9-10]。多项流行病学研究[7,11-12]表明脂肪摄入量与女孩初潮时间具有相关性,脂肪摄入量越高,女童的初潮时间越早。Maclure等[13]研究表明,213名美国女童在10岁时摄入较高的n-3 PUFA 与其初潮提前有关。Rogers等[14]观察了3 298 名3 岁和7 岁英国女童,发现PUFA 摄入量增多,初潮提前的风险随之增加,但女童的初潮时间与总脂肪、MUFA 的摄入量无关。Moisan等[15]研究也显示,女童在9.5~12.5岁时,MUFA摄入量较高,月经初潮延迟。由此可见,不饱和游离脂肪酸与女童青春期性发育具有相关性,但目前结论不一;而且,不同种类的脂肪酸可产生不同的作用效果(月经初潮提前或者延迟),具体作用机制仍需进一步研究。
本研究通过检测ICPP 女童的血清不饱和游离脂肪酸谱,分析其变化及其与BMI、性激素的相关性;在促性腺激素释放激素类似物(gonadotropin releasing-hormone analogues,GnRHa)治疗的随访研究中,观察治疗3个月后ICPP 女童血清不饱和游离脂肪酸谱的变化,为探究不饱和游离脂肪酸与性早熟的关系提供依据。
1 对象与方法
1.1 研究对象
选取2020 年8 月—2021 年1 月上海交通大学附属儿童医院收治入院的行促黄体激素释放激素(luteinizing hormone releasing hormone,LHRH)激发试验的6~9岁性早熟女童为研究对象。根据CPP 的诊断标准[2],56 例ICPP 女童纳入ICPP 组,平均年龄(8.28±0.59)岁。选取同期在该院体检的同龄健康未发育女童46 例为对照组,平均年龄(8.23±1.45)岁。经评估,对接受GnRHa 治疗的ICPP 女童进行3 个月随访;最后纳入随访研究的有48例,平均年龄(8.33±0.63)岁。
研究对象排除标准:①外源性、继发性性早熟及继发性CPP。②既往和近期诊断的慢性或重大系统性疾病(如严重的心、脑、血管、肝、肾等器质性疾病)。③合并糖尿病、恶性血液系统疾病、肿瘤、精神疾病及甲状腺功能异常。④近期服用过激素药物、减肥药物、降血糖或降脂药物、干扰HPGA 的药物。⑤临床资料不完整,未规律使用GnRHa或失访。
本研究通过医院伦理委员会批准(审批号:2020R153-E01),所有检查均经患儿家属知情同意。
1.2 基本资料收集
收集ICPP 组和对照组女童的年龄、身高、体质量,计算BMI、BMI 标准差评分(body mass index standard deviation score,BMI SDS)。
1.3 实验室检测
1.3.1 LHRH激发试验 ICPP组女童在上午8时行LHRH激发试验(2.5 μg/kg,最大剂量不超过100 μg),分别于0、30、60、90 min 采集静脉血各2 mL。所有血标本静置30 min 后于1 000×g的离心机离心10 min,分离血清,检测性激素水平,同时留取血清约1 mL,放置-80 ℃冰箱待测。通过贝克曼库尔特全自动化学发光免疫分析仪DX1800(贝克曼库尔特商贸有限公司,中国)检测血清黄体生成素(luteinizing hormone,LH)和促卵泡生成激素(follicle stimulating hormone,FSH)的基础值和峰值以及雌二醇(estradiol,E2)水平。通过西门子医疗诊断化学发光分析仪IMMULITE 2000(国润医疗供应链服务有限公司,中国)检测性激素结合球蛋白(sex hormonebinding globulin,SHBG)、胰岛素样生长因子-1(insulinlike growth factor-1,IGF-1)水平。对照组女童在相同时间段内采集空腹静脉血2 mL,分离并留取血清1 mL,放置-80 ℃冰箱待测。分离后的待测血清经有机试剂提取总脂、转化液进行衍生处理后,由检验科专业质谱室检测员采用液相色谱-串联质谱仪(日本岛津LC-MS/MS-8040cL)测定,分别检测2组女童11种血清不饱和游离脂肪酸的浓度,包括棕榈油酸(palmitoleic acid,PA,C16:1n-7)、油酸(oleic acid,OA,C18:1n-9)、巨头鲸鱼酸(gondoic acid,C20:1n-9)、亚油酸(linoleic acid,LA,C18:2n-6)、γ-亚麻酸(γ-linolenic acid,GLA,C18:3n-6)、花生四烯酸(arachidonic acid,AA,C20:4n-6)、n-6二十二碳五烯酸(n-6 docosapentenoic acid,n-6DPA,C22:5n-6)、α-亚麻酸(α-linolenic acid,ALA,C18:3n-3)、二十碳五烯酸(eicosapentaenoic acid,EPA,C20:5n-3)、n-3 二十二碳五烯酸(n-3 docosapentenoic acid,n-3DPA,C22:5n-3)、二十二碳六烯酸(docosahexaenoic acid,DHA,C22:6n-3),试剂、标准品及质控品均来源于广州可利医疗器械有限公司。
1.3.2 GnRHa 治疗后检测 对接受GnRHa 治疗的48 例ICPP 女童随访3 个月后,在空腹状态下,于GnRHa 注射1 h 后采集研究对象的静脉血2 mL,1 000×g离心10 min后留取血清,放置-80 ℃冰箱待检测血清不饱和游离脂肪酸谱浓度。
1.4 统计学方法
应用Excel 2010 软件录入数据,采用SPSS 20.0 软件进行统计学分析,采用GraphPad Prism 8.0.2 作图。定量资料符合正态分布者用±s表示,2 组间均数比较采用独立样本t检验;非正态分布者采用M(Q1,Q3)表示,2组间比较采用非参数Mann-Whitney 秩和检验。符合正态分布的双变量相关采用Pearson 相关分析,非正态分布者采用Spearman相关分析,控制相关变量采用偏相关分析,相关系数用r表示。对血清不饱和游离脂肪酸谱与各项指标的关系采用多元逐步回归分析。对治疗前后2组数据符合正态分布者采用配对t检验,不符合正态分布者采用Wilcoxon检验。P<0.05表示差异有统计学意义。
2 结果
2.1 2组女童一般临床资料比较
2 组女童的年龄比较,差异无统计学意义(P>0.05);但ICPP 组女童的身高、体质量、BMI、BMI SDS 明显高于对照组,差异具有统计学意义(均P<0.05)(表1)。
表1 2组女童一般临床资料的比较(±s)Tab 1 Comparison of general clinical data of the two groups(±s)
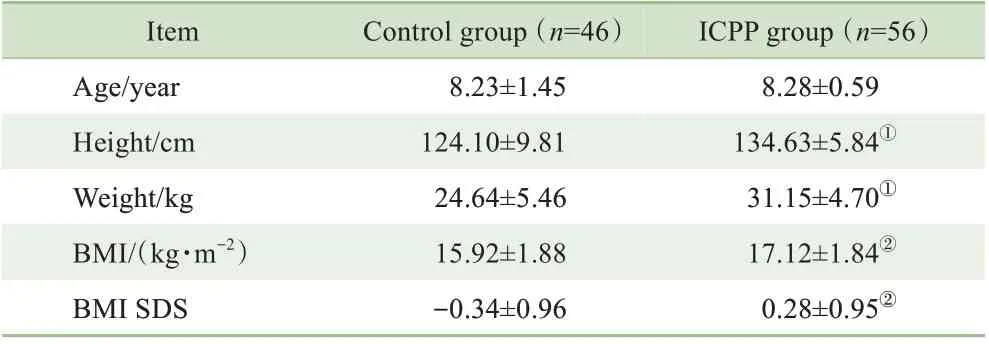
表1 2组女童一般临床资料的比较(±s)Tab 1 Comparison of general clinical data of the two groups(±s)
Note: ①P=0.000, ②P=0.001,compared with the control group.
ICPP group(n=56)8.28±0.59 134.63±5.84①31.15±4.70①17.12±1.84②0.28±0.95②Item Age/year Height/cm Weight/kg BMI/(kg·m-2)BMI SDS Control group(n=46)8.23±1.45 124.10±9.81 24.64±5.46 15.92±1.88-0.34±0.96
2.2 2组女童血清不饱和游离脂肪酸谱比较
与对照组相比,ICPP 组n-6 PUFA 类的AA、n-6DPA,n-3PUFA 类的n-3DPA、EPA、DHA,总n-6PUFA含量明显低于对照组,差异具有统计学意义(均P<0.05);而2 组MUFA 类的C16:1、C18:1、C20:1,PUFA类的LA、GLA、ALA,总n-3PUFA 及Tn-6/Tn-3PUFA 比值比较,差异无统计学意义(均P>0.05)(图1)。
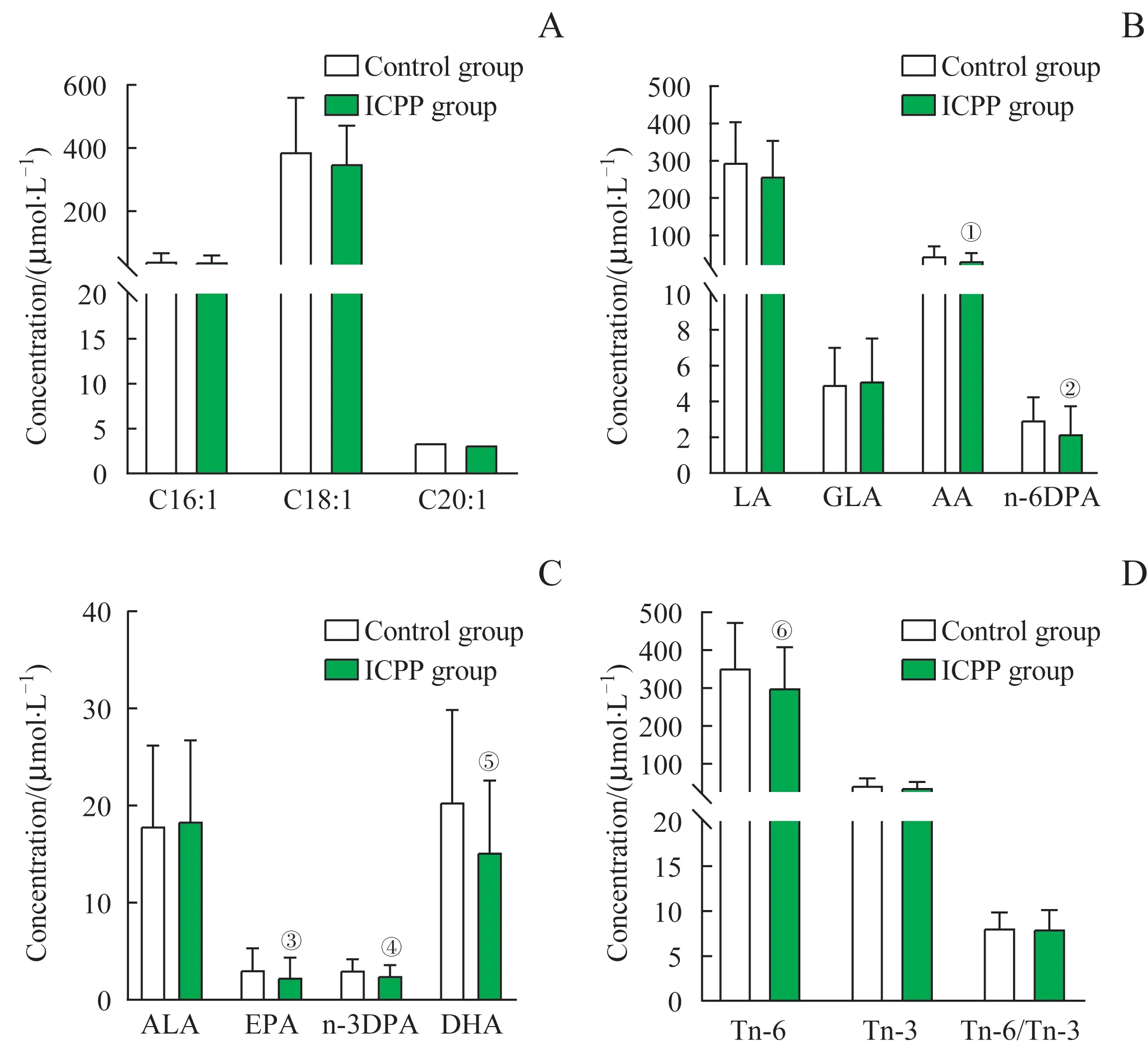
图1 2组女童血清不饱和游离脂肪酸谱比较Fig 1 Comparison of serum unsaturated free fatty acid profiles of the two groups
2.3 血清不饱和游离脂肪酸谱与BMI的相关性
经双变量Spearman 相关性分析,2 组女童的BMI 与不饱和游离脂肪酸谱均无相关性(均P>0.05)(表2)。
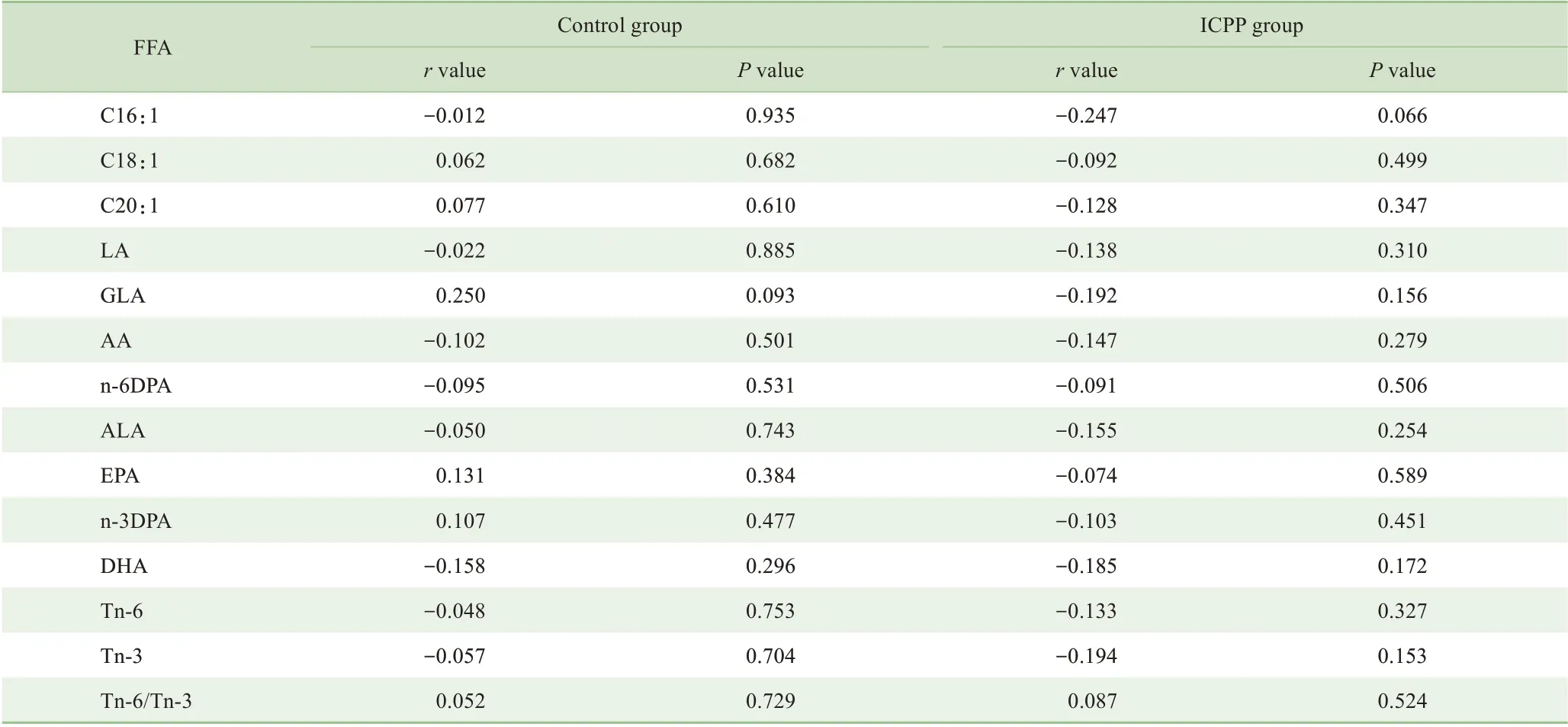
表2 2组女童不饱和游离脂肪酸谱与BMI的相关性Tab 2 Correlation of unsaturated free fatty acid profiles and BMI in the two groups
2.4 ICPP女童血清不饱和游离脂肪酸谱与性激素的相关性
控制BMI后,偏相关分析结果显示(表3):LH基础值(basic vaule of LH,LHB)与EPA、DHA 呈负相关;FSH 基础值(basic vaule of FSH,FSHB) 与EPA、n-3DPA、DHA、总n-3PUFA 呈负相关,而与Tn-6/Tn-3 比值呈正相关;LHB/FSHB与EPA呈负相关,而与Tn-6/Tn-3 比值呈正相关;LH 峰值(peak vaule of LH,LHP)与C18:1、C20:1、LA、GLA、ALA、总n-6PUFA均呈正相关;LHP/FSH 峰值(peak vaule of FSH,FSHP)与ALA呈正相关;E2与EPA、n-3DPA、DHA、总n-3PUFA 均呈负相关,而FSHP、SHBG、IGF-1与各游离脂肪酸指标均无相关性(均P>0.05)。

表3 ICPP女童血清不饱和游离脂肪酸谱与性激素的相关性(r)Tab 3 Correlation between serum unsaturated free fatty acid profiles and sex hormones in ICPP girls(r)
以性激素为因变量,相关的游离脂肪酸为自变量,进行多元逐步回归分析,结果显示(表4),n-3PUFA 主要与ICPP 女童体内性激素的基础水平相关:在控制其他因素的情况下,DHA 水平升高,而LHB 的水平呈下降趋势;n-3DPA 水平升高,FSH、E2基础值水平亦呈下降趋势;n-6/n-3 比值增大或ALA 水平升高,FSHB 及LHP 水平呈现升高趋势。
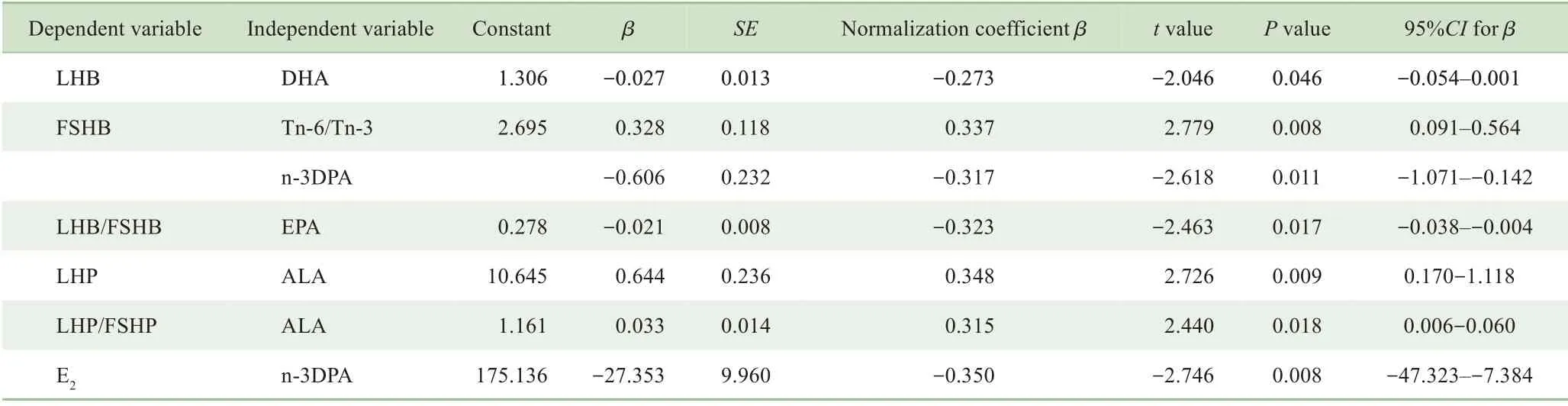
表4 ICPP女童血清不饱和游离脂肪酸谱与性激素的多元回归分析Tab 4 Multiple regression analysis of serum unsaturated free fatty acid profiles and sex hormones in ICPP girls
2.5 ICPP 女童GnRHa 治疗3 个月前后血清不饱和游离脂肪酸的比较
经3 个月治疗后,ICPP 女童C16:1、C18:1、C20:1、LA、GLA、ALA 水平明显下降(均P<0.05),而AA、EPA、DHA水平较治疗前明显升高(均P<0.05)(表5)。
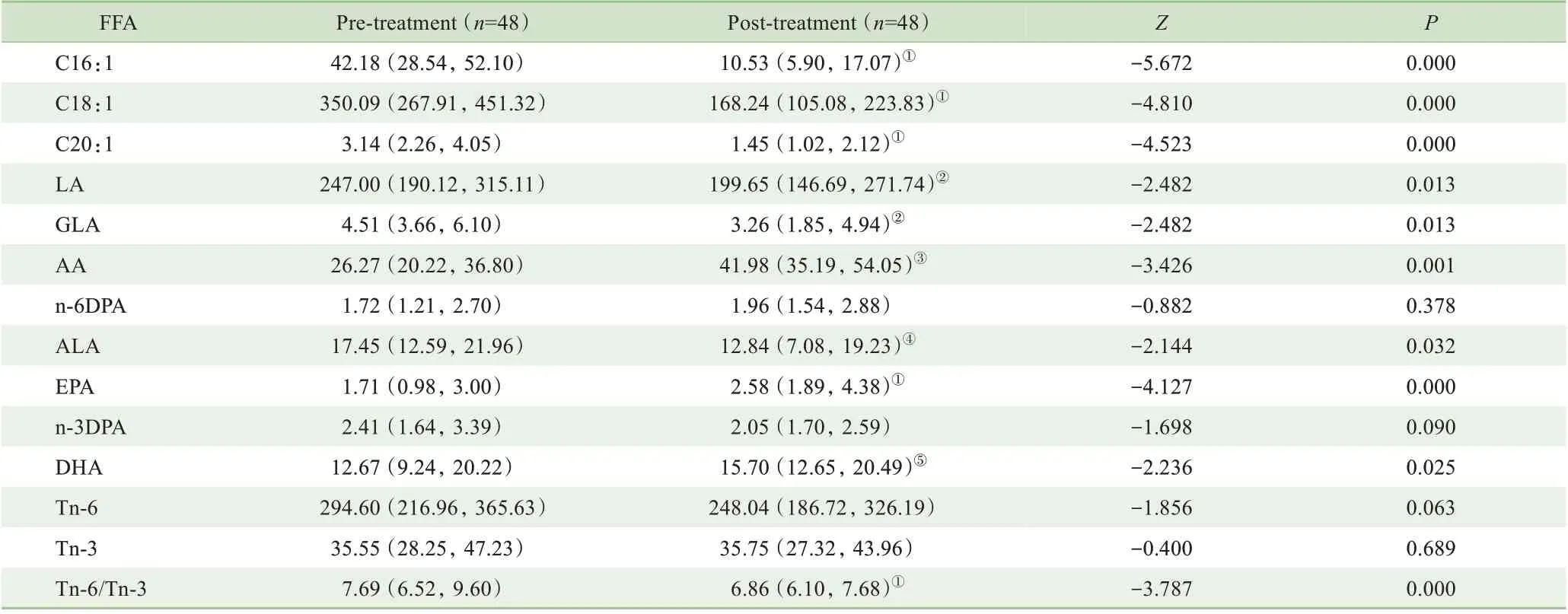
表5 ICPP女童GnRHa治疗前后血清不饱和游离脂肪酸谱的变化[μmol·L-1,M(Q1,Q3)]Tab 5 Changes of serum unsaturated free fatty acid profiles in ICPP girls before and after GnRHa treatment[μmol·L-1,M(Q1,Q3)]
3 讨论
不饱和脂肪酸是体内脂肪代谢重要的营养物质,参与体内多种生理功能。一方面,不饱和脂肪酸有调节血脂、抗炎、抗肿瘤、提高免疫力、预防心血管疾病及治疗精神性疾病等多种功能;另一方面,n-3PUFA 特别是EPA、DHA 对中枢神经系统、视网膜、皮肤等组织的正常发育具有重要作用[10-11]。研究[16]显示,n-3PUFA 摄入减少或与n-6PUFA 比例失调是心血管系统疾病、糖尿病、肥胖症、癌症、免疫性疾病及神经退行性疾病等多种慢性非传染性疾病发生的高危因素之一,通过改变膳食结构可降低上述疾病的风险;脂肪酸代谢水平与某些疾病的发生具有相关性,成为诊断疾病的生物学标志物,为诊治疾病提供了新方向。由此可见,对性早熟的脂肪酸谱组成及相关性进行研究,可为进一步阐述性早熟的发生机制提供依据。
早期研究结果显示ICPP 女童的BMI 较正常组女童偏高,但是性发育程度与BMI 无相关性;进一步的动物研究实验发现性发育与营养状态相关[17]。本研究结果也显示ICPP 女童的BMI 明显高于正常对照组。与对照组相比,ICPP女童的MUFA(C16:1、C18:1、C20:1)水平及必需脂肪酸(LA、ALA)水平未见明显变化,而LA、ALA 衍生的脂肪酸水平降低,提示ICPP 可能与PUFA 水平降低有关。临床研究及动物实验[18-19]显示,肥胖与大脑组织尤其是下丘脑的慢性炎症具有相关性;而n-3PUFA 可抑制体内慢性炎症,故可防治肥胖症及相关疾病。由此可推测,ICPP 女童普遍存在超重和肥胖,可能与PUFA水平下降有关。但本研究中,各种不饱和游离脂肪酸水平与BMI均无相关性。
本研究进一步分析了血清不饱和脂肪酸谱与性激素的相关性,结果显示不饱和游离脂肪酸与ICPP 女童体内性激素水平相关。C18:1、C20:1、LA、GLA、ALA、总n-6PUFA 水平与LHP 呈正相关;而EPA、DHA、n-3DPA、总n-3PUFA 水平与LH、FSH、E2 基础值呈负相关,总n-6PUFA/总n-3PUFA比值与LH、FSH、E2基础值呈正相关。因此推测,以上指标变化可能成为性发育提前的因素之一。进一步的随访结果显示ICPP 女童经GnRHa 治疗3 个月后,C16:1、C18:1、C20:1、LA、GLA、ALA 水平及总n-6PUFA/总n-3PUFA 比值下降,而EPA、DHA 水平明显升高,验证了体内不饱和游离脂肪酸谱与体内性激素变化的相关性。
PUFA 参与青春期性发育的机制可能与瘦素(leptin)和神经激肽B(kisspeptin)及其受体激活的相关通路有关[20-21]。n-3PUFA 尤其是EPA、DHA 对神经系统发育具有重要作用,它们可以通过改变脑细胞膜的流动性、膜结合酶的活性、受体的数量和亲和力、离子通道的功能、神经递质的产生和活性修饰作用以及神经递质和神经元生长因子的活性信号转导通路等作用机制对脑功能实施调控[7]。下丘脑促性腺激素释放激素(gonadotropin releasing-hormone,GnRH)神经元被激活是青春期启动的关键步骤。神经内分泌、营养状况、遗传因素等在不同程度上可影响GnRH神经元的激活和GnRH的释放。我们的早期研究[17,22-23]结果显示,雌鼠的性发育与哺乳期营养状态有重要的关系。肥胖的雌鼠性发育明显提前,营养不良即消瘦的雌鼠性发育明显延迟;在青春期发育时Kiss-1、GPR54基因表达明显增高,由此可得知Kiss-1、GPR54可能是诱导雌鼠性发育的关键。研究[24]还显示,早期肥胖会增强SPTLC1基因在下丘脑视旁核的表达,使神经酰胺合成增加,并促进卵巢去甲肾上腺素能系统的成熟,最终可导致性早熟;而通过阻断神经酰胺的合成可以延迟青春期,阻止神经激肽B的作用,逆转肥胖导致的青春期提前,进一步揭示了性早熟与肥胖关系的作用机制。
不饱和脂肪酸可通过直接影响类固醇生成机制及乳腺发育对青春期发育实施调控。研究[25]表明,PUFA 通过影响下丘脑-垂体-肾上腺(hypothalamus-pituitaryadrenal,HPA)轴发挥作用,调节肾上腺类固醇生成并作用于类固醇生成相关的转录因子。这些转录因子会影响类固醇急性调节蛋白的表达,提高芳香酶的活性和游离性类固醇水平,从而刺激GnRH 的释放[7]。体外研究[25]显示,n-3PUFA 可使雌鼠乳房发育延迟,延缓青春期启动。而当体内n-6PUFA水平升高,或n-6/n-3比例升高时,雌激素水平升高,乳房发育提前,罹患乳腺癌风险增加[26]。另外,有研究[27]显示,油酸作为MUFA 的主要成员,可以通过刺激乳腺发育和增加血清IGF-1含量影响青春期发作。本研究结果显示,ICPP 女童n-3PUFA 及n-6PUFA 水平呈下降趋势,而性激素水平升高,可能是通过以上机制参与性发育的启动。不同的脂肪酸,作用机制可能不一样,其与性激素水平的关系,有待更多的机制研究进一步阐明。
综上所述,本研究结果表明,性发育及GnRHa 治疗可影响ICPP 女童体内不饱和游离脂肪酸的代谢,初步揭示了PUFA 与性发育的关系。本研究仍存在一定的局限性:首先,本研究为单中心的研究,样本量偏小,随访时间短,仅分析了部分不饱和游离脂肪酸与性激素的变化关系,其相互影响的机制仍需要进一步的前瞻性研究进行验证;其次,不饱和游离脂肪酸谱的影响因素众多,如儿童的饮食习惯、运动、发育状态等都可能使脂肪酸谱发生变化,肥胖及超重儿童在治疗后可能调整了饮食习惯及生活方式,需要做进一步的调查。

