睡眠时间与糖尿病性视网膜病变风险关系的meta分析
刘 洁,谢新民,支雪梅,陆静毅
1.上海交通大学医学院图书馆,上海 200025;2.上海交通大学附属第六人民医院内分泌代谢科,上海市糖尿病临床医学中心,上海市糖尿病研究所,上海市糖尿病重点实验室,上海 200233
糖尿病是全球十大死亡原因之一,给个人和社会带来了沉重的负担。据国际糖尿病联盟[1]数据推测,到2045 年全球将有7 亿糖尿病患者。我国糖尿病患病率由1980 年的不足1.0%上升至现在的12.8%,估计患者数量高达1.3 亿[2-3],其中以2 型糖尿病(type 2 diabetes mellitus,T2DM)为主。糖尿病性视网膜病变(diabetic retinopathy,DR)为一种微血管病变,是相关患者主要的致盲原因[4]。近30 年来,我国DR 患病率上升了4倍[5]。多数患者在确诊糖尿病10~15 年后会发生DR[6]。早期进行干预可有效阻止DR 的发生与发展,其中生活方式干预是最经济有效的措施[7]。有研究[8]发现睡眠时间与T2DM 的发病风险呈“U”型关系,但其对DR 的影响尚存在争议。因此,本研究根据系统评价和meta 分析首选报告的条目(Preferred Reporting Items for Systematic Reviews and Meta Analyses,PRISMA)指南对公开发表的关于睡眠时间和DR 风险的观察性研究进行meta 分析,评价睡眠时间与DR 风险的关系,以期为DR 的预防和干预提供循证医学证据。
1 资料与方法
1.1 检索策略
计算机检索Embase、Cochrane Library、PubMed、Web of Science、中国生物医学文献数据库(SinoMed)、中国知网(China National Knowledge Infrastructure,CNKI)、万方数据知识服务平台和维普数据库(VIP),检索时间从各数据库建库至2021 年4 月。英文检索词包括“sleep”“sleep duration”“sleep amount”“sleep time”“sleeping habit”“quantity of sleep”“diabetic retinopathy”“retinal diseases”,中文检索词包括“睡眠时间”“睡眠时长”“糖尿病性视网膜病变”。
1.2 文献纳入与排除标准
纳入标准:①研究对象为T2DM 患者。②研究类型为观察性研究,含队列研究、病例对照研究和横断面研究。③暴露因素为睡眠时间,包括长睡眠时间和短睡眠时间。④结局指标包括多因素校正后的比值比(odds ratio,OR)及95%置信区间(confidence interval,CI)。⑤基于同一研究人群的不同报道,纳入样本量最大的文献。
排除标准:①中、英文以外语言。②无法提取或计算效应量的研究。③联系原文作者未回应或不能提供可供meta分析数据的研究。
1.3 文献筛选、质量评价及数据提取
由2名研究者独立检索、提取并筛选文献,之后相互核对,对存在分歧的文献提供给第3位研究者分析决定是否纳入。采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)评价纳入研究的质量,得分7~9 分为研究质量高,5~6分为质量中等,≤4分为质量低。提取的数据包括第一作者、研究地区、发表时间、研究类型、样本量、年龄、睡眠时间评估方法、睡眠时间分组、结局指标、校正混杂因素。
1.4 结局与暴露
研究对象的睡眠时间通过访视调查或问卷填写的方式获得,DR 均由眼科医师阅读眼底照片或进行间接眼底镜检诊断。在所纳入的研究中,对睡眠时间的分组和定义不完全一致,其中对短睡眠时间的定义为夜间或24 h睡眠时间≤5 h或<6 h,对长睡眠时间的定义为夜间或24 h睡眠时间≥8 h或≥9 h,睡眠参照时间多为夜间或24 h睡眠时间6~8 h。
1.5 统计学方法
使用R 4.0.4软件进行统计学分析。采用OR值进行效应评价,并计算95%CI。用I2统计值检验和Q检验对研究的异质性进行分析。当I2≤50%且P≥0.1 时,表明各研究间异质性无统计学意义;当I2>50%且P<0.1 时,表明研究间存在统计学异质性。采用敏感性分析判断合并结果的稳定性和可靠程度。采用亚组分析探究研究异质性来源以及不同亚组中睡眠时间和DR 风险的关系。采用漏斗图对称性判断、Begg's 法和Egger's 法对发表偏倚进行检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 文献筛选结果
共检索出文献1 146篇,其中英文文献1 044篇,中文文献102篇。剔重后获得文献846篇,通过阅读标题和摘要共剔除822篇文献,阅读全文后最终纳入5篇文献(图1),共5 627例研究对象。研究人群分别来自中国[9]、韩国[10]、新加坡[11]、印度[12-13]、马来西亚[13]。纳入研究的文献的基本特征如表1所示。
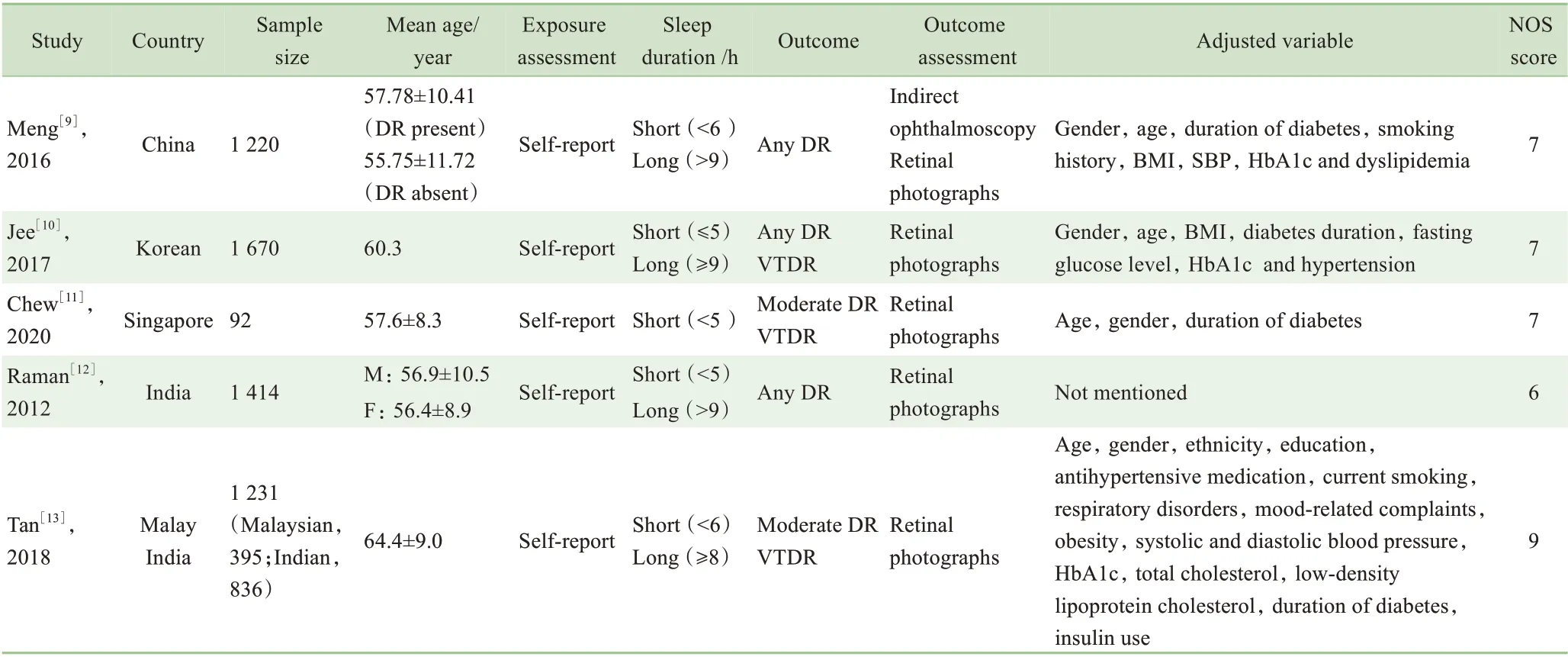
表1 纳入的研究的基本情况Tab 1 Characteristics of the included studies
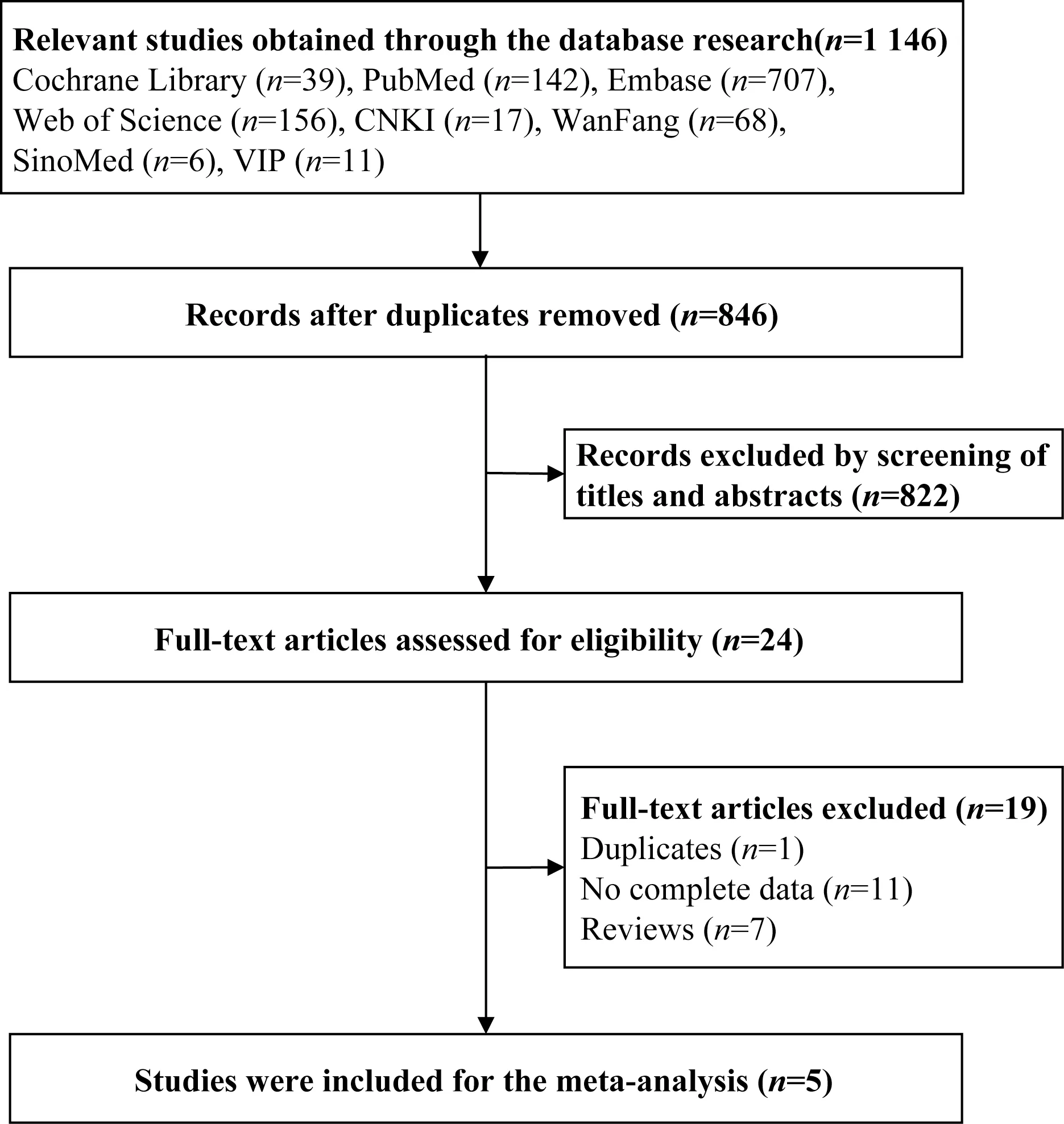
图1 文献筛选流程图Fig 1 Flow diagram of literature screening
2.2 统计分析结果
2.2.1 长睡眠时间与DR 风险 纳入的3 篇文献[9-10,12]提供了长睡眠时间组和对照组T2DM 患者发生DR 的OR值及其95%CI。异质性检验结果提示各研究间无统计学异质性(I2=0%,P=0.41)。Meta分析结果显示:固定效应模型OR=2.05,95%CI1.37~3.05;随机效应模型OR=2.05,95%CI1.37~3.05;提示与正常睡眠时间患者相比,长睡眠时间患者患DR的风险增加105%(图2A)。仅1篇文献[13]报道了长睡眠时间与中度DR 的关系:其中马来西亚人群OR=3.55,95%CI1.43~8.93;印度人群OR=1.49,95%CI0.74~2.93;总人群OR=2.03,95%CI1.24~3.29。纳入的2篇文献[10,13]提供了长睡眠时间组和对照组威胁视力的糖尿病视网膜病变(vision-threatening diabetic retinopathy,VTDR)的OR值及95%CI。异质性检验结果提示各研究间无统计学异质性(I2=18%,P=0.29)。Meta 分析结果显示:固定效应模型OR=1.76,95%CI1.06~2.90;随机效应模型OR=1.72,95%CI0.98~3.02(图2B)。
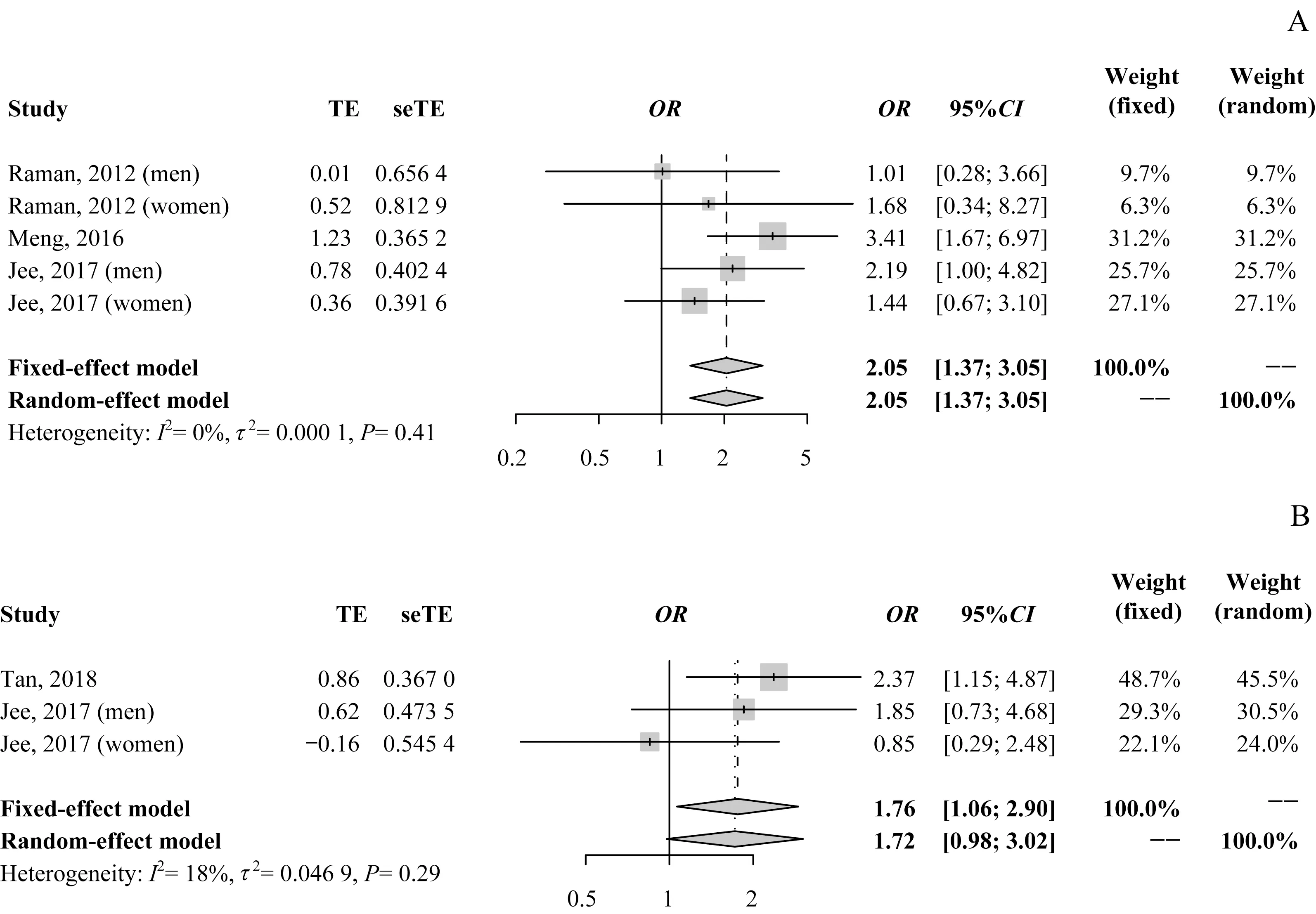
图2 长睡眠时间与DR风险的meta分析森林图Fig 2 Forest plot and meta analysis of long sleep duration and the risk of DR
2.2.2 短睡眠时间与DR 风险 纳入的3 篇文献[9-10,12]提供了短睡眠时间组和对照组T2DM患者发生DR风险的OR值及其95%CI。异质性检验结果提示各研究间无统计学异质性(I2=40%,P=0.15)。Meta 分析结果显示:固定效应模型OR=0.89,95%CI0.72~1.10;随机效应模型OR=0.98,95%CI0.71~1.37;提示短睡眠时间与DR 发生的风险无显著关联(图3A)。2篇文献[11,13]报道了短睡眠时间与中度DR 的关系,异质性检验结果提示各研究间无统计学异质性(I2=23%,P=0.27);meta 分析结果显示,固定效应模型OR=2.07、95%CI1.29~3.33,随机效应模型OR=2.06、95%CI1.18~3.58,提示与正常睡眠时间患者相比,短睡眠时间患者患中度DR 的风险增加(图3B)。3 篇文献[10-11,13]报道了短睡眠时间与VTDR的关系,异质性检验结果提示各研究间无统计学异质性(I2=0,P=0.62);meta分析结果显示,固定效应模型OR=0.92、95%CI0.58~1.47,随机效应模型OR=0.92、95%CI0.58~1.47,提示短睡眠时间与VTDR风险无显著关联(图3C)。
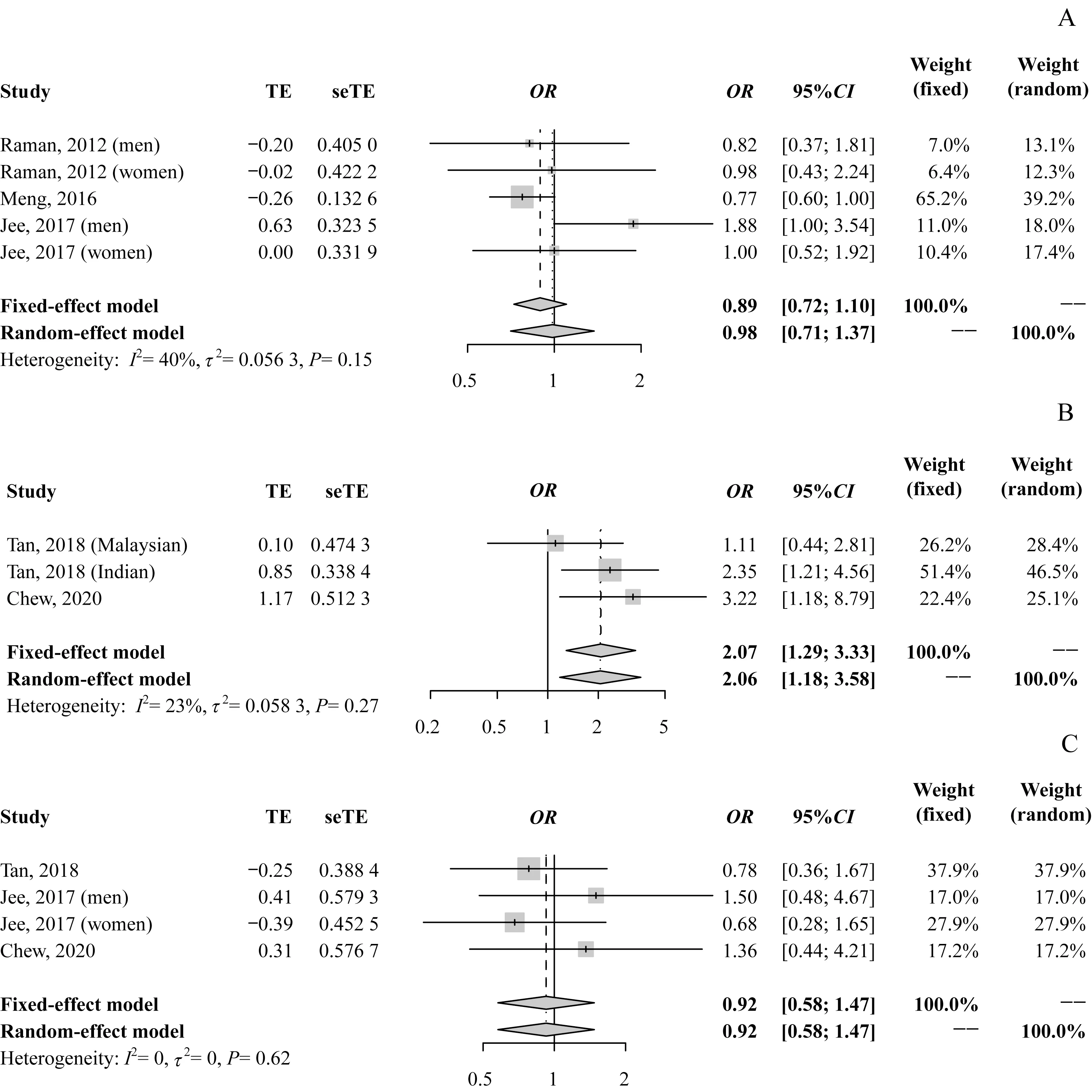
图3 短睡眠时间与DR风险的meta分析森林图Fig 3 Forest plot and meta analysis of short sleep duration and the risk of DR
2.2.3 发表偏倚及敏感度分析 通过绘制漏斗图(图4)发现,各研究点左右分布基本对称,没有严重的发表偏倚。为使结果更加可靠,通过Begg's 检验和Egger's检验进一步分析(图5)。对于T2DM 患者发生DR 的风险,长睡眠时间研究(Begg's 检验P=0.33,Egger's 检验P=0.36) 和短睡眠时间研究(Begg's 检验P=1.00,Egger's 检验P=0.30)均不存在发表偏倚。对于中度DR,短睡眠时间研究中不存在发表偏倚(Begg's 检验P=0.60,Egger's 检验P=0.90)。对于VTDR,长睡眠时间研究(Begg's 检验P=0.12,Egger's 检验P=0.95)和短睡眠时间研究(Begg's 检验P=0.17,Egger's 检验P=0.64)均不存在发表偏倚。敏感性分析结果显示,对于T2DM 患者发生DR 的风险,长睡眠时间与短睡眠时间研究中删除任一篇文献对于剩余文献合并效应值均无明显影响,证实结果具有稳定性;对于中度DR 及VTDR 的分析结果欠稳定。

图5 敏感性分析结果Fig 5 The results of sensitive analysis
3 讨论
近年来,很多研究发现了睡眠时间与糖尿病风险[8]及其相关并发症[12]的关系。本研究结果显示,长睡眠时间与DR 和VTDR 的发生均相关,而短睡眠时间仅与中度DR 风险相关,提示了异常睡眠时间与DR 相关性的潜在机制可能有所不同。此外,睡眠时间与中度DR 及VTDR的关联结果敏感性较强,可能的原因是纳入研究数量及样本量均较少。
关于长睡眠时间与DR 相关性的可能机制:首先,长睡眠时间可能是睡眠质量低下的间接反应(即患者可能由于睡眠质量差而需要延长睡眠时间)。例如,阻塞性睡眠呼吸暂停是导致睡眠需求增加的已知原因,其所引起的间歇性缺氧可能在糖尿病的发展中起重要作用,被确定是胰岛素抵抗和糖尿病的危险因素[14]。第二,和短睡眠时间一样,长睡眠时间也会增加炎症生物标志物[15],而促炎细胞因子具有诱发睡眠的作用,因而长时间的睡眠也可能是糖尿病本身和/或炎症状态诱发的结果[16]。第三,在黑暗的环境中,外层视网膜耗氧增加,导致视网膜氧张力曲线急剧下降,视网膜缺氧加剧,并刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)的过度产生,促进DR 发生[17-18]。第四,长睡眠时间往往与其他已知DR 危险因素的出现存在聚集性,如抑郁、社会经济地位低、其他内科疾病史及较少的体力活动等[19-20]。
短睡眠时间亦可能通过多种机制影响DR 的进展。首先,短睡眠时间与较差的血糖控制相关[21]。Buxton 等的研究显示,睡眠剥夺会导致胰岛素敏感性下降[22],并通过神经内分泌系统影响胰岛素分泌[23]。值得注意的是,2 项研究[10,13]发现,短睡眠时间在校正血糖控制指标后仍与DR 相关,提示其他机制亦可能参与DR 的发生、发展。其次,短睡眠时间可能与炎症相关[24-26]。研究[27]表明,睡眠剥夺与炎症生物标志物增加相关,例如白细胞计数、白细胞介素-6(interleukin-6,IL-6)、C-反应蛋白(C-reactive protein, CRP) 和 髓 过 氧 化 物 酶(myeloperoxidase,MPO)等。第三,短睡眠时间可能通过影响一氧化氮(nitric oxide,NO)、血清内皮素(endothelin-1,ET-1)等导致血管内皮功能障碍[28-29]。第四,睡眠中断会影响褪黑素的水平[30],加速DR 的进展。除此之外,一项临床试验[31]发现,相对于正常睡眠时间(8.5 h/d),短睡眠时间(5.5 h/d)可增加患者食欲,并降低脂肪氧化水平,从而可能对体质量及相关代谢造成负面影响。同时,与长睡眠时间相似,短睡眠时间常与其他DR 相关危险因素聚集出现,如社会经济地位和教育程度低等[20]。
需注意的是,DR 本身也会影响睡眠时间及质量[32]。尤其是对于老年患者,糖尿病并发症的存在与抑郁程度及睡眠时间相关[33]。因此,两者之间的因果关系仍有待进一步研究证明。并且,除简单强调正常的睡眠时间之外,良好的睡眠质量[34]和合适的睡眠节律[12-13]也对DR存在影响。
本研究首次对睡眠时间与DR 的关系研究进行了meta 分析。从多元回归模型中提取数据,一定程度上降低了混杂因素对结果的干扰。同时分析了睡眠时间对发生DR 风险的影响,同时提示了睡眠时间对疾病发生及其严重程度的影响。但本研究存在以下局限性:首先,睡眠时间主要由患者自我报告,主观性较大,且各研究对长、短睡眠时间的定义并不完全一致。其次,各研究中DR 的诊断方法及评级方法略有不同,研究人群来自不同种族,这可能使结果存在较大的异质性。第三,敏感性分析结果提示,对于中度DR 和VTDR,删除部分研究会对合并效应值产生影响,因此对应结论有待进一步研究确定。第四,由于纳入研究均属于横断面研究,无法对睡眠时间与DR 的因果关系做出推断。第五,由于研究收集信息的有限性,部分混杂因素不能充分考虑,如药物使用、女性绝经前后激素变化等。因此,对于结论需谨慎解释。
综上所述,本研究结果提示,除传统DR 危险因素外,睡眠时间与DR 的发生相关。其中,过长的睡眠时间是DR 的危险因素,而短睡眠时间与DR 的关系则待研究进一步确定;其因果关系及生物学机制也有待进一步研究证实。睡眠时间作为个人层面可改善的危险因素,应该引起临床医师及患者的高度关注。

