敲减免疫调节蛋白B7-H3 基因对膀胱癌细胞恶性增殖、侵袭和干细胞样特性的影响
王晓寒,叶云林,肖康华,赵志鑫,吴静雅
1. 河南护理职业学院外科教研室,安阳 455000;2. 中山大学附属肿瘤医院泌尿肿瘤科,广州 510030;3. 河南护理职业学院药学教研室,安阳 455000;4.河南省安阳地区医院中医科,安阳 455000
膀胱癌是人类最常见的泌尿系统癌症之一,如果不进行有效治疗,发病率和死亡率很高[1]。浅表性膀胱癌约占膀胱癌的75%,其中50%以上的患者有肿瘤复发和进展[2]。此外,只有46%的Ⅲ期患者和15%的Ⅳ期患者能达到5 年生存率[3]。虽然使用了大量的治疗方法,如手术、放射治疗(放疗)、化学治疗(化疗)等,但膀胱癌的术后生存率仍然很低[4]。T细胞的活化依赖于双信号:一是抗原肽-MHC 复合物,由T 细胞抗原受体识别;二是共刺激信号(co-stimulating signal),影响T细胞的活化、增殖及细胞因子分泌[5-6]。B7家族是重要的共刺激分子,家族成员之一的B7-H3蛋白,也被称为CD276,包括1个N 端信号肽、IgV 样区、1个IgC样区、1个跨膜区和1个45个氨基酸的胞浆尾[7]。它在多种癌症中都有高表达,并已被证明能促进肿瘤的发展[8-11]。已有相关研究报道,B7-H3过表达可通过PI3K/Akt/STAT3信号通路促进人膀胱癌细胞的迁移和侵袭[12],B7-H3在肌肉浸润性膀胱癌组织中的高表达水平与不良的临床病理状态和不良的预后有关[13],但几乎未见报道B7-H3对膀胱癌干细胞特性的影响。因此本研究重点考察B7-H3对膀胱癌J82细胞干细胞特性的作用。
1 材料和方法
1.1 实验材料
选取中山大学附属肿瘤医院2018 年9 月—2019 年12月期间手术切除的17例膀胱癌组织和癌旁组织作为样本。所有临床组织标本均由中山大学附属肿瘤医院病理科免疫组化结果确认为癌组织或正常上皮组织。本研究通过中山大学附属肿瘤医院医学伦理审查会审核,所有患者均签署知情同意书。
1.2 主要试剂和仪器
正常人膀胱上皮细胞和膀胱癌细胞系(J82,T24,5637 及BIU-87)购于武汉Procell 公司;GV248 干扰载体购于中国吉凯基因公司; Lipofectamine®2000、Superscript RNase H-反转录酶、抗体Bcl-2(#13-8800,1 μg/mL)、20 ng/mL碱性成纤维细胞生长因子、2%B27、F12 培养基购于美国Invitrogen 公司;RNA purification system 购于德国Qiagen 公司;DNase-I 购于瑞士Roche 公司;随机六聚体购于美国Sigma-Aldrich 公司;Giemsa 染色液、胰蛋白酶、Annexin V-FITC 细胞凋亡检测试剂盒、1%结晶紫、ECL 化学发光检测试剂盒购于北京索莱宝科技有限公司;抗体Bax(#2772,1∶1 000)、GAPDH(#97166, 1∶1 000)、 血管内皮生长因子(vascular endothelial growth factor,VEGF)(#2463,1∶1 000)、波形蛋白(Vimentin)(#39325,1∶1 000)、性别决定区Y 框蛋白2(SRY-related high-mobility-group box gene 2,SOX2)(#2748,1∶1 000)、八聚体结合转录因子(octamer binding transcription factor 4,OCT4)(#2750,1∶1 000)、抗兔IgG(#7074,1∶2 000)和抗生物素的HRP 连接抗体(#7074,1∶1 000)购于美国CST 公司;表皮生长因子、DMEM 购于美国Sigma 公司。ABI Prism 7000 系统购于美国Applied Biosystems 公司;SYBR Green Master Mix购于美国Thermo Fisher公司。
1.3 细胞培养
正常人膀胱上皮细胞和膀胱癌细胞保存于含10%胎牛血清的DMEM 培养基中,在37 ℃、5% CO2的湿化培养箱中培养。
1.4 B7-H3基因干扰实验
本研究中选择3 组shRNA——shRNA1、shRNA2、shRNA3 用来干扰B7-H3基因。B7-H3-shRNAs 是针对B7-H3基因设计的(NM_001024736.2);采用反转录聚合酶链式反应 (reverse transcription-polymerase chain reaction,RT-PCR)检测干扰效率。将特异性shRNAs克隆到GV248 干扰载体(中国吉凯基因公司)中。绿色荧光蛋白(GFP)慢病毒载体作为阴性对照。Control 组不做处理,其余各组通过Lipofectamine®2000 将阴性质粒载体及B7-H3干扰质粒shRNA1、shRNA2、shRNA3转染至J82细胞。转染48 h 后,收集并浓缩含有慢病毒的细胞上清液,校准病毒效价,最后得到对照细胞、shRNA-NC细胞、B7-H3-shRNA1 细胞、B7-H3-shRNA2 细胞和B7-H3-shRNA3细胞。慢病毒的最终浓度为4×108TU/mL,储存于-80 ℃。
1.5 qRT-PCR实验
总RNA 用RNA purification system 提取。用DNase-I去除基因组DNA。用Superscript RNase H-反转录酶和随机六聚体从5 mg 总RNA 中制备cDNA。对于qRT-PCR,在ABI Prism 7000 系统中,使用SYBR Green Master Mix 和引物在优化浓度下测定基因表达。B7-H3和管家基因甘油三磷酸脱氢酶(GAPDH)的序列如下:B7-H3正向引物5'-CATCACACCCCAGAGAAGCC-3',反向引物5'-AGA GGGCCGTGCGGTTGGCA-3';GAPDH正向引物5'-G GGTGTGAACCACGAGAAAT-3',反向引物5'-ACTGT GGTCATGAGCCCTTC-3'。每个基因均生成标准曲线,扩增效率为90%~100%。通过阈值比较,确定基因表达的相对定量。所有结果均以GAPDH为基准进行归一化。
1.6 克隆形成实验
将对照组、shRNA-NC组及B7-H3-shRNA组的J82细胞接种于6 孔板中,每孔200 个细胞,连续接种7 d。废弃培养基,每个孔用PBS仔细洗2次。将菌落在甲醇中固定20 min,然后用Giemsa 染色液染色。统计≥50 个细胞的菌落数,计算菌落形成效率:菌落百分比=菌落形成数/接种细胞数×100%。
1.7 流式细胞术
用胰蛋白酶消化J82细胞,用70%乙醇在4 ℃下过夜固定细胞。然后加入10 mg/mL RnaseA(上海翊圣生物科技有限公司)和碘化丙啶(propidi iodide,PI,北京索莱宝科技有限公司)于4 ℃染色过夜。使用Annexin V-FITC细胞凋亡检测试剂盒(北京索莱宝科技有限公司)按照说明书使用流式细胞仪(Becton Dickinson公司,美国)检测细胞凋亡率。AnnexinV-FITC(-)/PI(-)(左下)为正常细胞,AnnexinV-FITC (+)/PI(-)细胞(右下)为早期凋亡细胞,AnnexinV-FITC(+)/PI(+)(右上)为晚期凋亡细胞。AnnexinV(-)/PI(+)(左上)为坏死细胞。
1.8 Transwell实验
J82 细胞经胰蛋白酶处理后,接种于含10%胎牛血清(Gibco 公司,美国)的培养基中,细胞数为3×104个/孔。培养24 h 后,用棉签将上层残留的细胞取出。迁移后的细胞在室温下用95%乙醇固定,然后用1%结晶紫染色。在光学显微镜下观察每个孔的5个随机区域的染色情况。
1.9 肿瘤成球实验
细胞计数后,将单个细胞铺板在60 mm 无包被培养皿中(2.5×105/皿)检查球体形态,使用96 孔超低聚类板(2.5×104/孔)计数肿瘤球。在含有20 ng/mL 表皮生长因子、10 ng/mL 碱性成纤维细胞生长因子和2%B27 的无血清DMEM 和F12培养基中增殖细胞。培养7 d后于倒置显微镜下随机选取5个视野进行观测。
1.10 蛋白质印迹法(Western blotting)
用10%SDS-PAGE分离细胞和肿瘤中的蛋白,并转移到PVDF膜上。在被5%脱脂牛奶阻断后,蛋白质与第一抗体在4 ℃下孵育过夜。主要抗体如下:B7-H3(#ab105922,1∶1 000,Abcam 公司,英国)、Bax、Bcl-2、GAPDH、VEGF、Vimentin、SOX2和OCT4。PBS洗涤,抗兔IgG和抗生物素的HRP连接抗体孵育1 h。用ECL化学发光检测试剂盒(北京索莱宝科技有限公司)观察这些条带。
1.11 统计学分析
以上实验均独立重复3 次。所有定性资料均采用x±s表示,使用统计软件SPSS 20.5 进行统计分析;多组间比较采用单因素方差分析(One-Way ANOVA)方法进行比较,组间两两比较采用LSD-t检验;以P<0.05 认为差异具有统计学意义。
2 结果
2.1 B7-H3在膀胱癌组织和膀胱癌细胞系中高表达
RT-qPCR 检测B7-H3在膀胱癌组织和膀胱癌细胞系中的表达。如图1A 所示,与癌旁组织比较,膀胱癌组织中的B7-H3mRNA 表达显著上调(t=3.041,P=0.000)。如图1B 所示,与正常人膀胱上皮细胞比较,膀胱癌5637、J82、T24 及BIU-87 细胞系中的B7-H3mRNA 表达均显著上调(t=10.600、 2.882、 4.310、 5.364, 均P=0.000),且在J82 细胞系中上调最显著,因此使用J82进行后续实验。
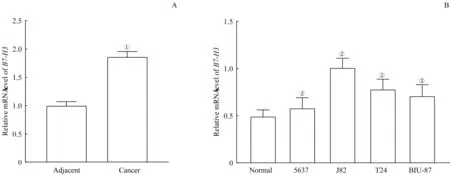
图1 B7-H3在膀胱癌组织和膀胱癌细胞系中的表达Fig 1 Expression of B7-H3 in bladder cancer tissues and bladder cancer cell lines
2.2 B7-H3-shRNAs转染膀胱癌细胞J82的效率
本研究中, 3 组shRNA——shRNA1、 shRNA2、shRNA3转染J82细胞后,RT-PCR和Western Blotting检测B7-H3基因的表达。结果(图2)显示,与对照组相比,3个shRNAs 组均显著降低了B7-H3的mRNA 和蛋白表达水平(mRNA 水平:t=1.667、1.128、2.571,均P=0.000;蛋白水平:t=1.533、1.073、1.780,均P=0.000),其中shRNA2干扰效果最为明显,因此选用shRNA2用于后续实验。
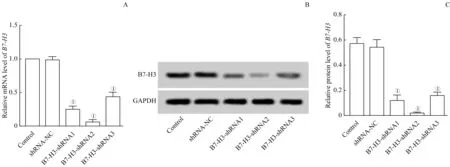
图2 膀胱癌细胞J82转染3种shRNAs后对B7-H3干扰效率的检测Fig 2 Detection of B7-H3 interference efficiency of bladder cancer cells J82 transfected with the three shRNAs
2.3 B7-H3-shRNA2抑制J82细胞增殖
克隆形成实验的结果(图3)展示,B7-H3-shRNA组的克隆形成率显著低于对照组(t=1.526,P=0.000)。由此表明,shRNA2 沉默B7-H3 能抑制J82 细胞的生长。
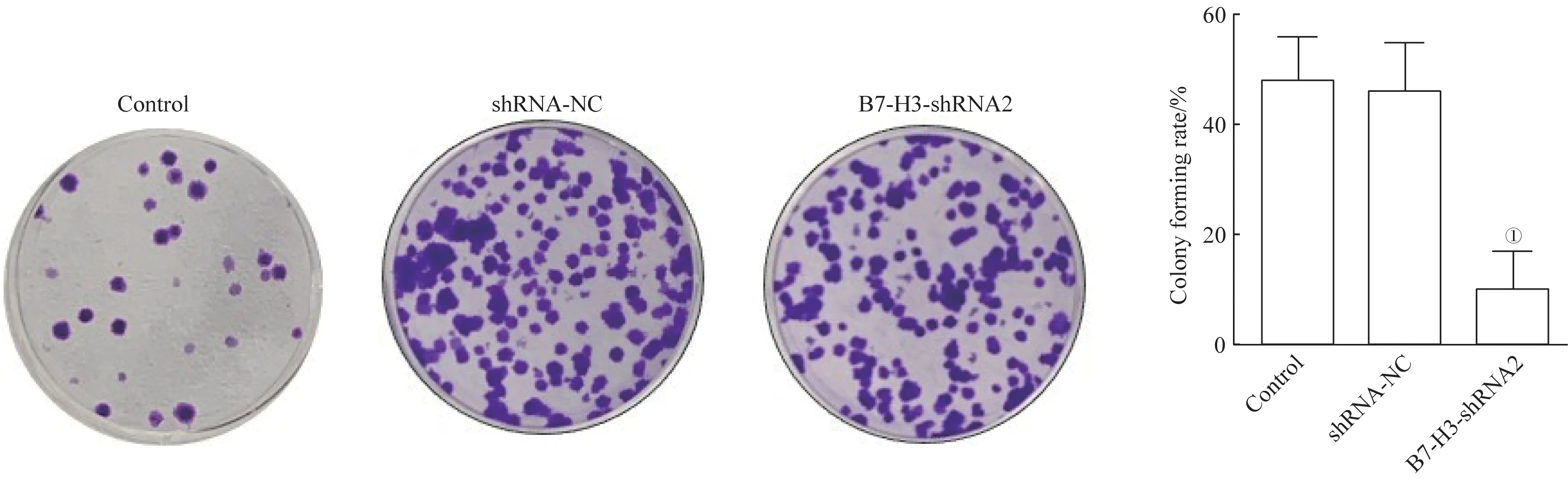
图3 J82细胞增殖情况的检测Fig 3 Detection of J82 cells proliferation
2.4 B7-H3-shRNA2促进J82细胞凋亡
如图4所示,用流式细胞术检测细胞凋亡情况。数据表明,相较于对照组,B7-H3-shRNA 组的细胞凋亡率显著升高(t=1.281,P=0.000)。同时Western blotting 实验的结果进一步从蛋白水平证实,与对照组比较,B7-H3-shRNA 组凋亡相关蛋白Bax/Bcl-2 比例显著增大(t=1.025,P=0.000)。上述实验均说明shRNA2 干扰B7-H3促进了J82细胞的凋亡。
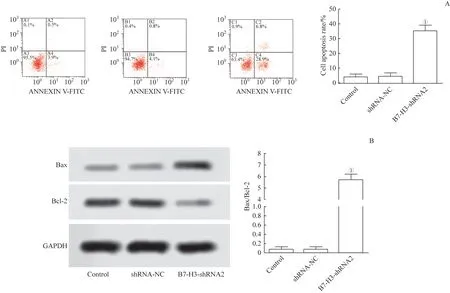
图4 J82细胞的凋亡情况的检测Fig 4 Detection of apoptosis of J82 cells
2.5 B7-H3-shRNA2抑制J82细胞侵袭
如图5A 所示,Transwell实验结果表明,与对照组相比,B7-H3-shRNA 组的侵袭细胞显著降低(t=1.436,P=0.000)。同样,Western blotting 从蛋白水平证实了B7-H3-shRNA 组VEGF 和Vimentin 的表达量相较于对照组均明显降低(t=1.138、1.122,P=0.000)(图5B)。这些实验都证实了B7-H3基因的敲除可阻碍J82细胞的侵袭能力。
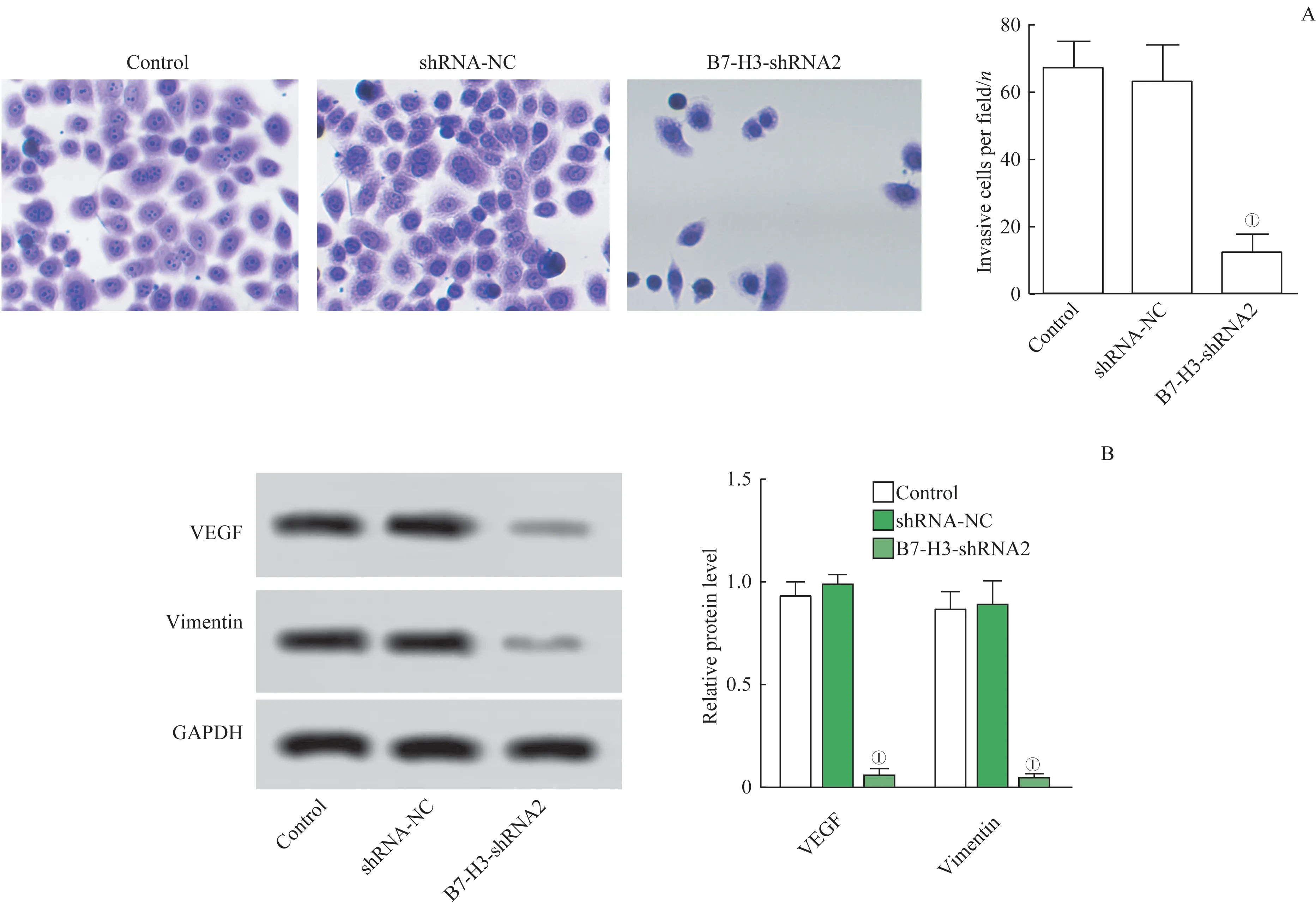
图5 J82细胞侵袭情况Fig 5 Invasion of J82 cells
2.6 B7-H3-shRNA2抑制J82细胞干细胞样特性
肿瘤成球实验显示,相较于对照组,B7-H3-shRNA2组肿瘤球的直径明显缩小(t=1.839,P=0.000)(图6A、B); 且B7-H3-shRNA2 组肿瘤球克隆数量显减少(t=1.875,P=0.000)(图6A、C)。Western blotting检测结果表明,B7-H3-shRNA2组与对照组比较,其干细胞标记物SOX2 和OCT4 的表达显著降低(t=1.444、1.123,P=0.000)。进而证实了B7-H3基因干扰可削弱J82 细胞的干细胞样特性。
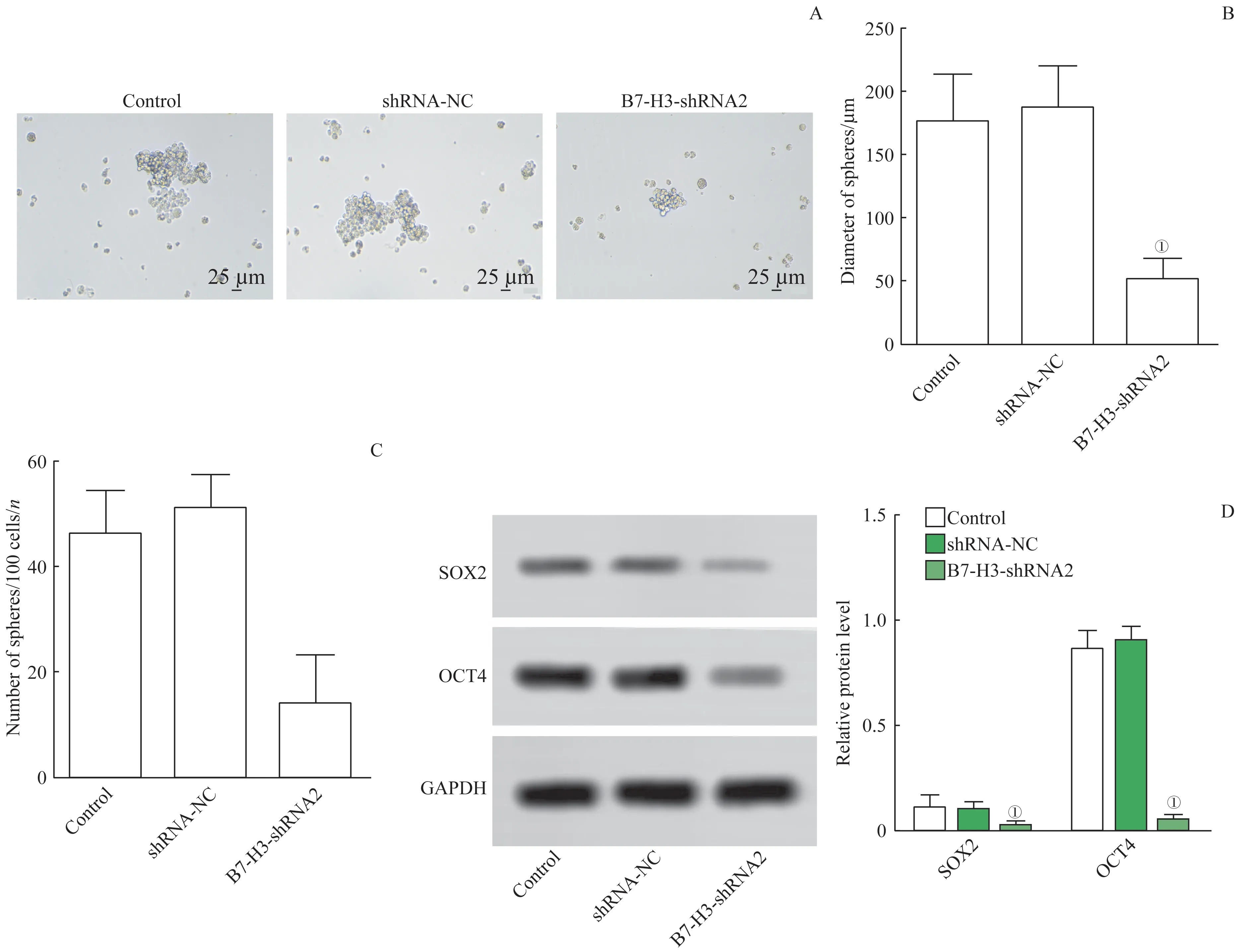
图6 J82细胞的干细胞样特性Fig 6 Stemness characteristics of J82 cells
3 讨论
B7- H3 是B7 家族免疫调节蛋白的一员,B7-H3mRNA 在正常人体组织中广泛表达,但B7-H3 蛋白表达水平较低,说明转录后调控较强。相比之下,B7-H3蛋白在许多类型的恶性肿瘤中过表达,促进肿瘤生长、转移和耐药。B7-H3 可作为有潜力的生物标志物和治疗靶点[14]。
敲除B7-H3的表达或抑制B7-H3可降低多种类型癌细胞的体外和体内生长。此外,B7-H3的表达水平会影响癌细胞的黏附、迁移、侵袭和转移。越来越多的研究支持B7-H3在不同类型的癌症中发挥促癌作用。Zhong 等[15]的结果表明,B7-H3过表达可通过JAK2/STAT3/Slug 依赖的信号通路抑制胶质瘤生长,促进胶质瘤细胞侵袭。Kang 等[9]的研究证实,B7-H3通过JAK2/STAT3/Slug 信号通路靶向上皮-间质转化(epithelial-mesenchymal transition,EMT),促进肝细胞癌的进展和侵袭性。Wang等[16]报道,B7-H3在骨肉瘤患者中过表达,并与肿瘤侵袭性和转移相关。Li 等[17]的研究显示,B7-H3通过向胰腺癌细胞传递信号来对抗化疗诱导的细胞凋亡。本研究使用shRNA抑制B7-H3在膀胱癌J82细胞中的表达,结果揭示表达下调的B7-H3抑制了J82 细胞增殖和细胞侵袭,并促进凋亡。结果与之前的研究一致。
肿瘤干细胞(cancer stem cells,CSCs)是一小群保留干细胞特性的肿瘤细胞,在肿瘤的发生、发展和治疗中发挥着重要作用。CSCs 的自我更新和分化负责肿瘤的发生和维持。CSCs 在转移过程中也起致瘤细胞的作用。此外,CSCs对抗癌药物具有耐药性,治疗后残留的CSCs会导致癌症复发。由于CSCs 在肿瘤的发生、维持、转移、耐药和复发等方面具有显著的作用,通过靶向调控CSCs 的信号通路抑制CSCs 是一种有效的抗肺癌策略[18-20]。B7-H3对CSCs 影响的相关报道很少。Liu 等[21]的数据显示,B7-H3的上调增加了乳腺癌干细胞的数量,促进了癌症的发展。而本研究中,我们发现抑制表达的B7-H3减少了膀胱癌J82 细胞的肿瘤球大小及数量,且下调了干细胞标记蛋白SOX2和OTC4表达。此结果与Li等在乳腺癌中的研究是一致的。
综上所述,下调B7-H3的表达,可抑制膀胱癌J82 细胞的恶性增殖和侵袭,促进细胞凋亡,并且可阻碍J82细胞干细胞样特性。

