色谱与质谱参数的优化对免疫抑制剂定量灵敏度的影响
孟 爽,周 立,付 勤,夏 立,孟丽媛
上海交通大学医学院基础医学公共技术平台,上海 200025
环孢菌素A (cyclosporine A,CsA)、他克莫司(tacrolimus,TaC)、西罗莫司(sirolimus,SiR)、依维莫司(everolimus,EvE)是4 种常用的免疫抑制剂,已被成功应用于临床上肝、肾、肺等多种器官的移植[1-3]。然而,作为窄治疗指数(narrow therapeutic index,NTI)药物,其治疗剂量与毒性剂量间的差别很小[4-6],因此免疫抑制剂的合理用药需在临床药物监测(therapeutic drug monitoring,TDM)的指导下进行,以提高患者用药的有效性和安全性[7-8]。此外,不同免疫抑制剂联合使用时,会产生协同效应,在临床实践中通常将它们合并使用以减少毒性和不良反应[1,9]。除器官移植外,CsA 可负载到重组脂蛋白上用于治疗颅脑损伤[10],EvE 可装载至H-铁蛋白纳米笼上用于治疗乳腺癌[11]等。因此,开发出可应用于临床检测,且能够同时分析多种免疫抑制剂的定量检测方法至关重要。目前,免疫抑制剂药物的临床监测主要基于2 种方法——免疫荧光或比色检测以及液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry, LC-MS/MS)法[12-13]。同LC-MS/MS 法相比,尽管免疫分析方法快速且价格便宜,然而却存在高交叉反应性的干扰,使得检测方法的特异性低,从而可能导致定量结果的高估[14-15]。已有很多报道阐述了LC-MS/MS 在免疫抑制剂定量检测分析中的突出优势[16-19]。如Mei 等[16]使用LCMS/MS 法同时检测了CsA 和TaC,其最低定量限(limit of quantitation,LOQ)分别为5.0 ng/mL 和0.2 ng/mL,并评估了化学发光微粒免疫法(chemiluminescence microparticle immunoassay,CMIA) 与LC-MS/MS 法的差异;Krnáč 等[17]与Gong 等[18]开发了能够同时检测4 种常用免疫抑制剂的LC-MS/MS 方法(CsA 的LOQ 为5.0 ng/mL,SiR、TaC 和EvE 的LOQ 为0.5 ng/mL)。尽管上述报道能够满足免疫抑制剂应用于临床器官移植TDM 的一般需求,然而仍然需要开发更高灵敏度的方法以实现这4 种免疫抑制剂更广泛的临床应用。
在LC-MS/MS 定量分析中,为了获得更高的检测灵敏度及准确度,通常需要对色谱条件及质谱参数进行优化。其中,流动相及流动相添加剂,如常用的甲酸(formic acid,FA)、乙酸、甲酸铵(ammonium formate,AF)、乙酸铵(ammonium acetate,AA)、氢氧化铵等的选择能够影响色谱峰分离度、峰形,并通过影响离子源中离子的形成从而影响检测灵敏度[20-22],因此是影响定性及定量检测的关键。电喷雾电离(electron spray ionization,ESI)是连接液相色谱和质谱最广泛使用的电离源,通过调整ESI 源参数设置,例如气、温度、电压等,能够影响化合物的电离效率及离子化碎片从而影响定性和定量结果[23-25]。尽管已有研究开始致力于更高灵敏度的方法开发(例如Bittersohl 等[26]使用LC-MS/MS 方法同时测定了肾移植患者中游离的CsA 和霉酚酸,其CsA 的检测灵敏度明显提升,LOQ 为0.1 ng/mL 等),至今还没有研究通过系统评价并优化色谱质谱参数,从而开发能够简易有效地提高检测灵敏度的方法。
本研究考察色谱条件及质谱参数对免疫抑制剂定量结果的影响,包括流动相的选择、流动相改性剂的添加及离子源参数的设置(包括气、电压、温度等)。本研究旨在通过评估色谱条件及质谱离子源参数对LC-MS/MS分析中分析物的电离和碎片化的影响,探索一种能够简便地提高定量灵敏度的思路,助力LC-MS/MS 方法开发和优化的有效进行。
1 材料与方法
1.1 试剂
本实验所用的试剂均为商业化产品而非经自行纯化。色谱纯乙腈购自德国Honeywell公司,色谱纯甲醇购自美国Merck 公司,超纯水由RephiLe 纯水仪制备。质谱纯的FA 购自美国ThermoFisher Scientific 公司,色谱纯的AF购自美国ALDRICH 公司,色谱纯的AA 购自美国Fluka公司。CsA、TaC 及SiR 标准品购自加拿大的TRC 公司,EvE标准品购自加拿大TLC公司。
1.2 仪器及软件
超高效液相色谱(ultra-high performance liquid chromatography,UPLC)系统为岛津的LC-30A 系列,配有LC-30AD二元泵,SIL-30AC自动进样器以及CTO-30A柱温箱。质谱系统为SCIEX 公司的QTRAP 6500 plus 系列,配有IonDrive Turbo V 离子源以及IonDrive 高能检测器等。所有质谱谱图数据的处理采用质谱仪自带的Analyst 软件(V1.7.0)以及定量软件MultiQuant(V3.0)进行分析。
1.3 方法
1.3.1 色谱及质谱方法的建立 采用多反应监测(multiple reaction monitoring,MRM)模式定量分析免疫抑制剂。首先,通过针泵推注直接进样法确定4种免疫抑制剂的母离子(precursor ion,Q1)和子离子(product ion,Q3)定量离子对(Q1/Q3)。具体方法为:使用甲醇分别配制CsA、TaC、SiR 及EvE 的标准品储备液1 mg/mL,再用甲醇分别稀释至5 μg/mL,经针泵推注至质谱仪。通过采集一级、二级质谱信息,最终确定各自的定量离子对及相应的碰撞能量等参数。色谱柱选用Waters公司的ACQUITY UPLC®BEH C18 (2.1 mm×100.0 mm,1.7 μm), 保护柱为 ACQUITY UPLC®BEH C18 VanGuardTMPre-Column (2.1 mm×50.0 mm,1.7 μm)。流动相:A 为有机相,选择甲醇或乙腈;B 为水相。为了改善色谱峰峰形、提高信号强度,流动相均添加0.1%FA。洗脱梯度为:0~2 min,40% B;2~6 min,40% B→0 B;6~8 min,0 B;8~8.01 min,0 B→40% B;8.01~10 min,40% B。流速为0.5 mL/min,色谱柱温度设置为50 ℃,自动进样器温度设置为4 ℃。
1.3.2 流动相对其响应的影响 为了考察流动相对4种免疫抑制剂定量结果的影响,采用甲醇或乙腈作为有机相,并且使用含不同浓度缓冲盐(AF 或AA,浓度为5、10或20 mmol/L)的水相体系,考察AF或AA 的添加对定量分析的影响。考察流动相的影响时,质谱条件选择匹配0.5 mL/min的流速下常用的离子源参数设置:离子源电压(ionSpray voltage,IS) 为5 500 V,离子源温度(ion source temperature,TEM)为550 ℃,喷雾气(ion source gas 1,Gas 1)为50 psi(1 psi=6.895 kPa),干燥气(ion source gas 2,Gas 2) 为50 psi,气帘气(curtain gas,CUR)为35 psi,碰撞气(collision gas,CAD)为低流速。
1.3.3 质谱参数对其响应的影响 为了考察质谱离子源参数对4 种免疫抑制剂定量结果的影响,设置IS 分别为4 000、4 500、5 000、5 500 V;TEM 分别为150、200、250、300、350、400、450、500、550、600 ℃;CUR 分别为20、25、30、35、40、45 psi;Gas 1 分别为40、45、50、55、60、65 psi;Gas 2 分别为40、45、50、55、60、65 psi;CAD 分别为低、中、高流速。通过比较不同条件下4 种免疫抑制剂的峰形及峰面积,确定最佳的质谱参数。
1.3.4 标准品溶液及标准曲线的配制 用甲醇配制浓度为100 ng/mL 的4 种免疫抑制剂标准品混合溶液,用以评估流动相及离子源参数对于化合物色谱响应的影响。用甲醇分别配制浓度为0.05、0.1、0.2、0.5、1、2、5、10 ng/mL 的CsA、TaC、SiR 和EvE 标准品溶液,置于4 ℃冰箱中备用。
1.3.5 结果分析 使用SCIEX 公司的定量软件MultiQuant (V3.0) 对标准曲线的线性及准确度(accuracy)进行分析。其中,准确度表示标准曲线中各个样品的理论浓度与实测浓度的接近程度,由MultiQuant(V3.0)软件自动计算(一般要求各标准品浓度点的准确度在100%±15%范围内,最低浓度点在100%±20%范围内)。使用GraphPad Prism 6 软件绘制质谱参数对于免疫抑制剂色谱峰峰面积影响的折线图。
2 结果
2.1 免疫抑制剂MRM定量离子对的确定
采用MRM 正离子模式,对4 种免疫抑制剂进行定量分析。为了确定免疫抑制剂的MRM 定量离子对信息,使用针泵直接推注标准品的进样方式,对4 种免疫抑制剂分别进行一级、二级质谱信息采集,从而获取4 种免疫抑制剂的Q1 和Q3 碎片信息,并针对每个化合物分别优化去簇电压(declustering potential,DP)、碰撞能量(collision energy,CE)、碰撞室出口电压(collision cell exit potential,CXP)等参数,最终确定用于定量检测的MRM 离子对,结果见表1。该结果将用于后续建立LC-MS/MS 定量检测方法。
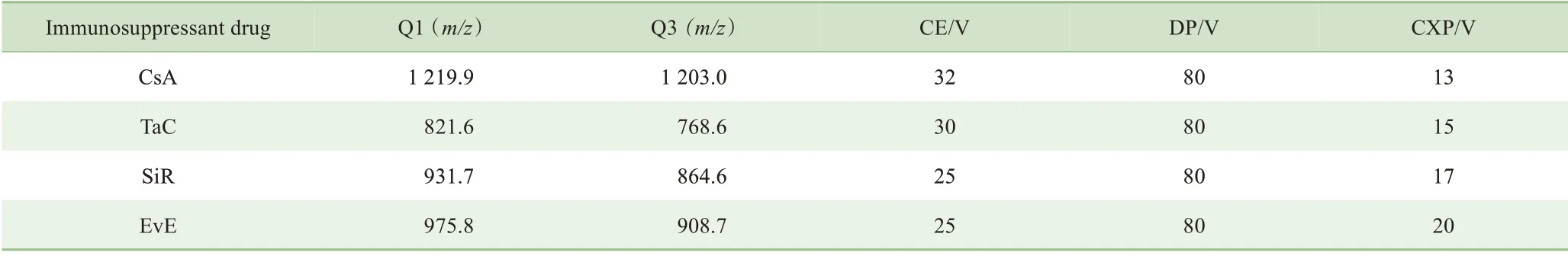
表1 4种免疫抑制剂MRM方法参数Tab 1 Parameters of MRM method of four immunosuppressant drugs
2.2 流动相对免疫抑制剂定量分析的影响
不同有机相及缓冲盐体系对免疫抑制剂定量检测的影响主要通过峰宽和色谱峰响应来评价(图1)。结果表明,与乙腈相比,甲醇作为有机相能够明显减小峰宽、改善峰形。例如,有机相由乙腈更换为甲醇时,CsA 色谱峰峰宽由0.70 min 缩短至0.31 min,TaC 色谱峰峰宽由0.93 min 缩短至0.61 min,且色谱峰峰形得到一定程度的改善。为了进一步改善峰形、提高色谱峰响应,以甲醇(含0.1%FA)为有机相,在水相(含0.1%FA)中添加了5 mmol/L 的AF。结果发现AF 的添加能够显著提高色谱峰响应并改善峰形。
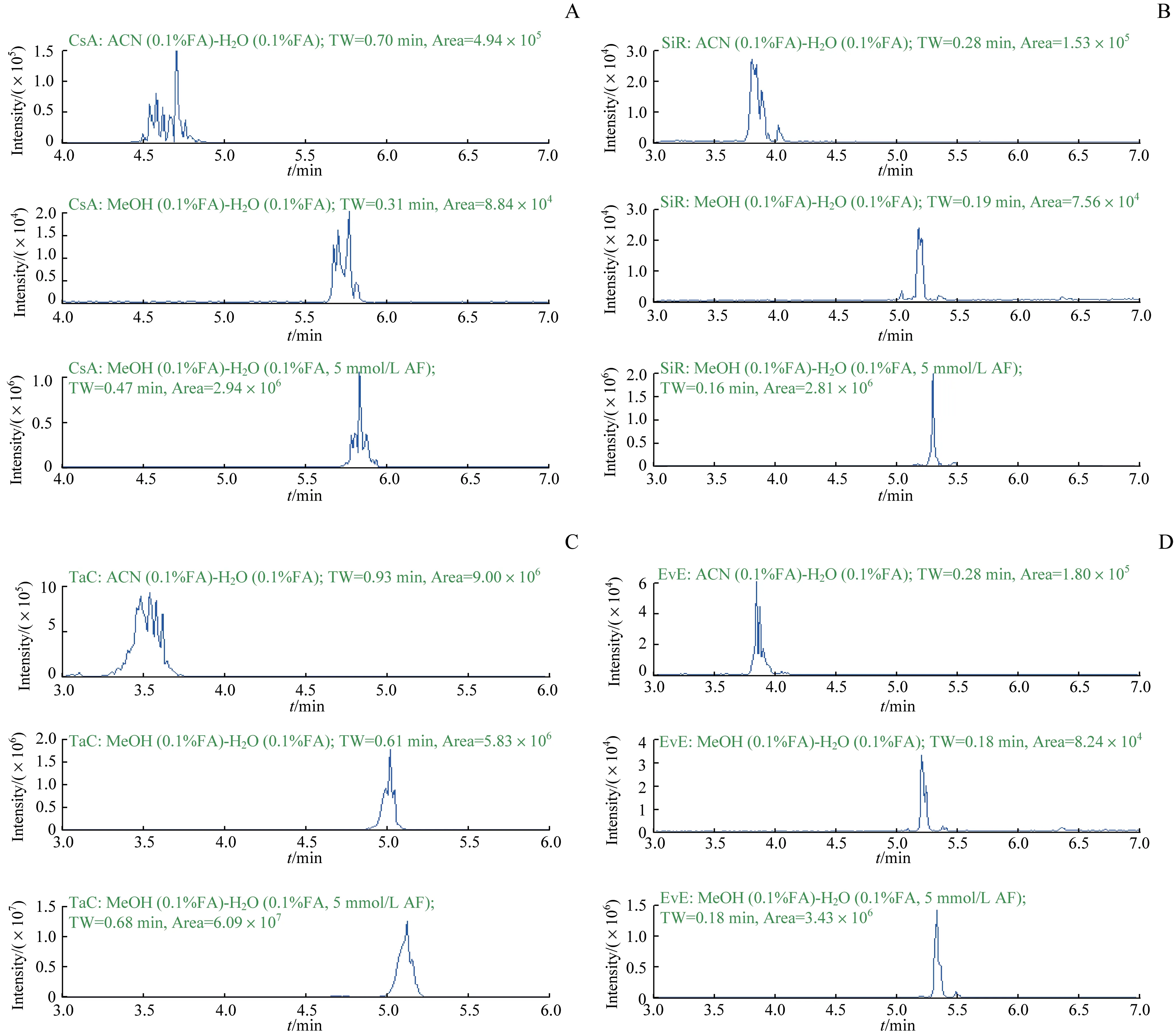
图1 4种免疫抑制剂在不同流动相体系下色谱峰峰形及色谱响应的比较Fig 1 Comparison of chromatographic peak shapes and chromatographic responses of four immunosuppressant drugs under different mobile phase systems
含不同浓度AF 及AA 的缓冲盐体系对免疫抑制剂定量分析影响的结果见表2。同AA相比,含AF的流动相体系下,色谱峰的响应相对更高。此外,无论是AF 还是AA,随着缓冲盐浓度的增加,色谱峰信号并没有进一步提高。相反,高浓度缓冲盐反而会一定程度抑制色谱峰响应。因此,最终选择在水相中添加5 mmol/L的AF开展后续的优化实验。
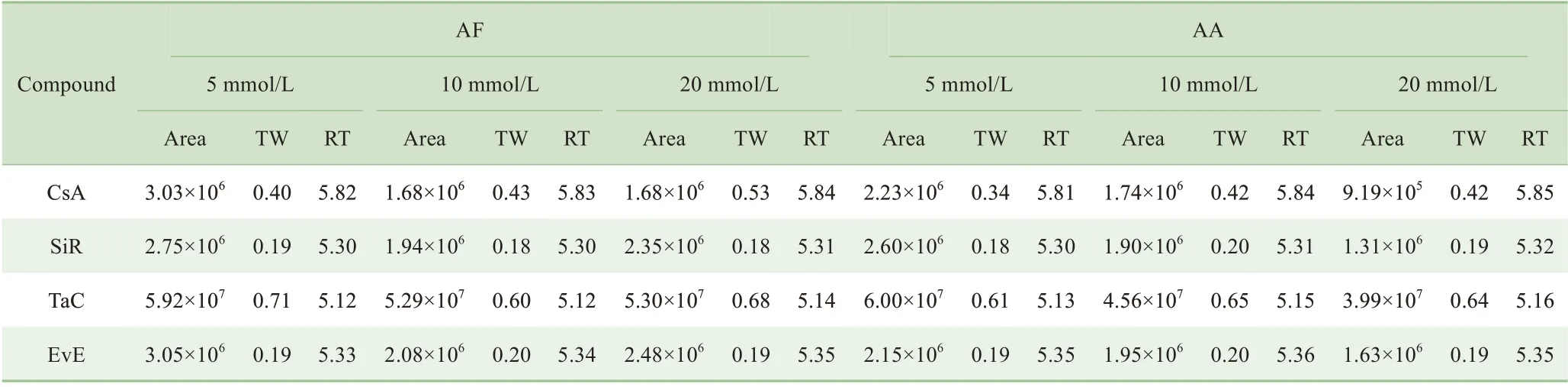
表2 不同缓冲盐体系对4种免疫抑制剂色谱峰的影响Tab 2 Influence of different buffer salt systems on the chromatographic peaks of four immunosuppressant drugs
2.3 质谱参数对免疫抑制剂定量检测的影响
优化流动相体系虽然能够提高免疫抑制剂色谱峰响应,但色谱峰峰形仍有待优化。为了改善峰形,提高定量的准确性,分别优化了IS、TEM、CUR、Gas 1、Gas 2、CAD 等离子源参数(图2)。结果表明,随着IS升高,免疫抑制剂色谱峰响应逐渐增强(图2A);TEM对免疫抑制剂色谱峰响应影响显著,在100~600 ℃的范围内,随着温度的增加,色谱峰响应呈现先增后减的趋势(图2B);随着CUR 的增加,色谱峰响应降低(图2C);Gas 1 和Gas 2 对4 种免疫抑制剂响应的影响并不明显,在40~65 psi 的范围内,色谱峰响应几乎不受影响(图2D、E);CAD 对4 种免疫抑制剂响应的影响趋势不同,对SiR 和EvE 的影响较大,在CAD 低流速时为最优(图2F)。
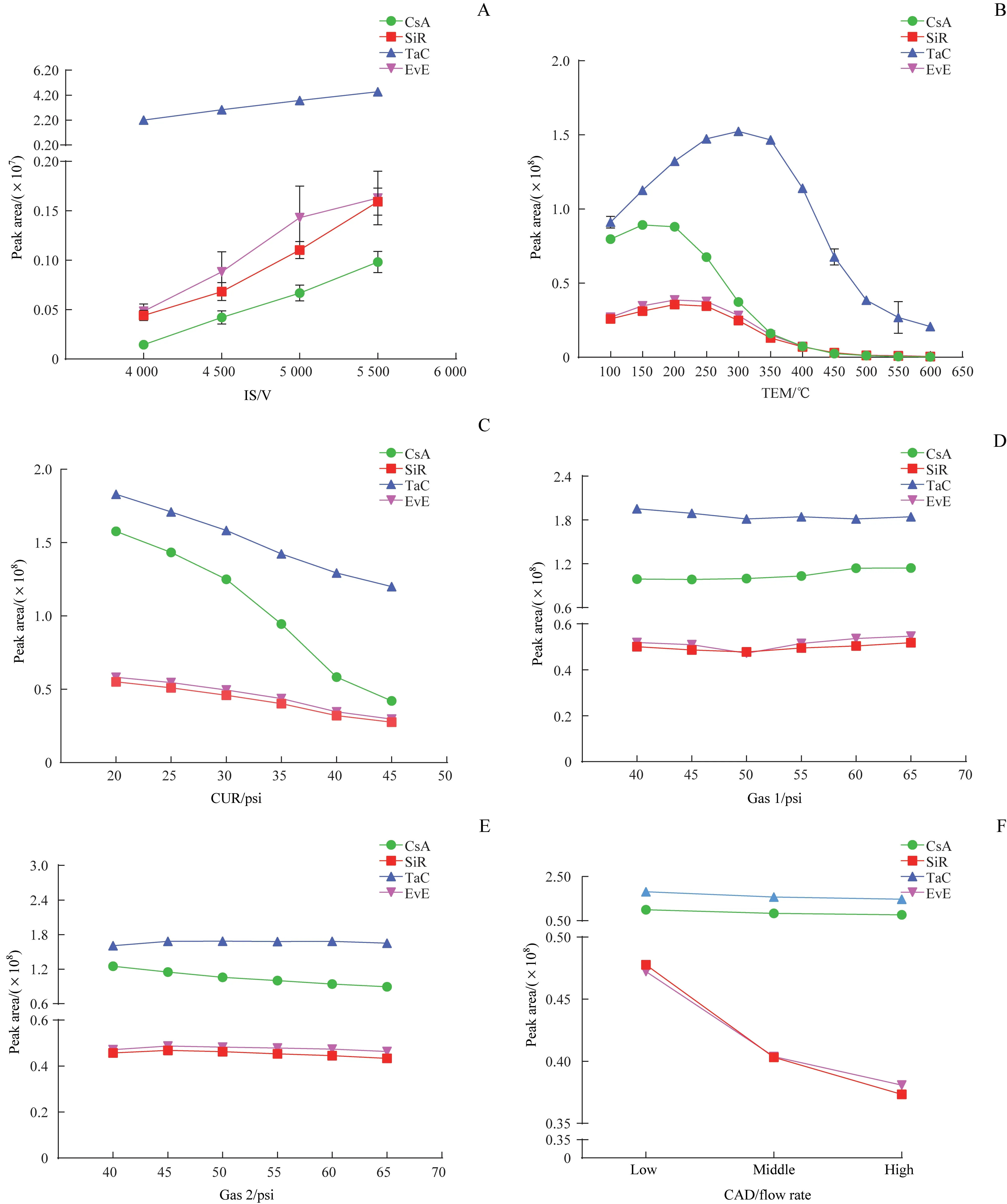
图2 质谱离子源参数对4种免疫抑制剂色谱峰响应的影响Fig 2 Influence of mass spectrometry ion source parameters on the chromatographic peak response of four immunosuppressant drugs
在质谱离子源参数中,TEM 对4 种免疫抑制剂的色谱峰响应影响最为明显(图2)。在500~600 ℃时(0.5 mL/min 流速下通常设置的TEM 范围),4 种免疫抑制剂的色谱峰响应反而最低。CsA、SiR、TaC 及EvE 的最优TEM 范围分别为150~200 ℃、200~250 ℃、250~300 ℃、200~250 ℃。对于CsA 来说,温度的改变能够造成色谱峰响应值呈2~3 个数量级的变化(图2B)。此外,温度的改变对免疫抑制剂峰形的影响极大,随着温度的降低,色谱峰峰形得到明显改善(图3)。其中,CsA 的峰形变化尤为显著:TEM 为500 ℃时,色谱峰呈多分叉状;温度降低至300 ℃时,色谱峰峰形得到一定程度的改善;而温度降低至100~250 ℃时,色谱峰呈平滑无分叉的对称峰。
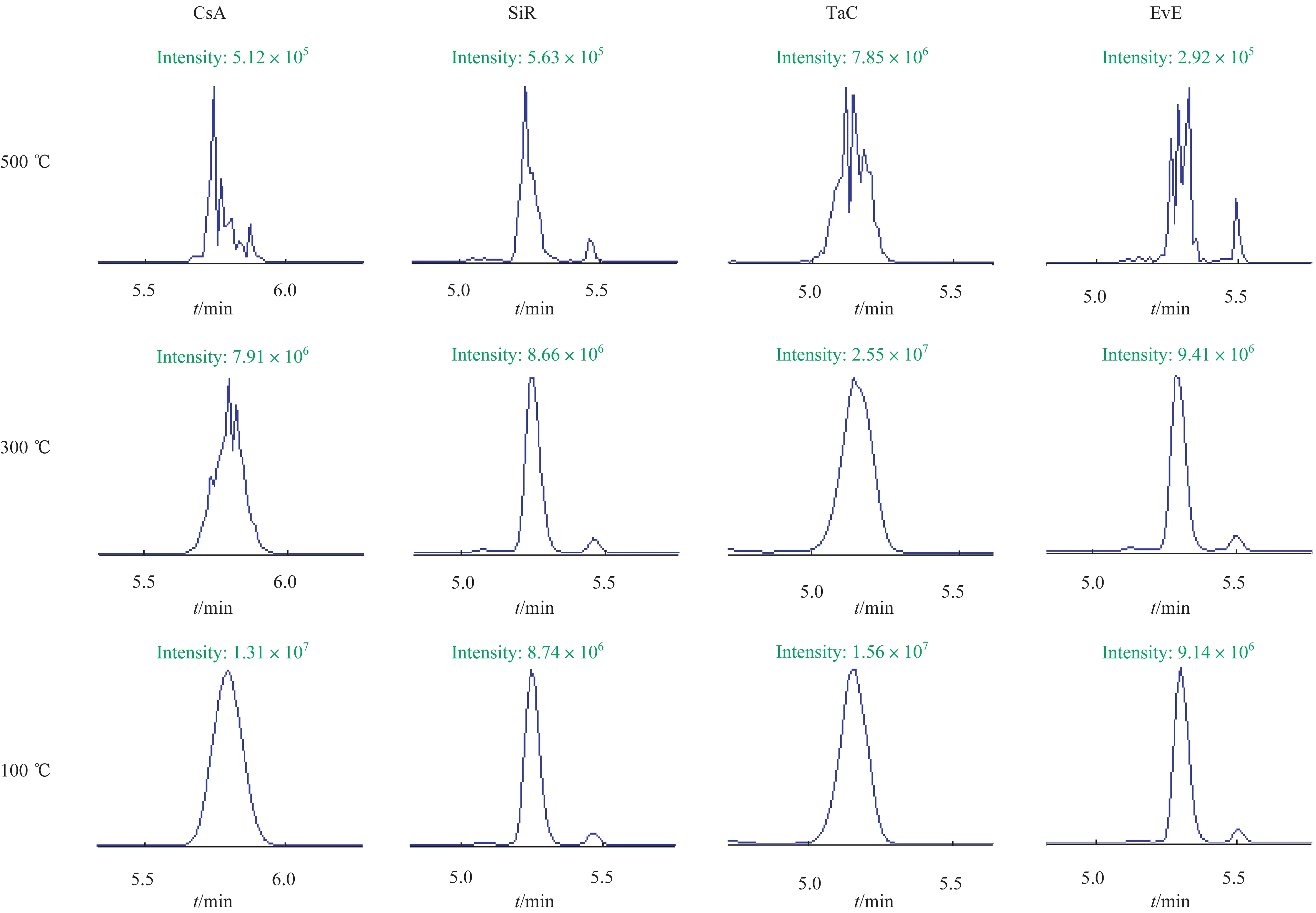
图3 质谱TEM对4种免疫抑制剂色谱峰峰形的影响Fig 3 Influence of mass spectrometry TEM on the chromatographic peak shape of four immunosuppressant drugs
为了进一步确定TEM 对免疫抑制剂定量的影响,我们考察了不同TEM 设置(250 ℃和550 ℃)对4 种免疫抑制剂标准曲线的线性及定量灵敏度LOQ 的影响。结果见图4。250 ℃时,4 种免疫抑制剂的标准曲线线性良好(图4A),除EvE 外,r2均大于0.99,且定量准确度高(85%~115%)。此外,4 种免疫抑制剂的LOQ 均能达到0.05 ng/mL[信噪比(signal-to-noise ratio,S/N)>10],远高于已有文献报道[16-18,26],表明定量灵敏度得到显著改善;而550 ℃时,4 种免疫抑制剂的标准曲线线性相对较差且标准曲线各个浓度点的准确度不能满足85%~115%的可容忍范围。此时,相较于250 ℃,CsA 和SiR的浓度达到0.1 ng/mL 时,才能满足S/N>10,即定量灵敏度降低。因此,TEM 过高时(550 ℃)时,4 种免疫抑制剂的定量灵敏度和准确度均降低;TEM 对免疫抑制剂定量结果影响显著,在方法优化时不容忽视。综上,在甲醇(含0.1% FA)-水(含0.1% FA 及5 mmol/L AF)的色谱条件下,免疫抑制剂定量分析方法的最优质谱离子源参数设置为:IS=5 500 V,TEM=250 ℃,CUR=20 psi,Gas 1=65 psi,Gas 2=45 psi,CAD=低流速。
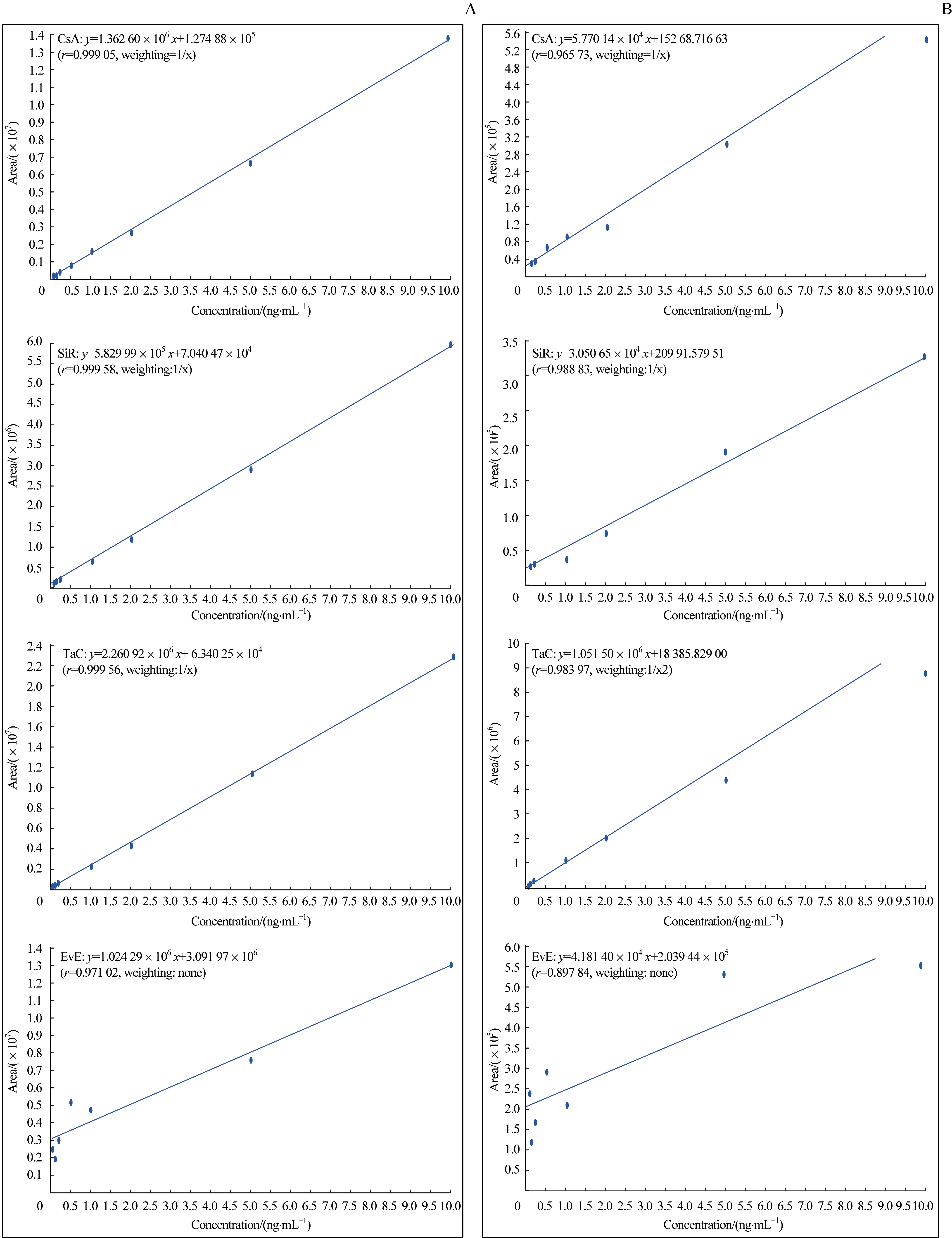
图4 TEM对4种免疫抑制剂标准曲线线性的影响Fig 4 Influence of TEM on the standard curve linearity of four immunosuppressant drugs
3 讨论
近几年来,LC-MS/MS 作为定量检测手段应用于免疫抑制剂的分析已较为成熟。例如,Gong 等[18]开发了结合样品前处理一步蛋白沉淀法的LC-MS/MS 分析方法,可实现样品前处理的简单化、短时间梯度(7 min)以及较高灵敏度(CsA、SiR、TaC、EvE 的LOQ 分别为5.0、0.5、0.5、0.5 ng/mL)[18];Krnáč等[17]进一步缩短了洗脱梯度(3.5 min),从而提高了检测效率等。尽管目前已经有非常多的报道将LC-MS/MS 应用于免疫抑制剂定量检测项目中,然而免疫抑制剂定量检测需要开发更高灵敏度的定量分析方法,且至今尚没有报道系统评价色谱质谱参数对免疫抑制剂定量分析的影响。Krnáč 等[17]仅评价了流动相中添加不同浓度的AF 对免疫抑制剂响应的影响。本研究针对LC-MS/MS 方法中主要的参数进行系统考察,包括流动相、流动相添加剂、IS、TEM、Gas 1、Gas 2、CAD 等。通过改变不同的参数设置,来系统评估并优化免疫抑制剂定量分析的关键因素。
FA、AF 和AA 是常用的流动相添加剂,较低浓度(≤0.05%体积分数)的FA 能够增强大多数化合物在正离子模式下的质谱响应[16-18]。此外,在优化色谱-质谱方法时,我们发现AF 或AA 的添加能够明显增强免疫抑制剂色谱峰响应;随着缓冲盐浓度的增加,色谱响应反而受到抑制,这与流动相PH 值及化合物本身的pKa 值有关[27]。在本研究中,TEM 是影响免疫抑制剂定量分析的最主要因素。对于ESI 离子源,其TEM 的设置在一定的范围内与流速呈正相关。例如,在0.4~0.5 mL/min的流速下,该色谱-质谱体系匹配的TEM 通常为500~600 ℃。然而,对于免疫抑制剂来说,较高的TEM(500~600 ℃)能够导致峰形变差且抑制色谱峰响应,随温度升高其抑制作用更为明显,从而最终影响定量的准确性。在200~300 ℃之间,4 种免疫抑制剂的色谱峰响应最高(图2),这与Gong等[18]的方法描述一致(TEM 为300 ℃)。除流速以外,ESI 的TEM 还与流动相组成及化合物的特性相关。通常,TEM 升高能够加快带电液滴表面的溶剂挥发,从而能够更快地到达Rayleigh 极限,因此在相同时间内能够产生更多的气相离子从而增加检测的灵敏度。然而,当有机相比例较高时,相对较低的TEM 已经足够使得带电液滴气化[24]。由于CsA 等这4种免疫抑制剂水溶性差,其在高甲醇比例时出峰,因此可能仅需要较低的TEM 即可满足气化。
综上所述,我们探究了CsA、SiR、TaC 以及EvE 4种免疫抑制剂在UPLC-MS/MS 定量分析中的主要色谱和质谱参数对定量分析的影响,改善了免疫抑制剂定量检测的灵敏度和准确性。此外,也为其他化合物的质谱定量方法开发和优化提供了新的思路。

