急性髓系白血病化疗术后并发肌肉毛霉感染1例
张改玲 贾亚琼 张弦
[1.河北燕达陆道培医院普通血液及免疫治疗科,廊坊 101601; 2.迪飞医学科技(南京)有限公司,南京 210032]
急性髓系白血病(AML)是血液科常见的恶性肿瘤之一,治疗手段有化疗、靶向治疗及免疫治疗等。化疗后粒缺期,特别是严重粒细胞缺乏期[1]有相当比例患者出现感染[2]。中国血液病患者中性粒细胞缺乏期间最常见的病原菌为革兰阴性菌(44.54%),其次为革兰阳性菌(37.99%),真菌感染发生率相对较低(17.47%)[3]。毛霉病是一种由毛霉目真菌引起的、威胁生命的、罕见的机会性真菌感染,易引起组织坏死及血管血栓形成,易侵犯部位包括鼻、眼眶、肺、胃肠道、皮肤等[4],但肌肉被毛霉菌感染的案例较为罕见。本文报道1例AML患者化疗后感染毛霉,通过宏基因组测序(mNGS)得到及时诊断感染原,采用泊沙康唑及多烯类准确治疗后炎症缓解的案例。
1 临床资料
患者,男,47岁,出生、成长于新疆,因考虑急性髓系白血病于2019年3月11日入我院。患者入院检查:白细胞计数1.11×109/L,血红蛋白79.60 g/L,血小板27.60×109/L。胸部CT提示冠状动脉硬化,双侧胸膜略增厚。心脏超声提示二、三尖瓣轻度反流,左心室舒张功能减低,左心室射血分数为70%,左心室缩短分数为40%。骨髓增生活跃,原始粒细胞占36%,外周血原始细胞占1%。骨髓流式结果显示22.89%细胞为恶性髓系幼稚细胞。白血病融合基因筛查结果显示MLL-PTD基因突变阳性。骨髓染色体检查结果为46,XY,der(6) t(6;18) inv(18) (q11.2q23) t(6;18)(p23;q23)。血液肿瘤突变结果提示U2AF1 S34F突变阳性。患者入院查体:贫血貌,余无阳性体征。既往有血糖偏高、高血压病史。
临床表现 患者2019年3月13日至4月13日进行化疗,期间予其行PICC置管后出现感染性发热,体温持续波动于37 ℃~39.2 ℃,伴右侧胸部疼痛,右手腕部肿胀疼痛,外周血1,3-β-D葡聚糖检测/半乳糖甘露醇聚糖抗原检测(G/GM)、外周血人类疱疹病毒(HHV1-HHV8)筛查以及血细菌、真菌培养试验均阴性,外周血C反应蛋白(CRP)持续升高,降钙素原(PCT)由阴性转为阳性。4月20日右肺听诊可闻及湿啰音,右肺下测呼吸音低,肺部CT显示出现感染性病变(见图1A、B)。按照急性白血病化疗后粒缺期抗感染指南,先后给予头孢吡肟、万古霉素、威凡、头孢米诺、斯沃、达托霉素、泰能、替加环素、异烟肼、利福平等多种抗生素治疗,效果欠佳,持续高热。12 d内右手臂红肿进行性加重,右手食指及大拇指出现麻木状况,后期右前臂极度肿胀,质硬,出现整个前臂缺血性紫黑现象,急诊行右前臂切开负压封闭引流术(VSD,见图2A)。对患者右前臂开刀发现,肌肉组织已坏死,呈弥漫性暗红色。

图1 肺部CT检测. A.感染前肺部(4月13日);B.肺部出现感染(4月22日); C、D.肺部感染性病变加重(5月13日); E、F.肺部感染区域缩小,前胸壁软组织病变(5月22日); G、H. 感染得到控制,右肺出现气胸,胸腔积液和皮下积气(6月13日); I、J. 肺部好转(9月21日)Fig.1 Pulmonary CT scan. A. The lungs before infection (4.13); B. Infected lungs (4.22); C、D. Diseased lungs; E、F. Pulmonary infection area shrinked and soft tissue biof anterior chest wall appeared lesions (5.22); G、H. Pulmonary infection control was achieved and pneumothorax appeared (6.13); I、J. Lung condition improved markedly (9.21)
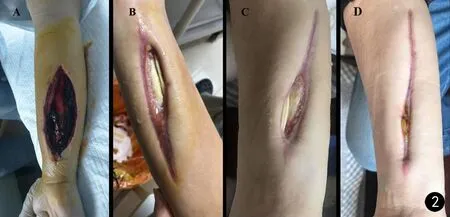
图2 患者右上肢感染状况. A.感染严重(4.26);B.感染得到控制(5.22);C.伤口基本愈合,感染消失(8.3);D.伤口愈合(9.21)Fig.2 Infected right upper limb. A. Aggravated infection (4.26); B. Infection control was achieved (5.22); C. The wound began to heal and infection disappeared (8.3); D. Wound healing (9.21)
mNGS检测 采集患者外周血,肌肉组织及痰液,交由迪飞医学科技(南京)有限公司进行样本测序和生物信息学分析。利用核酸提取试剂盒从样本中提取DNA,进行文库构建后使用Illumina Next-seq仪器进行单端测序。测序完成后对人类宿主序列进行去除,获得unmapped序列。将unmapped序列与微生物基因组数据库比对,均检出微小根毛霉(见表1)。

表1 mNGS检测结果Tab.1 A mNGS results
分子生物学鉴定 对mNGS检测提取的DNA设计引物并PCR扩增约280 bp,外周血和肌肉组织为阳性(见图3),PCR结果送去南京擎科生物测序,测序结果Genbank进行BLAST比对鉴定,比对到微小根毛霉(sequence ID: FWWN02000395.1,见图4),综合考虑该患者可能存在毛霉菌感染。

图3 PCR电泳图Fig.3 PCR electrophoretogram
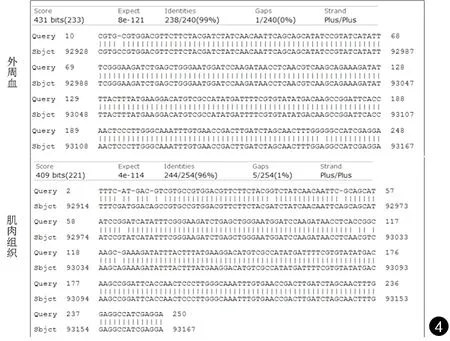
图4 Genbank序列比对结果Fig.4 Sequence alignment results of Genbank
组织活检 使用真菌荧光染色液试剂盒,以酶联法用于标记并吸附在真菌上的抗原结合位点形成强荧光复合物,置于荧光显微镜物镜下,肉眼通过目镜进行直接镜检。右上臂肌肉活检结果亦显示有真菌感染菌丝结构(见图5A)。
组织微生物培养 进行肌肉组织培养后将组织剪碎,加生理盐水研磨接种血平板,经乳酚棉蓝染色后在显微镜下观察真菌形态特征,肌肉组织培养出了根霉属菌(见图5B~D)。

图5 组织病理结果. A. HE染色(×10); B. HE染色(×20); C. PAS染色(×40); D. 荧光法染色(×40)Fig.5 Pathological microscopy of the muscle tissues. A. Hematoxylin and Eosin staining; B. Hematoxylin and Eosin staining; C. PAS staining; D. Fluorescence staining
诊断与治疗 确定病原后调整用药,4月28日起,先后予以患者泊沙康唑(20 mL/d)联合两性霉素B(25 ~50 mg/d)或泊沙康唑(20 mL/d)联合安必素(150~250 mg/d)进行治疗,同时给普通两性霉素B进行雾化吸入及伤口冲洗和房间消毒。患者体温波动及治疗方案见图6。1周后患者体温恢复正常,肺部影像(见图1C、D)显示:①右肺上、中叶内病变,考虑为感染性病变,真菌感染可能。②右肺下叶内侧基底段胸膜下区病变性质待定。③右侧胸膜略增厚病伴有胸腔积液。④提示肝脾实质内多发结节状低密度影,考虑为真菌感染。5月13日调整泊沙康唑(30 mL/d)联合安必素(250 mg/d)的用药剂量。5月22日肺部影像(见图1E、F)显示右肺及前胸壁软组织病变,局部胸壁下级胸腔内新见气体。肌肉组织再次培养结果转为阴性,患者病情好转(见图2B)。因家庭经济困难,患者要求出院治疗。患者5月23日出院后一直维持口服泊沙康唑,体温正常,带瘤生存。随访显示右前臂刀口逐步趋于愈合(见图2C、D)。因患者家中不慎摔倒,出现右侧肋骨骨折伴气胸(见图1G、 H),在当地医院处理气胸后,患者持续服用泊沙康唑,后复查肺部CT,患者肺部感染症状好转(见图1I、J)。
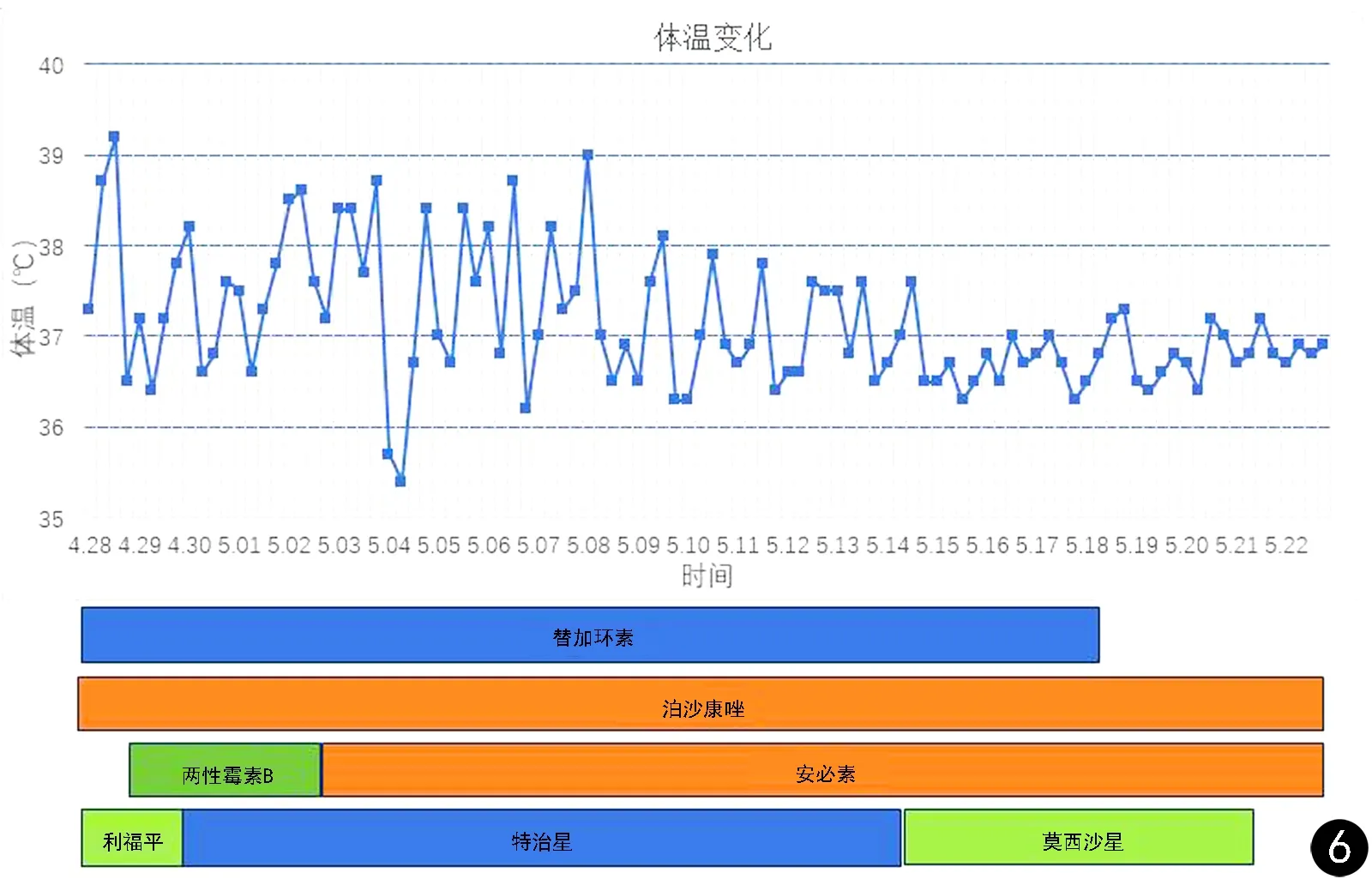
图6 患者治疗过程中体温监测及用药情况Fig.6 Body temperature monitoring and medication during treatment
2 讨 论
毛霉菌病又称接合菌病,是一种由毛霉目引起且威胁生命罕见的机会性真菌感染。毛霉菌病的发病率逐年增加,且诊断困难,病程多数呈急性进展,死亡率高[5]。澳大利亚一项多中心、回顾性研究统计了2004—2012年74位毛霉菌病患者基础疾病情况及分布,结果显示毛霉菌病涉及众多科室,主要为血液科[6]。Tedder等[7]综合报道的255例肺毛霉菌病患者,其中恶性血液病占比达到37%,其次为糖尿病(32%),其他易发因素有肾功能衰竭、器官移植、近期手术、实体肿瘤等。毛霉病的预后与基础疾病状态及治疗时效有关[7]。大部分患者累及皮肤及呼吸道等接触外界的部位,而深部肌肉部位的感染,特别是没有外伤将毛霉菌带入体内的情况下,鲜有报道。
本文是1例AML化疗后并发肌肉毛霉感染的罕见案例,患者化疗后粒缺期持续发热、右上侧胸痛、右臂肿胀,先后给予多种抗生素治疗,效果欠佳,持续高热。毛霉病不易早期确诊,特别是早期表现的一些临床症状,极易误诊为其他病原体感染[8]。目前临床诊断毛霉病的检验手段存在不足,主要表现在无可靠血清学手段,PCR假阳率高,病原体培养阳性率低,G/GM试验也常为阴性等方面,为临床治疗造成了极大的不便[9]。
本案例使用最新检测技术mNGS,快速准确的辅助临床检测到患者外周血,肌肉组织及痰液样本中均存在毛霉,临床使用多烯类和三唑类抗真菌药物使患者的感染得到控制。值得提出的是,mNGS检测结果与临床培养结果有一些出入,临床组织培养检测结果为根霉属菌,而mNGS检测结果提示感染病原体是根毛霉属中的微小根毛霉种。后续为验证mNGS检测结果的可信度,将患者3个样本中mNGS检出的所有序列分别和NCBI中根霉属和根毛霉属的参考基因组进行比对校准,结果显示检测到的序列均特异性比对到根毛霉属中的微小根毛霉,但未比对到根霉属。分析可能的原因如下:一方面,毛霉菌普遍存在于腐败的植物和土壤中,正常情况下存在于人的鼻咽部,当机体免疫低下时,可通过吸入孢子等途径进入机体造成疾病[10],对于这种环境中常见的病原体,组织培养可能因污染出现了假阳的情况;另一方面,根霉属和根毛霉属同属于毛霉科,表型相似度较高,培养结果产生了误判。同时,进一步验证mNGS检测结果的可信度,对mNGS检测提取的DNA经过PCR扩增和测序验证外周血和肌肉组织为微小根毛霉,但可能由于痰液中微小根毛霉浓度很低,所以痰液PCR扩增阴性。
从患者案例可以看出,mNGS技术可检测样本中的所有病原微生物,检测没有偏好性,不依赖经验,可以很大程度的减少假阴和误判的情况。检测结果显示3个感染样本中都检出有微小根毛霉,且外周血和肌肉组织序列数较高,可以很大程度辅助临床排除是环境污染造成的阳性检出率;通过检出序列的特异比对,检出序列数因组覆盖度的高指标降低了由同源性造成的比对不准的可能性。综上所述,组装级别高,精准度高的高质量病原微生物基因组的发布,对于未来mNGS病原精准诊断起着决定性的作用,mNGS在不依赖临床判断的基础上可以大范围快速的诊断病原微生物,非常适用于一些罕见,传统诊断困难和病程急的感染性疾病的诊断。因此传统的临床检验手段结合mNGS病原检测对于未来精准治疗意义重大。

