等位基因特异性PCR法快速检测烟曲霉常见耐药突变基因
邓宇晨 方文捷 邓淑文 陈显振 张亚茹 冯真益 凌丽燕 潘炜华 廖万清
(1. 海军军医大学长征医院皮肤科,上海 200003;2. 浙江省平湖市第二人民医院检验科,平湖 314201)
曲霉(Aspergillus)是导致侵袭性真菌病最重要的病原真菌之一,以烟曲霉(Aspergillusfumigatus)为主要致病菌种,常引起过敏反应、慢性和侵入性支气管肺病等严重疾病[1]。烟曲霉既可侵犯免疫功能低下人群,也能在免疫正常人群中致病,其发病率和死亡率均较高,应引起临床医生关注。近几十年来,医疗技术快速发展,曲霉病的诊治水平有了很大的提高。但是,近年来临床上难治性曲霉感染病例有增加趋势[2],很大一部分原因是由于烟曲霉耐药菌株的增多[3]。
对于侵袭性曲霉病,早期正确的诊断及抗真菌治疗是成功治疗的关键。体外药敏试验是真菌耐药性检测的金标准,方法成熟可靠,但其最大的弱点是费时,传统培养时间是2~3周,体外药敏试验至少需要培养3 d后观察结果,难以满足临床对于耐药真菌诊断与治疗的需求[4]。因此寻找特异性好、灵敏度高并且简单易行的实验室检测指标与方法是耐药真菌研究中需要解决的问题。对于烟曲霉,cyp51A基因编码产物是唑类药物作用的靶标,特定点突变能导致唑类药物与 Cyp51A 蛋白的亲和力下降[5],是发生唑类耐药的重要原因,也是通过分子诊断方法精确反应耐药结果的依据[6]。TR34/L98H 是烟曲霉菌种常见的耐药突变类型,能够解释90%以上的耐药现象[7]。对于上述位点的检测,可以判断菌株的耐药情况[8-9]。因此本研究拟建立等位基因特异性PCR检测曲霉耐药突变的体系,检测TR34/L98H耐药基因以快速初筛烟曲霉对抗真菌药物的耐药性。
1 材料与方法
1.1 菌株的收集
烟曲霉唑类耐药基因突变菌株:STJ0048,STJ0049,STJ0107,STJ0140,XJ138。这些菌株是从临床标本分离得到,分别来自福州(STJ0048,STJ0049)、上海(STJ0107)、南京(STJ0140)和乌鲁木齐(XJ138),前期已通过药敏试验和对cyp51A基因的测序鉴定其对唑类药物耐药并且存在TR34/L98H位点突变[10]。随机选择前期药敏试验鉴定的10株未突变烟曲霉作为阴性菌株[11-12]。黄曲霉、灰绿曲霉、构巢曲霉、寄生曲霉、土曲霉、杂色曲霉、红色毛癣菌、毛霉菌和青霉菌从上海长征医院真菌研究所菌种保藏库随机各选1株,人类DNA提取自HeLa细胞(TechStar Co.Ltd, Jiangsu, China)。
1.2 DNA的提取
使用ZR Fungal/Bacterial DNA Kits(Zymo)试剂盒提取真菌DNA。
1.3 引物设计
相关序列来自项目组测序及NCBI 检索官网下载 (https://blast.ncbi.nlm.nih.gov/Blast.cgi),装载于 Geneious©10.1.2 软件进行比对以及分析,及手工设计引物,待定引物通过 IDT 核酸分析工具进行特性分析(https://eu.idtdna.com/calc/analyzer)。引物设计遵循如下原则:①引物不能同常见临床、环境真菌和人类 DNA 发生交叉反应;②应用 IDT OligoAnalyzer 3.1 软件(https://eu.idtdna.com/calc/analyzer)预测引物的 Tm值以及二聚体。控制Tm值、引物二聚体和 PCR产物长度,使得二重引物可以共存于一个体系。
项目组针对L98H点突变以及TR34重复插入片段突变设计了两对特异性引物:第1组引物L98H-F:CGCATGAGCAGCATCTCGCTTC L98H-R:
GGAACGAGTTTATTCTCAACGGCAAAGA检测位点L98H点突变(T>A突变),扩增产物446 bp,Tm=86.19℃(Tm值由http://biotools.nubic.northwestern.edu/OligoCalc.html计算得到);第二组引物TR34-F:TGTGCTGAGCCGAATGAATCACGC、TR34-R:GATAAGAG-GGATTATTTCATATACTGGAT-TCC引物一侧位于两次重复片段中间位置,即前1个重复片段的偏后区域以及后1个重复片段的偏前区域,突变菌株存在该序列,可以进行聚合酶链式反应,野生菌株无插入突变,故不存在两次突变重复序列,无法进行聚合酶链式反应,扩增产物257 bp,Tm=81.50℃。
1.4 等位基因特异性PCR扩增
每一管同时进行2对引物的PCR扩增,PCR的反应体系如下:SYBR Premix Ex Taq 12.5 μL、L98H-F 0.5 μL、L98H-R 0.5 μL、TR34-F 0.5 μL、TR34-R 0.5 μL、Template 1 μL、ddH2O 9.5 μL,共25 μL。PCR扩增的条件如下:95℃ 30s-(95℃ 30s-57℃ 30s-72℃ 30s)共30个循环-65℃ 5s-95℃。本实验通过RT-PCR的扩增曲线判断扩增是否成功以及溶解曲线呈现双峰判断两种突变是否共存。
1.5 特异性试验
将新型的单重检测方法,同步检测L98H/TR34耐药突变烟曲霉和非突变烟曲霉对照菌株,证明新方法仅在烟曲霉耐药基因突变菌株中产生阳性反应;同时将黄曲霉、灰绿曲霉、构巢曲霉、寄生曲霉、土曲霉、杂色曲霉、红色毛癣菌、毛霉、青霉和人Hela细胞的DNA作为对照,证明该检测体系与这些物种不存在交叉反应。
1.6 敏感性试验
经查阅文献,曲霉基因组大小为29.4 Mb。建立拷贝数计算公式:Copy number = (amount ng·6.022·1023)/(2.94·107·1·109·650) 得到106个曲霉的DNA重量为31.7 ng。故将上述试剂盒抽取的DNA浓度稀释为31.7 ng/μL,在以10为倍数,建立浓度梯度,用于敏感性试验(106/mL,105/mL,104/mL,103/mL,102/mL,101/mL)。新方法依次对上述浓度的DNA样本进行扩增试验,查看阳性反应的最低浓度,即为敏感性。
2 结 果
2.1 特异性结果
所有烟曲霉耐药基因阳性突变菌株RT-PCR溶解曲线均呈现双峰,显示两种突变共存;所有阴性突变株,非耐药烟曲霉菌株均未检测到突变位点(见图1~3)。以黄曲霉、灰绿曲霉、构巢曲霉、寄生曲霉、土曲霉、杂色曲霉、红色毛癣菌、毛霉、青霉、HeLa细胞的DNA作为对照未见扩增,即不存在交叉反应。

图1 单株烟曲霉耐药基因阳性菌株等位基因特异性PCR的溶解曲线 图2 耐药基因阳性菌株与阴性菌株的扩增曲线 图3 耐药基因阳性菌株与阴性菌株的溶解曲线Fig.1 Melt curve of allele-specific PCR forone resistance gene positive Aspergillus fumigatus Fig.2 Amplification curves of resistance gene positive and negative Aspergillus fumigatus Fig.3 Melt curves of resistance gene positive and negative Aspergillus fumigatus
2.2 敏感性结果
通过对不同浓度的DNA样本进行扩增实验,阳性反应的最低浓度为104/mL(见图4)。
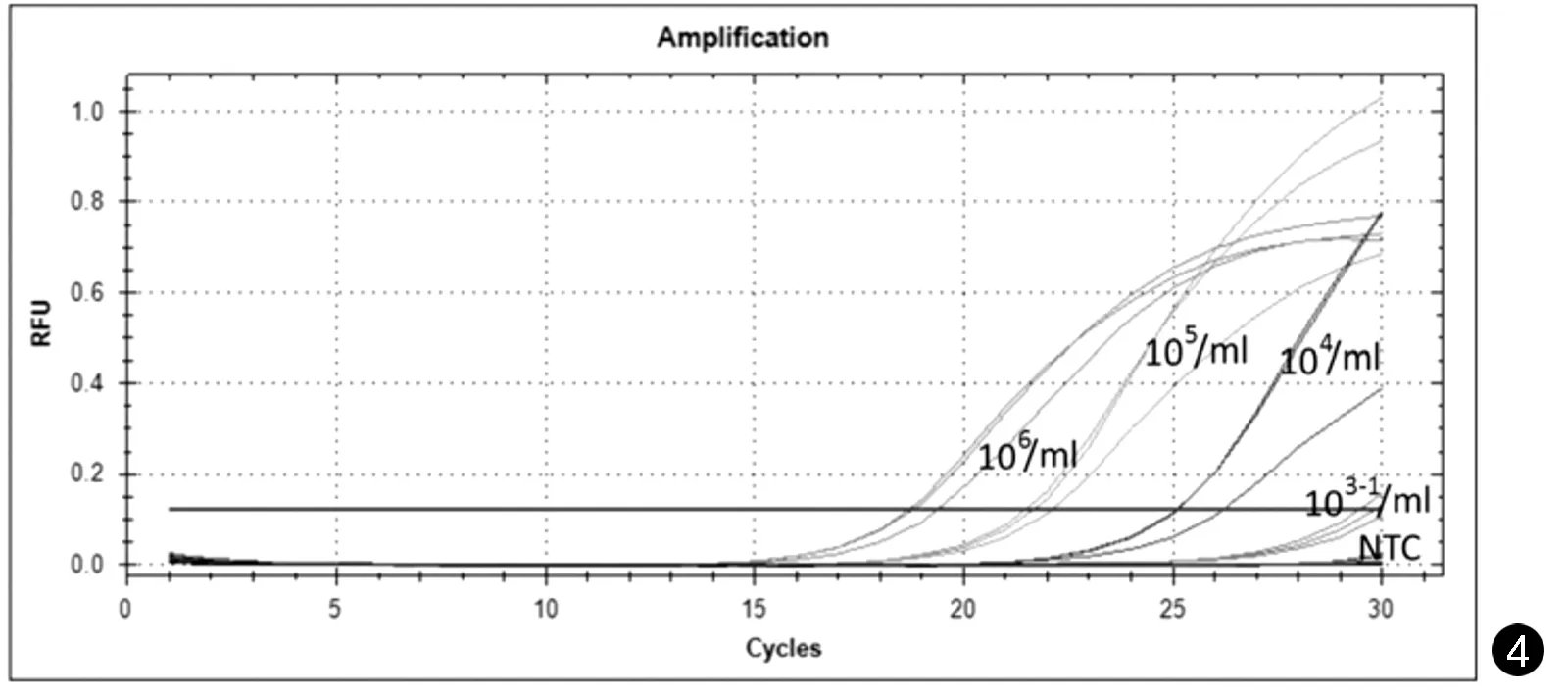
图4 不同浓度DNA样本的扩增曲线Fig.4 Amplification curves for different concentrations of DNA samples
3 讨 论
国际指南推荐的烟曲霉一线用药为广谱三唑类抗真菌药物,如伊曲康唑、泊沙康唑和伏立康唑等[13]。该类药物不良反应小,临床效果好,已经广泛用于曲霉感染高危人群经验性预防、急慢性感染控制。但由于全球范围内含唑类农药大规模应用,以及临床上唑类抗真菌药物的长疗程使用,烟曲霉对伏立康唑等抗真菌剂的耐药性呈现逐年上升趋势[14]。据文献显示,临床菌种耐药率在美国约为3.6%,中国为 4%,日本为 11%[15]。以往耐药检测是基于培养等传统技术,阳性率低,本研究成功建立一套双管等位基因特异性PCR体系,可以在相同的反应条件下,同步检测TR34/L98H这两个唑类耐药曲霉的突变位点,所有唑类敏感菌株均未检测到这两个突变位点,验证了该体系的特异性,有效提高了检测的敏感性。
检测烟曲霉唑类耐药的传统方法,是以培养为基础的微量肉汤稀释法药敏检测法等,该方法较可靠,无需特殊仪器,但最大弱点是费时,传统培养时间为2~3周,药敏试验至少需要培养3 d后观察结果。运用血清学检测(G试验,GM试验)可以在数小时内得到菌种信息,但是药敏结果仍然需要通过传统方法3周时间才能获知。这些检测技术不能在患者治疗的初期及时提供精确的用药指导信息,使得目前的抗真菌方案不能科学地遵守个体化原则,既耽误了患者的治疗,也造成了财力的浪费[4],而本文建立的基于等位基因特异性PCR的分子诊断方法可以有效解决上述问题,将耐药检测时间由传统方法的2~3周缩短为2~3 h,可以精准指导临床早期、有效的抗真菌治疗,对于改善患者预后起到了重要的作用。
本研究提供一种用于烟曲霉唑类耐药突变检测的核酸诊断策略。针对烟曲霉的耐药突变TR34/L98H,设计了一套价格低廉、操作简单、不需要高价仪器的曲霉耐药检测方法,而且特异性和敏感性均较高,能够同血清学检测形成良好的互补,适合临床快速检测,进而提高曲霉菌的诊治水平。该方法仍具有一定的局限性,不能完全取代传统药敏方法,因此等位基因特异性PCR法具有一定的临床应用价值,是对传统真菌药敏方法的有益补充。

