老年结核病患者外周血中恒定自然杀伤T淋巴细胞的比例、表型及功能状态▲
朱雄林 冯显红 杨 梅 章革民 姚广冰
(湖北省武汉市新洲区人民医院1 感染科,2 检验科,3 妇产科,武汉市 430400,电子邮箱:4047695@qq.com)
结核病一种是由结核分枝杆菌复合群感染引起的慢性传染病。近年来,随着我国步入老龄化社会,老年人群的结核病呈高发趋势,并具有高复发率、高耐药性、高死亡率等特征[1],是临床防治的重点。有研究显示,宿主个体免疫状况的差异会显著地影响结核病的发生与发展[2]。因此,准确阐明不同结核病人群的各免疫细胞的表达水平及状态,对临床诊治有着积极意义。
T淋巴细胞的免疫应答是人体抗结核感染的主要机制[3]。恒定自然杀伤T淋巴细胞(invariant natural killer T lymphocytes,iNKT)是一类 CD1d 限制性T淋巴细胞,在结核感染过程中能够以CD1依赖的方式显著地抑制结核杆菌的复制,降低肺脏中的结核杆菌载量,在整个免疫应答过程中发挥重要的作用[4]。本研究分析老年结核病患者外周血中iNKT的比例、表型及功能状态,现报告如下。
1 资料与方法
1.1 临床资料 选取2017年5月至2019年5月武汉市新洲区人民医院收治的150例结核病患者,纳入标准:(1)均符合中华医学会结核病学分会制定的诊断标准[5],并经胸部影像学、痰标本涂片抗酸杆菌等检查确诊;(2)均对本研究知情同意。排除标准:(1)合并心肝肾肺等器官功能衰竭者,或严重的免疫系统、神经系统等疾病者;(2)合并支气管结核、陈旧性结核以及其他感染性疾病者;(3)近期使用免疫抑制剂者。根据年龄将结核病患者分为老年结核病组(≥60岁)与非老年结核病组(<60岁),其中老年结核病组68例,年龄65~75(69.54±7.44)岁,非老年结核病组82例,年龄32~58(48.85±10.28)岁。同时选取80例老年志愿者作为对照组。纳入标准:年龄≥60岁;对本研究知情同意。排除标准:存在影响观察指标的疾病或近期使用免疫抑制剂者;存在结核病以及其他危重疾病者。对照组研究对象年龄60~75(68.05±8.45)岁。3组研究对象的性别、基础疾病差异均无统计学意义(均P>0.05),老年结核病组和非老年结核病组的抗结核治疗情况差异亦无统计学意义(P>0.05),见表1。本研究经过武汉市新洲区人民医院医学伦理委员会审核批准。
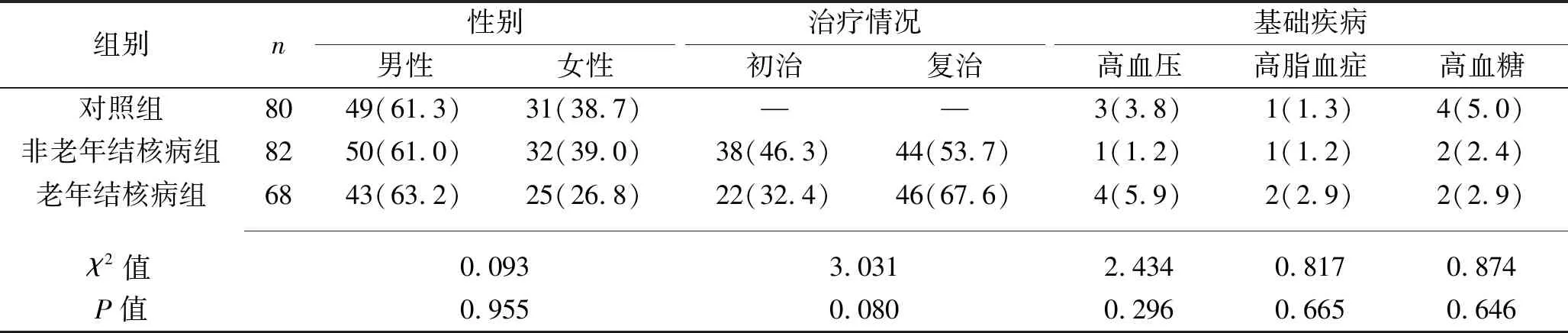
表1 3组研究对象临床资料的比较[n(%)]
1.2 主要试剂和仪器 磷酸缓冲盐溶液(phosphate buffered saline,PBS)、RPMI 1640培养基和胎牛血清均购自美国HyClone公司(批号:SH30256.01,SH30027,SV30087.01);抗人CD3 BV421、抗人CD4 BV510、抗人CD62L藻红蛋白(phycoerythrin,PE)-cy7、抗人CD69异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、别藻蓝蛋白(allophycocyanin,APC)标记的人PBS57/CD1d四聚体均购自美国BioLegend公司(批号:563797,562971,562404,560969,564175);抗人γ干扰素(interferon γ,IFN-γ)FITC、抗人CD白细胞介素4(interleukin 4,IL-4)PE-cy7、抗人CD161 PE、抗人CD122 FITC均购自美国eBioscience公司(批号:11-7311-41,25-7041-82,25-1619,11-1228);α-半乳糖苷神经酰胺(α-galactosylceramide,α-GalCer)购自美国Avanti Polar Lipids公司(批号:860833);淋巴细胞刺激剂氟波醇乙酯(phorbol 12-myristate 13-acetate,PMA)、离子霉素(ionomycin,Iono)、布雷菲德菌素A(brefeldin A,BFA)均购自美国Abcam公司(批号:ab147465,ab120370,ab120299)。FACSCalibur基本型流式细胞仪购自美国BD公司,MCO-175型CO2培养箱购自日本SANYO公司,96孔细胞培养板购自美国Costar公司。
1.3 检测方法 (1)外周血单个核细胞的制备:分别抽取对照组研究对象,老年结核病组与非老年结核病组患者治疗前的外周血5 mL,肝素抗凝,加入等体积的PBS稀释。取与血样样本等量的淋巴分离液加入15 mL离心管中,再将稀释好的血液加入分离液的上层,室温下2 000 r/min离心30 min。吸取中间的灰白色淋巴细胞层,移入另一试管内,加入10 mL PBS,室温下1 000 r/min离心10 min,PBS洗涤2次,弃上清,加入10 mL染色缓冲液重悬细胞,获得外周血单个核细胞(peripheral blood mononuclear cell,PBMC),调整细胞数至5×106个/mL,用含有10%胎牛血清的RPMI 1640培养液,置于37℃、5%CO2的培养箱中培养2 h。(2)iNKT比例、表型的检测:取100 μL的PBMC悬液,加入50 μL的染色缓冲液及相应的单克隆抗体染液(抗人CD3 BV421、抗人CD4 BV510、APC标记的人PBS57/CD1d四聚体、抗人CD161 PE、抗人CD62L PE-cy7、抗人 CD122 FITC、抗人CD69 FITC,以上抗体各5 μL),4℃避光孵育30 min。然后用PBS重悬,室温下1 500 r/min离心10 min,弃上清,再用PBS重悬沉淀。采用流式细胞仪检测iNKT占淋巴细胞的比例,以及iNKT表型CD69、CD161、CD62L、CD122的表达情况。(3)iNKT分泌细胞因子的能力分析:取100 μL的PBMC悬液,加入10 μL PMA(1 ∶100)、8μL Iono(1 ∶20),置于5%CO2培养箱中培养1.5 h 激活细胞,然后加入8 μL BFA(1 ∶10)继续培养3.5 h。将细胞转至流式管中,PBS洗涤1次,1 500 r/min离心10 min,50 μL染色缓冲液重悬PBMC后,加入抗人CD3 BV421、抗人CD4 BV510、APC标记的人PBS57/CD1d四聚体以及抗人CD161 PE(以上抗体各5 μL),4℃避光孵育30 min,PBS洗涤细胞1次,室温下1 500 r/min离心10 min,再用200 μL 4%多聚甲醛溶液固定20 min,加入破膜剂1 mL,室温下1 000 r/min离心10 min,加入50 μL染色缓冲液重悬细胞,加入抗人IFN-γ FITC、抗人CDIL-4PE-cy7各5 μL,4℃避光孵育30 min。PBS洗涤细胞1次,室温下1 500 r/min离心10 min。加入流式缓冲液重悬细胞,使用流式细胞仪检测IFN-γ阳性细胞比例和IL-4阳性细胞比例。另取等量PBMC悬液,不加入PMA/Iono刺激,检测细胞因子表达情况作为各组的阴性对照。(3)iNKT的扩增能力检测:将100 μL PBMC接种于96孔培养板,加入10 μL α-GalCer(200 ng/mL),置于37℃、5%CO2的培养箱中培养7 d。取10 mL细胞悬液,加入50 μL染色缓冲液及相应单克隆抗体染液(抗人CD3 BV421、抗人 CD4 BV510、APC标记的人PBS-57/CD1d四聚体等,以上抗体各5 μL),4℃避光孵育30 min。加入PBS,室温下1 500 r/min离心10 min,弃上清,沉淀再用PBS重悬。采用流式细胞仪检测iNKT被 α-GalCer刺激后的iNKT比例。另取等量PMBC悬液,接种于96孔板,用含有10%胎牛血清的RPMI 1640培养液置于37℃、5%CO2培养箱中培养7 d后进行检测,作为各组空白对照。
1.4 统计学分析 采用SPSS 19.0软件进行统计学分析。呈正态分布的计量资料以(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组研究对象外周血中iNKT占淋巴细胞的比例和表型的比较 3组iNKT占淋巴细胞的比例、CD69表达水平差异均有统计学意义(均P<0.05),其中老年结核病组的iNKT占淋巴细胞比例低于非老年结核病组及对照组(P<0.05),老年结核病组和非老年结核病组的CD69表达水平均高于对照组(P<0.05),但老年结核病组与非老年结核病组的CD69表达水平差异无统计学意义(P>0.05);3组的CD161、CD62L、CD122表达水平差异无统计学意义(均P>0.05)。见表2。
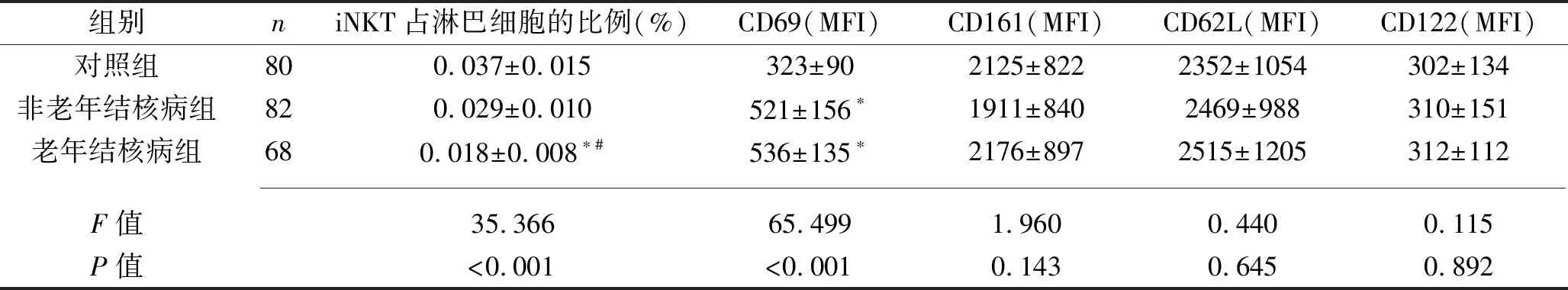
表2 3组研究对象外周血中iNKT占淋巴细胞的比例及其各表型的比较(x±s)
2.2 3组研究对象外周血中iNKT细胞因子分泌能力的比较 3组研究对象在PMA/Iono刺激后iNKT中INF-γ、IL-4分泌阳性细胞率均较刺激前增加(均P<0.05)。但3组在刺激前、刺激后的INF-γ、IL-4分泌阳性细胞率差异均无统计学意义(均P>0.05),见表3。
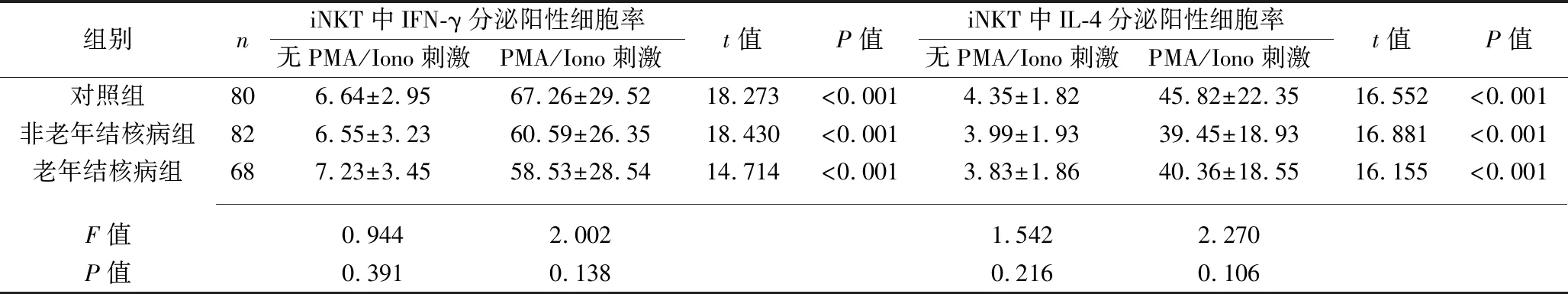
表3 3组研究对象iNKT细胞因子分泌能力的比较(x±s,%)
2.3 3组研究对象外周血中iNKT扩增能力的比较 对照组在α-GalCer刺激后iNKT占淋巴细胞的比例较刺激前增加(P<0.05);老年结核病组与非老年结核病组在α-GalCer刺激前后的iNKT占淋巴细胞比例差异无统计学意义(均P>0.05)。3组研究对象在α-GalCer刺激后iNKT占淋巴细胞比例差异有统计学意义(P<0.05),其中老年结核病组与非老年结核病组的iNKT占淋巴细胞比例均低于对照组(均P<0.05)。见表4。
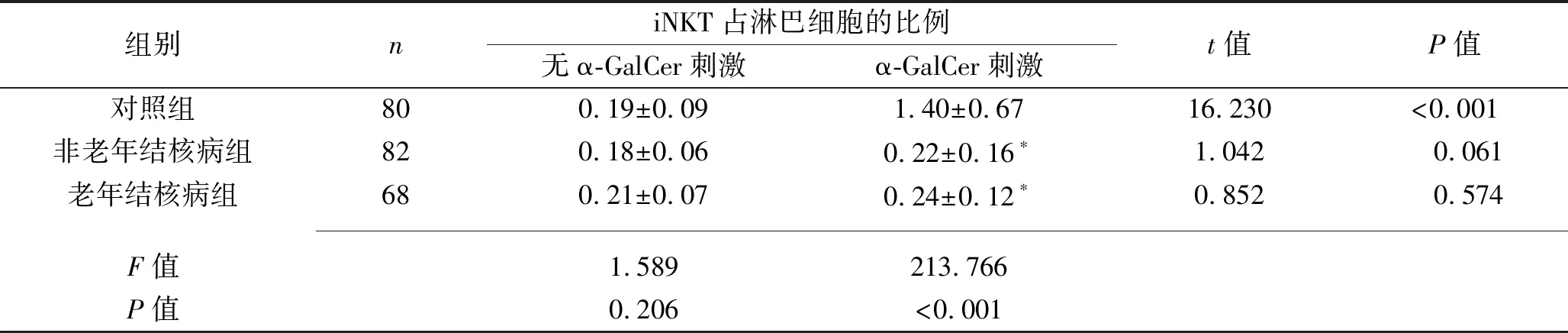
表4 3组研究对象外周血中iNKT扩增能力的比较(x±s,%)
3 讨 论
iNKT是一种广泛分布于外周血中,同时具有自然杀伤细胞和T淋巴细胞部分表型及功能的细胞亚群,能够发挥免疫调节及抗感染等重要作用。近年来,iNKT在结核病相关的免疫发病机制中的作用受到临床高度关注[6]。PBMC是机体免疫的重要组成部分,本研究将经过严格分离培养获得的足量PBMC作为检测标本,并采用CD3+PBS57/CD1d+来分选 iNKT,结果显示老年结核病患者外周血中iNKT占淋巴细胞的比例低于老年志愿者(P<0.05),这提示结核感染对老年患者iNKT水平有着较大影响。相关研究结果也表明,感染早期大量结核杆菌的存在会严重抑制机体免疫应答,造成部分iNKT的损失[7]。本研究进一步对iNKT进行表面染色,结果显示老年结核病组CD69表达水平高于对照组(P<0.05),其余iNKT表型差异无统计学意义(P>0.05)。CD69是T细胞体内活化的标志物,其高水平表达则表明iNKT处于过度活化状态[8]。近期有学者发现,iNKT活化后Fas与Fas配体表达的上调可促使 iNKT进入次级淋巴组织并发挥 Fas配体介导的杀伤效应,会导致iNKT数量减少[9-10]。由此推测,iNKT活化后凋亡可能也是造成老年结核病患者外周血中iNKT比例下降的主要原因之一。
iNKT可以分泌IFN-γ(Th1型)、IL-4(Th2型)等多种细胞因子,诱导树突状细胞的活化和成熟,具有双向介导保护性和调节性免疫应答的功能[11]。本研究通过PMA/Iono刺激PBMC,采用胞内细胞因子染色法分析iNKT的分泌能力。结果显示,在PMA/Iono刺激前,老年结核病患者与老年志愿者iNKT细胞中IFN-γ和IL-4分泌阳性细胞率均保持在较低水平,经PMA/Iono刺激后IFN-γ和IL-4分泌阳性细胞率均有明显提升(均P<0.05),但刺激前后两组之间的INF-γ和IL-4分泌阳性细胞率差异并无统计学意义(均P>0.05),表明在老年结核病患者体内iNKT虽然数量减少并且过度活化,但仍对PMA/Iono反应正常,其分泌细胞因子的潜能并未发生明显减弱。近期一项针对HBV慢性感染患者的研究结果显示,感染者外周血中的iNKT经PMA刺激后分泌INF-γ和IL-4的能力与正常对照组无明显差异,而且发现在HBV感染过程中机体可能通过血清IL-15等细胞因子的负反馈调节机制来维持iNKT部分的细胞因子分泌能力[12]。我们推测,在结核病患者中可能也存在着与之类似的调控机制,这有待后续研究进一步论证。
α-GalCer是iNKT最强的激动剂,其可经由T淋巴细胞受体途径的非特异性刺激,有效增强CD1d脂类抗原的提呈能力,能够全面地反映iNKT的真实功能状态[13]。因此本研究在PBMC中加入α-GalCer后进行检测,结果显示在α-GalCer刺激后,老年志愿者iNKT占淋巴细胞的比例较刺激前提升(P<0.05),而老年结核病组刺激前后的iNKT占淋巴细胞比例差异无统计学意义(P>0.05),表明老年结核病患者机体中的iNKT对α-GalCer具有低反应性,细胞功能受损严重,导致体外扩增效率降低。同时也进一步提示,在结核病iNKT分泌能力保持正常的状态下,其功能缺陷更可能是由其自身T淋巴细胞受体基因表达受限,导致iNKT无法经α-GalCer刺激在体内正常活化扩增造成[14]。
另外,本研究还比较了不同年龄段结核病患者外周血iNKT的特点,结果显示老年结核病组iNKT占淋巴细胞的比例低于非老年结核病组(P<0.05),但两组患者iNKT的细胞因子分泌能力与扩增能力差异均无统计学意义(均P>0.05)。研究表明,随着年龄的增长,人体的细胞免疫功能会出现明显下降,对于结核病患者,这可能会导致机体相关效应细胞对结核杆菌的吞噬作用下降,抗原体提呈功能减弱[15],使得体内结核杆菌持续存在并维持适度的增殖活性,影响了淋巴细胞的正常表达水平和状态[16]。因此,老年结核病患者外周血iNKT比例较非老年结核病患者更低。但老年结核病患者病情复杂,受限于本研究样本量,关于年龄对iNKT细胞的具体影响需要进一步扩大研究分析。
综上所述,老年结核病患者外周血中iNKT比例下降明显,并呈过度活化状态,细胞因子分泌能力正常,但扩增效率降低。

