原发性干燥综合征41例CNS临床特点分析
张志刚,常利华,任静
原发性干燥综合征(pSS)是一种以淋巴细胞浸润和B细胞高反应性为特征的慢性自身免疫性疾病,主要累及泪腺和唾液腺,引起患者眼干、口干等不适[1]。除此之外,pSS还能引起皮肤、胃肠、肾脏、肺、血液、神经等多系统损害[2-3]。有研究[4]发现,神经系统病变是pSS腺外损害的常见类型,占pSS患者的8.5%~70%,周围神经病变占大多数,CNS病变相对少见,占2%~25%[5-6]。CNS的pSS(CNS-pSS)临床表现多样,容易误诊漏诊,且部分患者病情危重,常遗留功能障碍影响生活质量。本研究对41例CNS-pSS患者的临床症状、实验室指标、影像学结果、治疗方案及预后情况进行回顾性分析,以期提高临床医生对本病的认识。
1 对象与方法
1.1 对象 系2009年1月至2017年12月在中国医科大学附属盛京医院风湿免疫科或神经内科住院治疗的CNS-pSS患者。纳入标准:(1)年龄≥18周岁。(2)pSS的诊断符合2002年pSS的分类标准[7]。(3)CNS-pSS诊断由1名神经内科高级职称医师和1名风湿科高级职称医师共同确定,需满足以下3点:①患者有CNS症状,包括脑病症状、无菌性脑膜炎、精神/认知障碍、运动感觉异常、失语、共济失调、癫痫、震颤、视力下降等;②头颅/脊髓MRI或CSF检查提示CNS病变;③排除脑血管病、感染、其他风湿系统疾病(系统性红斑狼疮、类风湿性关节炎等)以及药物不良反应引起的CNS病变,排除IgG4相关性疾病、淋巴瘤、脓肿、转移瘤和结节病等,考虑CNS病变与pSS直接相关[8-10]。
1.2 方法
1.2.1 临床资料的收集 收集患者的一般临床资料(性别、年龄、pSS确诊到合并CNS病变时间)、临床症状、实验室指标、头颅/脊髓MRI、CSF检查、治疗用药和预后情况。临床症状包括口眼干、脑病症状、精神和认知障碍、运动感觉异常、失语、共济失调、震颤、视力下降等。认知障碍由主管医师采用蒙特利尔认知评估量表(MoCA量表)进行评分评定,≥26分正常。
1.2.2 血液指标检测 所有患者于入院第2 d空腹抽取静脉血标本,检测血沉、C反应蛋白、免疫球蛋白IgA、免疫球蛋白IgM、免疫球蛋白IgG、抗核抗体(ANA)滴度、抗dsDNA抗体、抗干燥综合征A抗体(抗SSA抗体)、抗干燥综合征B抗体(抗SSB抗体)、抗Ro-52抗体。部分患者腰穿检测CSF生化(白细胞计数、糖、蛋白、氯化物),部分患者进行血清和CSF寡克隆带/水通道蛋白-4(AQP-4)抗体检测。
1.2.3 影像学资料 于入院后采用3.0 T超导MR扫描仪及8通道相控阵线圈对患者进行扫描,扫描序列包括T1WI、T2WI、Flair、DWI、T1增强。部分患者行全脑DSA或CTA检查。单灶长节段脊髓病灶是指单个脊髓病灶累及至少3个脊柱节段。影像资料由1名放射科高级职称医师评估审核。
1.2.4 随访 出院后通过门诊复诊或住院治疗两种方式随访。截止时间为2018年12月31日,失访5例。
2 结 果
2.1 CNS-pSS患者的一般情况 2009年1月至2017年12月在中国医科大学附属盛京医院风湿免疫科或神经内科住院治疗的pSS患者共1 748例,符合本研究入选标准及排除标准的病例41例,CNS-pSS发生率为2.35%(41/1 748)。其中女性38例(92.68%),年龄25~72岁,平均(53.39±3.90)岁。7例(0.4%)以CNS病变为首发症状,34例在pSS诊断后第0.5~20年内出现CNS症状,CNS症状出现时pSS的平均病程为(3.78±2.06)年。
2.2 CNS-pSS患者CNS临床症状特点 眼口干患者35例(85.36%),以CNS为首发症状的pSS患者中眼干、口干仅1例(14.28%)。头晕头痛24例(58.54%),肢体无力16例(39.02%),感觉异常11例(26.83%),言语障碍9例(21.95%),视力下降7例(17.07%),饮水呛咳吞咽困难5例(12.20%),尿潴留4例(9.76%),认知功能下降3例(7.32%)(MoCA量表评分为19分、20分、22分),肢体抖动2例(4.88%),面部麻木2例(4.88%),意识障碍2例(4.88%),上睑下垂1例(2.43%),痫性发作1例(2.43%)。
2.3 CNS-pSS患者免疫指标及CSF检查结果 血沉增快22例(53.65%),C反应蛋白升高11例(26.82%),IgA升高4例(9.75%),IgM升高1例(2.43%),IgG升高29例(70.73%),ANA升高39例(95.12%),而ANA≥1∶1 000者15例(36.59%),抗SSA抗体阳性33例(80.48%),抗SSB抗体阳性18例(43.9%),抗Ro-52抗体阳性12例(29.26%),抗dsDNA抗体阳性4例(9.75%),抗线粒体抗体M2阳性3例(7.31%),抗Sm抗体阳性2例(4.87%),抗核小体抗体阳性1例(2.43%)。30例患者行CSF检查,正常者1例(3.33%),29例(96.67%)存在CSF指标异常。其中,白细胞计数升高者18例(60.00%),范围(12~38)×106/L;蛋白定量升高17例(56.67%),范围0.49~1.18 g/L,葡萄糖及氯化物均无异常;CSF IgG升高9例(30.00%),范围11.7~36.4 mg/L。3例患者行血清及CSF寡克隆带检测,仅1例CSF中检测到1条寡克隆带。6例患者行血清和CSF AQP-4抗体检测,血清和CSF AQP-4抗体均阳性3例(50.00%),单独CSF AQP-4抗体阳性1例(16.67%)。
2.4 CNS-pSS患者的影像学特点 见图1、图2。41例患者均行MRI检查(头颅MRI 38例,脊髓MRI 7例),14例行增强MRI检查,1例行DSA检查,3例行CTA检查。脑实质和脊髓内病灶均为T1低信号,T2高信号,Flair高信号。DWI高信号6例,等信号35例,4例患者增强可见点状或斑片状强化效应,10例增强无强化效应。1例患者行DSA发现动脉瘤,2例患者头颅CTA发现动脉狭窄。41例患者中单一病灶6例(14.63%),其中脊髓病变3例,延髓病变1例,小脑病变1例,胼胝体病变1例。多发病灶35例(85.37%),脑室旁白质病灶28例(68.29%),合并皮质下白质23例(56.10%),合并脑干或脊髓5例(12.20%)。额叶病灶25例(60.98%),顶叶病灶13例(31.71%),脑干病灶6例(14.63%),颞叶病灶2例(4.88%),枕叶病灶2例(4.88%),小脑病灶2例(4.88%),胼胝体病灶1例(2.44%)。脊髓病灶7例(17.07%),脊髓合并脑干1例(2.44%),脊髓合并脑室旁白质1例(2.44%),单灶长节段脊髓病灶3例(7.32%)。
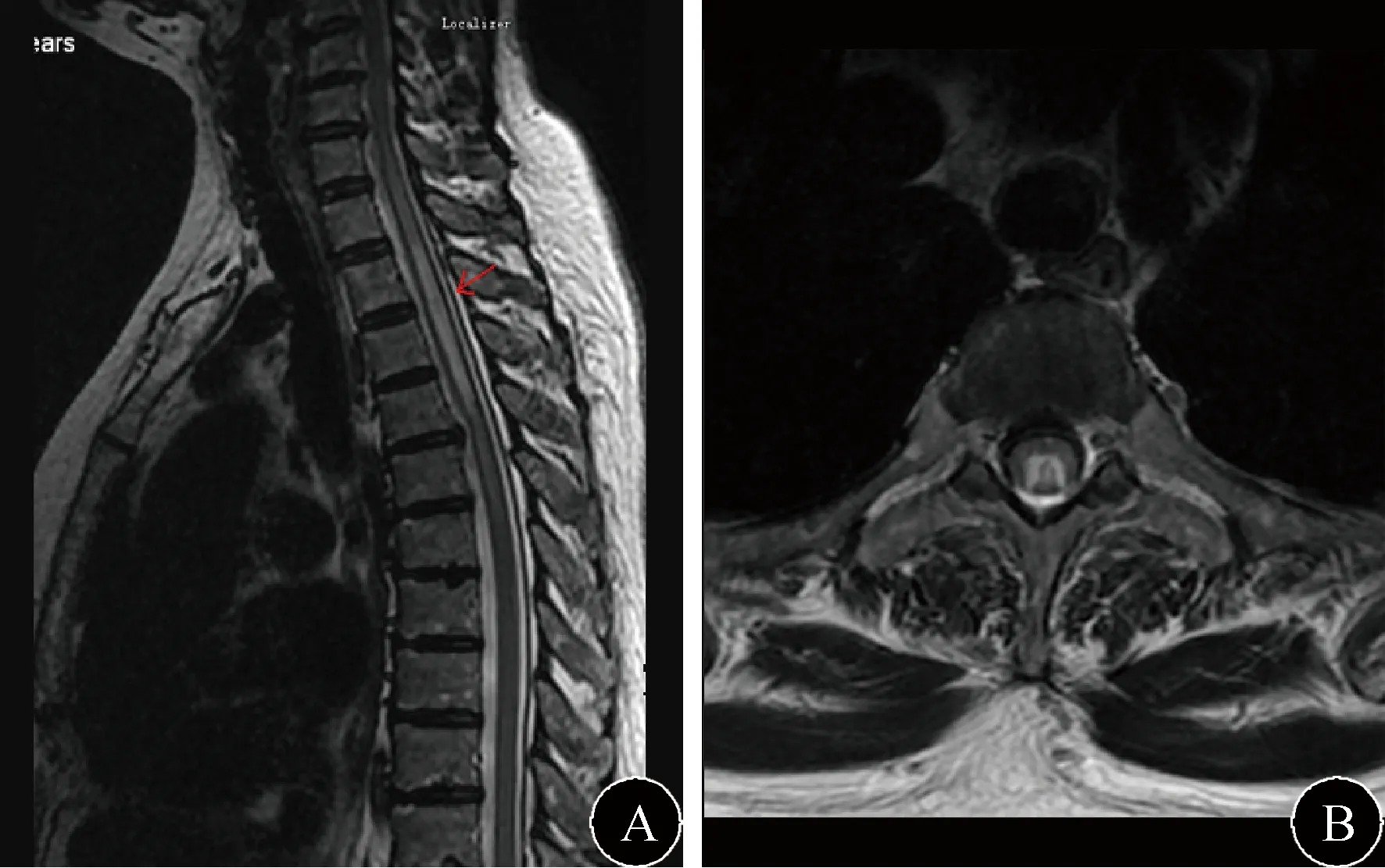
图2 患者脊髓MRI结果 A:脊髓C8~T5节段T2序列高信号;B:脊髓轴位可见髓内“八”字形异常高信号
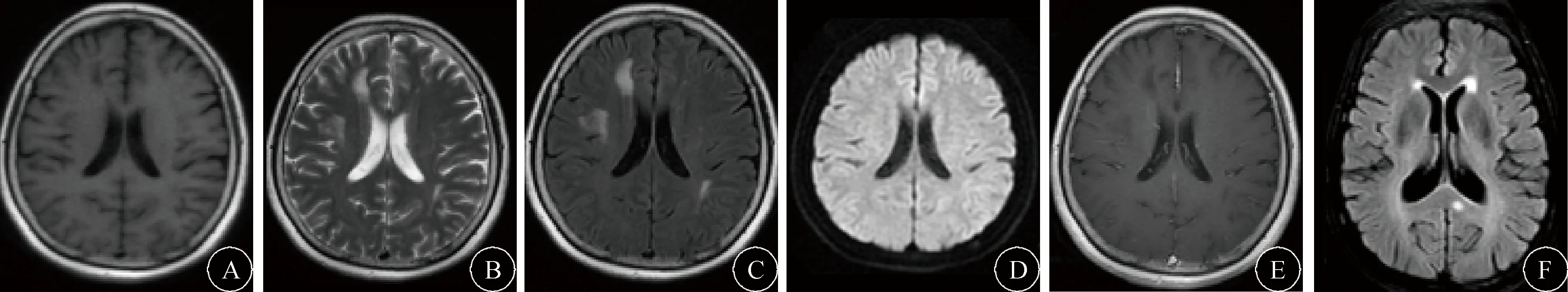
图1 患者头颅MRI结果 A:右侧额叶T1低信号;B:右侧额叶、脑室旁及左侧脑室后角旁片状T2高信号;C:右侧额叶、脑室旁及左侧脑室后角旁片状Flair高信号;D:DWI未见弥散受限;E:T1增强序列无强化效应;F:同一患者1年后复查头颅MRI胼胝体新增病灶
2.5 治疗方案和预后 所有患者根据临床特点和影像学检查结果予糖皮质激素或糖皮质激素联合免疫抑制剂治疗。糖皮质激素治疗27例(甲泼尼松龙-泼尼松序贯治疗9例,泼尼松口服18例);糖皮质激素冲击联合免疫抑制剂治疗14例(包括7例脊髓病变患者),免疫抑制剂分别为环磷酰胺3例,硫唑嘌呤4例,利妥昔单抗6例,1例患者采用地塞米松联合甲氨蝶呤鞘内注射治疗。41例患者中失访5例,36例患者随访时长1~6年,平均(3.2±1.4)年。其中22例(61.11%)患者临床症状缓解,14例(38.89%)临床复发(4例脊髓病变)。36例患者均复查MRI,30例(83.33%)病灶个数或面积增加(图1A),仅6例(16.67%)患者病灶减少。
3 讨 论
国内外研究[8,11]发现,CNS病变是pSS的主要并发症,但各研究得出的CNS-pSS发病率差异较大(2.5%~60% )。目前CNS-pSS病变尚无统一的诊断标准,发病率差异较大可能与研究病例选择偏倚有关。本研究统计了1 748例pSS患者,合并CNS病变41例(2.35%),这与一项在法国进行的队列研究[12]结果相近(3.5%)。本研究41例患者平均年龄(53.39±3.90)岁,女性38例,占92.68%。以CNS为首发症状者7例(0.4%),均为脊髓病变,首诊于神经内科。Massara等[10]进行的一项研究中,纳入了pSS患者424例,其中以CNS病变为首发症状的患者13例,发病率为3%。本研究神经系统首发症状比例较低,可能与pSS样本量较大且为单中心研究有关,大样本多中心研究可能会减少偏倚的影响。
本研究发现,pSS的CNS表现复杂多样,临床症状可有头晕、头痛、肢体无力、感觉异常、言语障碍、视力下降、饮水呛咳吞咽困难、认知功能下降、尿储留、肢体抖动、面部麻木、意识障碍、上睑下垂和痫性发作等。本研究中头晕头痛患者占一半以上(58.54%),单纯头痛8例患者均行腰穿检查确诊为无菌性脑膜炎。Fauchais等[4]研究发现,无菌性脑膜炎在pSS患者中并不少见,可能与脑膜血管炎症有关,可引起头痛、脑膜刺激征等表现,伴或不伴发热。因此,对于pSS伴头痛建议必要时做腰穿以明确是否存在无菌性脑膜炎,有利于早期诊断和治疗。多项研究[13-14]发现,pSS患者可以出现认知功能下降,甚至可作为首发症状出现,本研究中认知功能下降3例(7.32%),与Hou等[13]的研究结果相似。
在免疫指标方面,本研究发现,53.65%的CNS-pSS患者血沉升高;免疫球蛋白以IgG升高为主,占70.73%;95.12%的患者ANA升高,其中ANA≥1∶1 000者占36.59%,80.48%的患者抗SSA抗体阳性,43.9%的患者抗SSB抗体阳性。同时,抗Ro-52抗体阳性率较高,占29.26%。Tobón等[15]研究发现,CNS-pSS患者的抗Ro-52抗体阳性率比非CNS-pSS患者高,抗Ro-52抗体阳性可能是CNS-pSS病变的预测指标。抗SSA抗体与CNS-pSS的关系目前仍存在争议。一项研究[16]发现,pSS神经系统并发症与抗SSA抗体无关。也有研究[17]表明,CNS-pSS病变及病情严重程度与抗SSA抗体有关。本研究抗SSA抗体阳性率(80.48%)明显高于研究[18]中的结果(60%~70%),可能与pSS合并CNS病变有关。建议对pSS患者进行全面的抗体检测筛查CNS病变。本研究30例患者完成CSF检测,96.67%存在CSF异常,以白细胞计数升高、蛋白升高、IgG升高为主。CSF白细胞升高比率高于Pars等[19]的研究结果,可能与本研究病例入选标准较严格有关。3例患者行血清及CSF寡克隆带检测,仅1例CSF中检测到1条寡克隆带。抗AQP-4抗体在复发性脊髓受累的pSS患者中阳性率明显升高,被认为与pSS出现视神经及脊髓受损有关,并参与了发病过程[20]。本研究中脊髓受累的7例患者有6例行抗AQP-4抗体检测,4例阳性,疾病均复发,因此结合病情完善CSF常规、寡克隆带及抗AQP-4抗体检测对诊断及预后评估具有重要意义。
MRI在检测CNS-pSS方面敏感性高于CT,CNS-pSS患者的头颅MRI常表现为脱髓鞘改变,主要累及皮质下及脑室周围白质,灰质受累相对少见,病灶大多表现为T1低信号、T2高信号。 pSS合并脊髓病变(SSM)患者累及颈胸节段多见,腰髓受累少见,病灶常超过3个椎体节段, 呈长条状或斑片状, T1低信号、T2高信号, 急性期可伴部分病灶强化[21]。 本研究41例患者中,脑部受累36例,脊髓受累7例,脑和脊髓均受累2例。病灶特点为T1低信号,T2高信号,Flair高信号,DWI等或高信号,T1增强部分强化,这与Massara等[10]的研究结果相一致。然而本研究存在一定局限性,仅34.15%(14例)患者完成MRI增强扫描,其中4例存在强化效应,期待将来更大样本量来分析CNS-pSS病变影像学特点。本研究发现CNS-pSS以多发性病灶为主,占85.37%。易受累部位依次为脑室旁白质、额叶、顶叶、脑干,颞叶,枕叶,小脑,胼胝体。研究发现,SSM患者病灶可以为多发局灶性分布[22],也可以表现为长节段横贯性分布,且以后者最为常见[1]。本研究7例SSM患者中,5例为长节段脊髓病变,与Perzyńska-Mazan等[1]的研究结果一致。本研究发现脊髓病变可以合并脑干或侧脑室旁白质病变,因此对于脊髓病变患者若有脑部症状建议完善头颅MRI检查以防漏诊。
CNS-pSS患者可以出现肢体麻木无力、视觉障碍等症状,同时MRI类似脱髓鞘改变不易与多发性硬化(MS)及视神经脊髓炎谱系疾病相区分,可以从以下方面鉴别:(1)CNS-pSS患者发病年龄通常>40岁,本研究平均年龄53.39岁,而MS患者多为青中年;(2)CNS-pSS患者MRI上的病变范围通常比MS小;(3)CNS-pSS患者CSF中检测到的寡克隆区带数通常较少,一般为1~2条,而MS患者一般多于3条[23]。本研究的不足之处在于仅3例患者行血清及CSF寡克隆带检测,其中1例CSF中检测到1条寡克隆带。期待更多关于CNS-pSS病变CSF相关研究为临床诊疗提供参考。
目前关于CNS-pSS的治疗方案尚无统一标准,大多根据专家经验和病案报道。Delalande等[9]研究发现,对急性起病、快速进展的CNS-pSS患者予大剂量糖皮质激素[甲泼尼松龙1 g/d静滴3~5 d,序贯泼尼松1 mg/(kg·d)口服一个月]联合每月静脉输注环磷酰胺(700 mg/m2)治疗,在2~3个月内将泼尼松减量为10 mg/d,长期维持可以缓解临床症状,也可以选择硫唑嘌呤或霉酚酸酯维持治疗。然而小样本研究[24]提示利妥昔单抗对pSS累及颅内病变者疗效不确切。SSM患者急性期治疗首选大剂量糖皮质激素(甲泼尼松龙1 g/d静滴5 d),如果无效可以考虑血浆置换。缓解期需要硫唑嘌呤、利妥昔单抗或霉酚酸酯维持治疗[25-26]。本研究治疗方案中单纯口服激素18例,糖皮质激素冲击9例,糖皮质激素冲击联合免疫抑制剂14例,其中1例患者采用地塞米松联合甲氨蝶呤鞘内注射治疗临床症状改善。目前有关CNS-pSS患者预后的资料较少,本研究36例患者完成随访,平均时间3.2年,大部分患者临床症状缓解(22/36, 61.11%),14例临床复发,成功随访的6例脊髓病变患者中有4例复发,复发者AQP-4抗体均阳性,提示AQP-4抗体可能是SSM患者复发的预测指标。虽然大部分随访患者临床症状缓解,但复查头颅/脊髓MRI发现30例病灶数量或病灶体积增加,提示疾病仍在进展。
CNS-pSS发病率低,复发率高,且可能遗留神经功能障碍影响生活质量。头晕、头痛、肢体无力感觉异常为其常见临床表现。糖皮质激素及免疫抑制剂可以改善大部分患者的临床症状,但不能完全阻止疾病进展,更有效的治疗方法有待进一步研究。

