MMP-2和MMP-9基因在牦牛肌肉组织的表达分析
欧阳谭亮,武志娟,信金伟,柴志欣,王吉坤,王海波,张 明,钟金城*
(1.青藏高原动物遗传资源保护与利用四川省、教育部重点实验室,成都 610041;2.省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,拉萨 850002)
基质金属蛋白酶(Matrix metalloproteinases,MMPs)是一类在动物组织中广泛存在、结构相近而功能复杂的Zn2+、Ca2+依赖性蛋白水解酶家族,可由骨骼肌干细胞、平滑肌细胞、成肌细胞等多种肌细胞分泌[1-2],主要通过介导细胞外基质(Extracellular matrix,ECM)降解参与调控肌肉生长发育过程。根据MMPs降解底物及结构特征可将其分为6种类型:明胶酶、胶原酶、间质溶解素、基质溶解因子、膜型基质金属蛋白酶及其他类型基质金属蛋白酶。明胶类酶MMPs包含MMP-2和MMP-9两种,在机体中主要受基质金属蛋白酶抑制剂(Matrix metalloproteinase inhibitor,TIMP)调控,与TIMPs互作可调控肌肉组织相关功能。
研究显示,畜禽肌肉生长发育程度与其肉品质高度相关,明胶类酶MMPs可通过降解底物调控肌肉ECM中胶原蛋白含量,参与肌肉生长发育及修复等生物过程[3-4],影响肌肉品质。Michenlin等发现,富含大理石纹的牛肌肉组织ECM中含有大量胶原蛋白,且肌纤维含量高的牛肉中MMP-2酶活性也更高[5]。祁艳霞等通过分析不同年龄南阳牛背最长肌中MMP-2、MMP-3和MMP-13基因表达水平与肉质指标关系,发现MMP-2与肌内脂肪(Intramuscular Fat,IMF)沉积相关,且在背最长肌中表达水平随年龄增长显著下降[6]。Park等发现在阉牛和公的背最长肌中,MMP-9表达量与肌纤维含量呈正相关[7]。
牦牛具有抗逆、耐粗饲、抗病能力强等优势,是青藏高原不可或缺的重要畜种[8]。牦牛肉具有高蛋白、低脂肪,富含多种营养物质等特点,是优质天然的绿色食品。牦牛骨骼肌生长发育,对其肉质有重要影响。研究表明,MMP-2与MMP-9对普通牛肉质均有影响,但有关牦牛MMP-2、MMP-9基因相关研究尚未见报道。此外,相关研究显示明胶类酶MMPs在动物心肌组织中表达,可防止动物心肌肥大[9-10],且MMP对牦牛低氧适应性也具有影响[11]。本研究通过对牦牛MMP-2和MMP-9基因测序及生物信息学分析、组织差异表达研究,探索其对牦牛肉质与肌肉生长发育的影响,以期为牦牛良种选育和改良提供理论依据。
1 材料与方法
1.1 试验材料与试剂
于四川省阿坝藏族羌族自治州红原县选取0.5、1.5和2.5岁健康麦洼牦牛各3头,分别采集心脏和臀大肌组织,使用DEPC水冲洗干净,锡箔纸包裹,将其迅速置于液氮中保存,带回实验室备用。
试验主要试剂:TaqDNA聚合酶、dNTPs购自博迈德生物公司;RNA提取试剂Trizol购自Invitrogen公司;RNA反转录试剂盒、TBGreen Premix ExTaqⅡ均购自TaKaRa公司;琼脂糖凝胶DNA纯化回收试剂盒购自北京天根生化科技有限公司;鼠抗MMP-2、MMP-9单克隆抗体购自美国Novus Biologicals公司。
1.2 基因克隆与测序
利用Trizol法提取组织总RNA,1%琼脂糖凝胶电泳检测RNA片段,紫外分光光度计检测RNA浓度及纯度,反转录为cDNA,-20℃保存备用。
参照GenBank中黄牛MMP-2 mRNA序列(NM_174745.2)和MMP-9 mRNA序列(NM_174744.2),选取GAPDH(XM_014482068)为内参基因,利用Primer Premier 5软件和NCBIPrimer-BLAST在线软件设计引物,分别扩增MMP-2和MMP-9基因CDS区,根据克隆所得序列设计实时荧光定量PCR引物(见表1),引物由北京擎科梓熙(成都)生物技术有限公司合成。
PCR扩增体系(15μL):上下游引物各0.6μL、cDNA模板0.6μL、ddH2O 5.7μL、2×TaqPCR MasterMix 7.5μL。PCR反应条件:95℃预变性5 min,95℃变性30 s,退火温度见表1,72℃延伸90 s,循环35次,72℃延伸7 min,4℃保存。PCR产物用1%琼脂糖凝胶电泳检测。测序所得序列利用DNAMAN软件拼接组装,获得牦牛MMP-2和MMP-9基因序列,NCBI-BLAST在线比对工具核对CDS区。
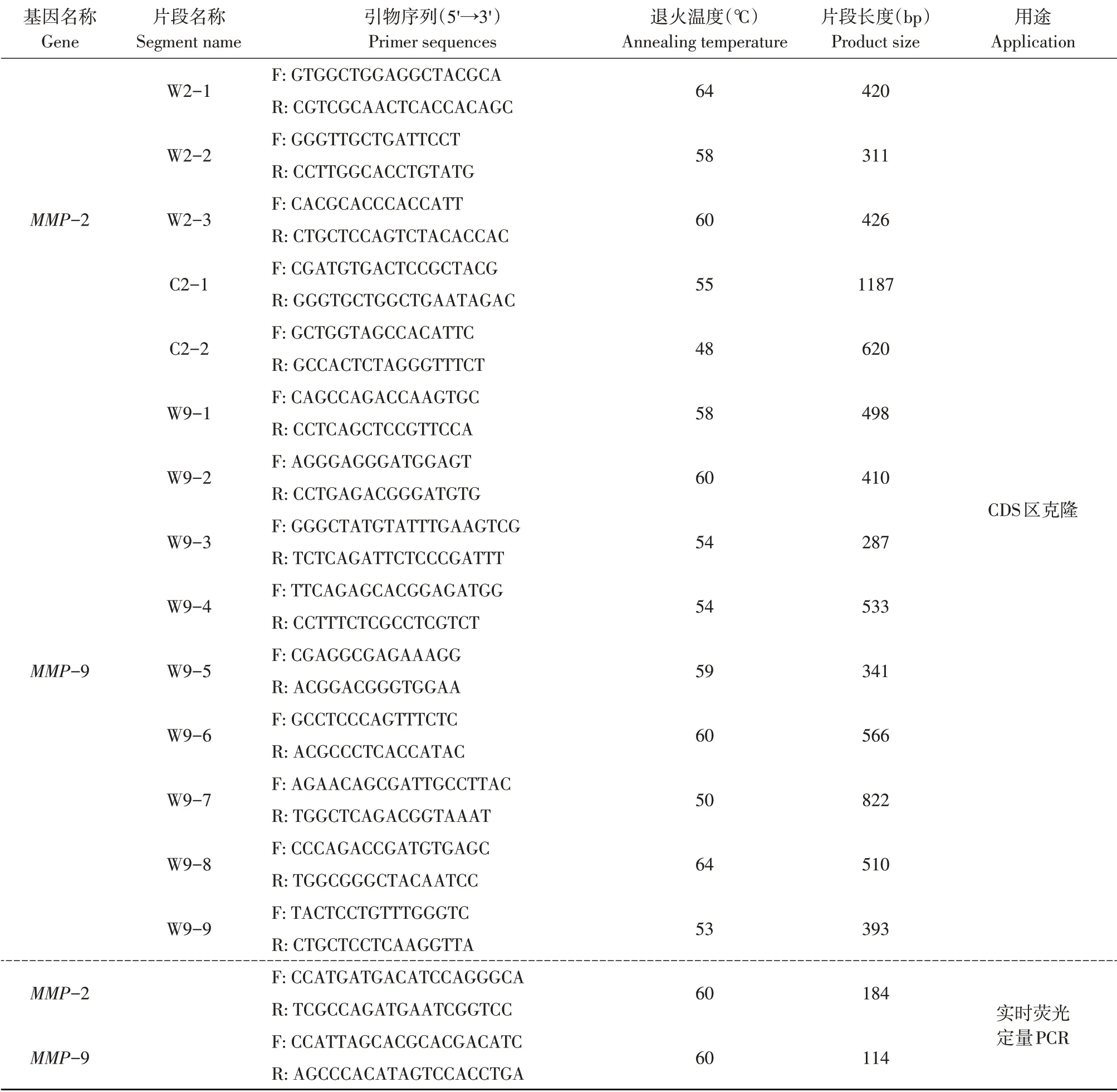
表1 牦牛MMP-2和MMP-9基因克隆引物序列信息Table 1 Primer sequence of yak MMP-2 and MMP-9 genes for cloning

续表
1.3 组织差异表达分析
分析MMP-2、MMP-9及其相关基因和底物基因MMP-14、TIMP-2、CL1A1(Ⅰ型胶原蛋白)和CL3A1(Ⅲ型胶原蛋白)在0.5、1.5和2.5岁牦牛心肌和臀大肌组织中表达量。反应体系(10μL):TB Green Premix ExTaqⅡ5μL、上下游引物各0.4μL、ddH2O 3.2μL、模板cDNA 1μL。反应程序:95℃预变性30 s,95℃变性5 s,60℃退火30 s,共40个循环。
1.4 免疫组织化学分析
将不同年龄牦牛臀大肌从4%多聚甲醛固定液中取出,制成石蜡切片,使用5%胎牛血清封闭,分别以鼠抗MMP-2、MMP-9单克隆抗体(1∶100)为一抗,4℃孵育过夜;以辣根过氧化物酶标记的多聚山羊抗鼠IgG(1∶200)为二抗。经免疫组化观察MMP-2和MMP-9蛋白在不同年龄牦牛臀肌中表达情况。
1.5 数据统计分析
每个基因分别设置3个生物学重复和3个技术重复,以GAPDH为内参采用2-ΔΔCt法计算目的基因相对表达量。利用SPSS22.0软件作单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。利用Image-Pro Plus 6.0测定肌纤维着色面积及免疫组化相对平均光密度值,并用GraphPad Prism5绘制MMP-2、MMP-9在臀大肌和心脏组织中mRNA转录水平和组化结果分析图。
2 结果与分析
2.1 牦牛MMP-2和MMP-9基因CDS区大小
分别获得牦牛MMP-2和MMP-9基因片段长度一致的清晰条带(见图1),通过拼接可知MMP-2基因CDS区全长为1 983 bp,开放阅读框1 209 bp,共编码402个氨基酸;MMP-9基因CDS区全长为2 137 bp,开放阅读框1 329 bp,编码442个氨基酸,序列信息已提交NCBI,MMP-2和MMP-9登录号分别为MZ476247和MZ476248。
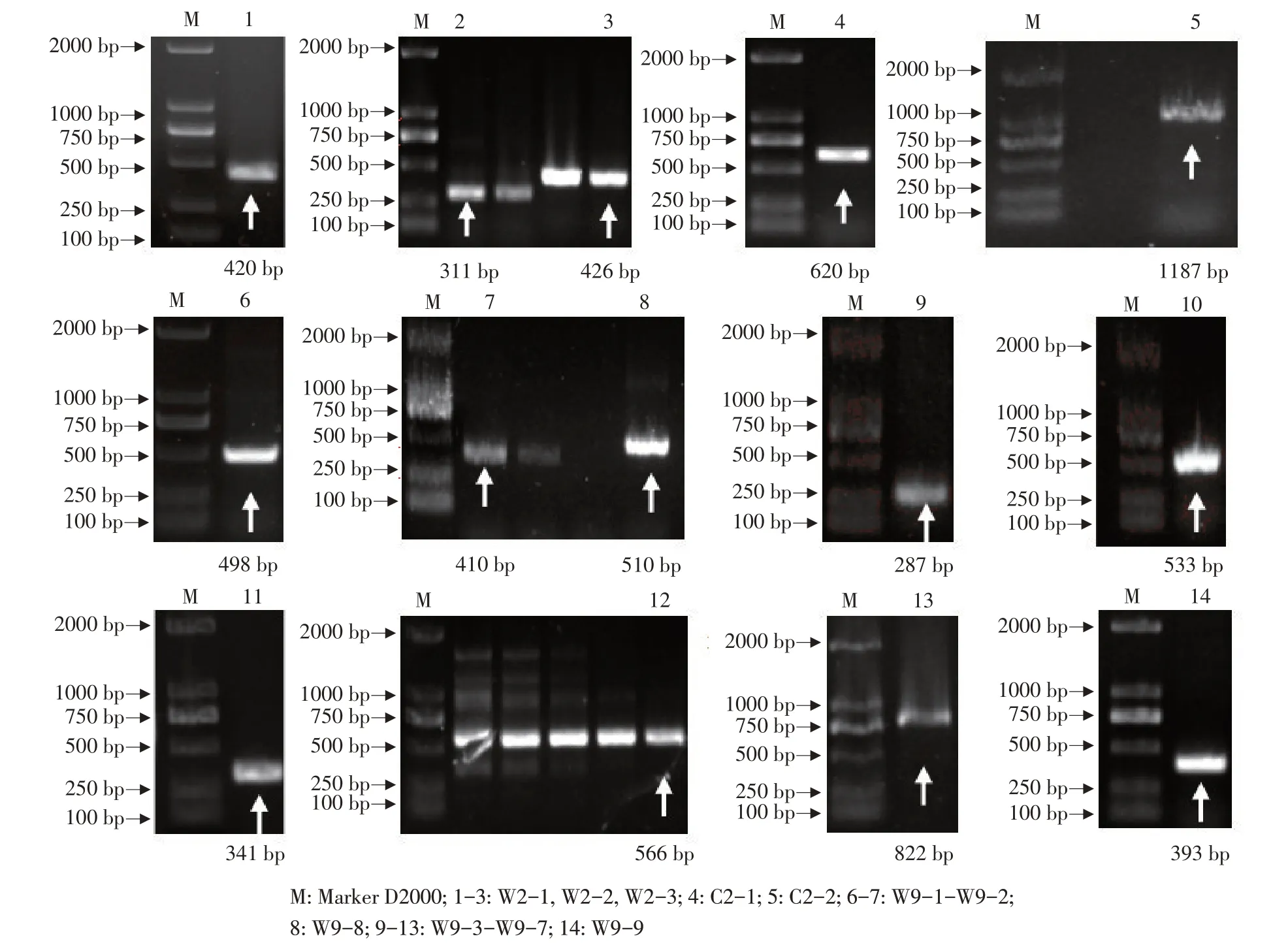
图1 牦牛MMP-2和MMP-9基因PCR扩增结果Fig.1 PCRamplification resultsof MMP-2 and MMP-9 genesin yak
2.2 牦牛MMP-2和MMP-9基因似性及系统进化关系
利用MegAlign 7.0软件分别将牦牛MMP-2和MMP-9基因序列与穴兔、斑马鱼、小家鼠、黄牛、家鸡、猕猴、灰仓鼠、野猪、家犬、绵羊、马、北美虹鳟鱼、虎斑颈槽蛇和乌鸦相应基因序列作比对(见表2)。
由表2可知,牦牛与黄牛序列相似性最高,与斑马鱼序列相似性最低。系统进化树显示,牦牛与黄牛亲缘关系最近,其次是绵羊,而与斑马鱼、北美虹鳟鱼、乌鸦和虎斑颈槽蛇等动物亲缘关系最远(见图2)。
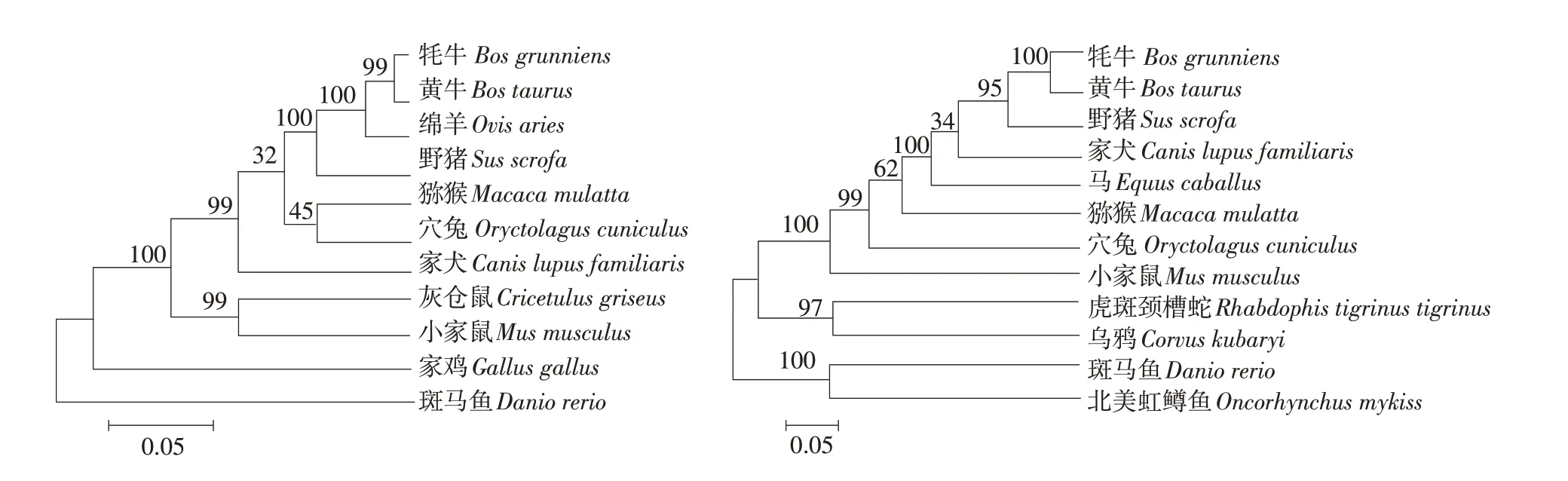
图2 牦牛MMP-2(左)和MMP-9(右)基因系统进化树Fig.2 Phylogenetic tree of MMP-2(left)and MMP-9(right)
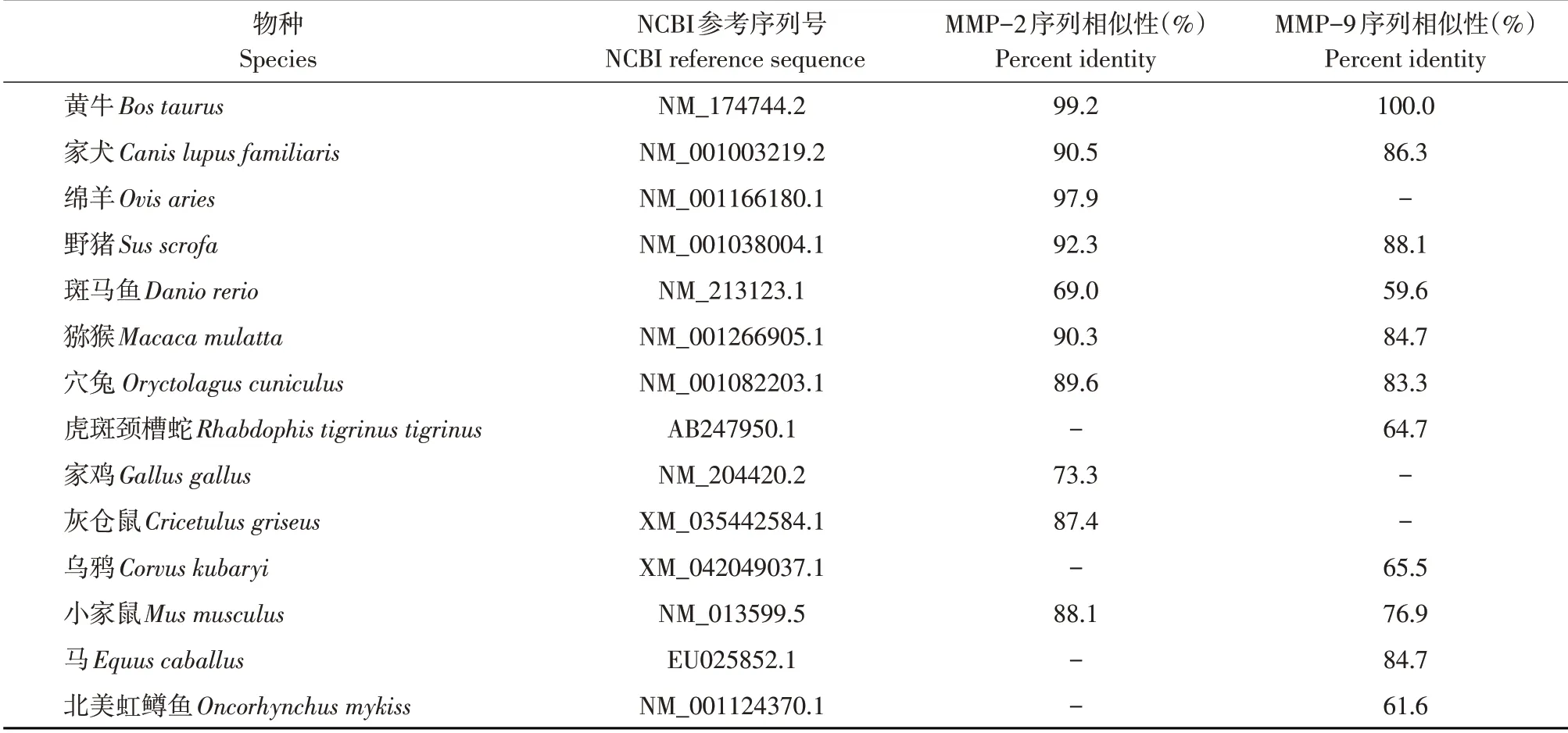
表2 牦牛MMP-2和MMP-9基因与其他物种序列相似性比对Table 2 Comparison of MMP-2 and MMP-9 sequence similarity between yak and other species
2.3 牦牛MMP-2和MMP-9蛋白理化性质预测
使用ExPASy中Prot Param和ProtScale程序预测MMP-2和MMP-9蛋白理化性质。结果表明,MMP-2和MMP-9蛋白均为亲水性酸性蛋白,二者甘氨酸(Gly)含量最高,其次为天冬氨酸(Asp)和亮氨酸(Leu);不稳定系数分别为34.72和42.82,故MMP-2属于稳定蛋白,MMP-9属于不稳定蛋白。通过在线软件ExPASy-TMpred、SignalP 5.0预测,发现MMP-2与MMP-9蛋白均无跨膜结构,且MMP-2无信号肽。利用NetPhos 3.1 Server预测MMP-2和MMP-9蛋白序列磷酸化位点,结果显示MMP-2基因编码氨基酸中共发现8个Ser磷酸化位点、7个Thr磷酸化位点、8个Tyr磷酸化位点;MMP-9基因编码氨基酸包含6个Ser磷酸化位点、7个Thr磷酸化位点、3个Tyr磷酸化位点。利用NetNGlyc 1.0预测其O、N糖基化位点,结果表明,MMP-2蛋白包含5个O-糖基化位点(Thr279、Thr286、Thr289、Thr291、Thr386),MMP-9蛋白存在4个O-糖基化位点(Thr27、Thr37、Thr90、Thr273)。此外,MMP-2蛋白未检测到N-糖基化位点,MMP-9则检测到3个N-糖基化位点(Asn38、Asn120和Asn127)。
2.4 牦牛MMP-2和MMP-9蛋白亚细胞定位及保守结构域预测
利用在线软件PSORT II Prediction分析牦牛MMP-2和MMP-9蛋白细胞亚定位,发现MMP-2蛋白主要分布于细胞质(65.2%)和细胞核(17.4%),在细胞骨架、液泡、高尔基体和囊泡中分布比例均为8.7%;MMP-9蛋白主要定位于细胞外基质(66.7%),其次为液泡(22.2%)和质膜(11.1%)。利用NCBI-CD Search预测牦牛MMP-2和MMP-9蛋白氨基酸序列保守结构域(见图3)。结果显示,牦牛MMP-2和MMP-9蛋白均含有纤连蛋白2型结构域(Fibronectin type 2 domain,FN2)和基质蛋白(Matrixin)。此外,MMP-9还有3个α螺旋组成的肽聚糖结合结构域,该结构域位于细菌细胞壁降解所涉及各种酶N或C末端,具有肽聚糖结合功能。
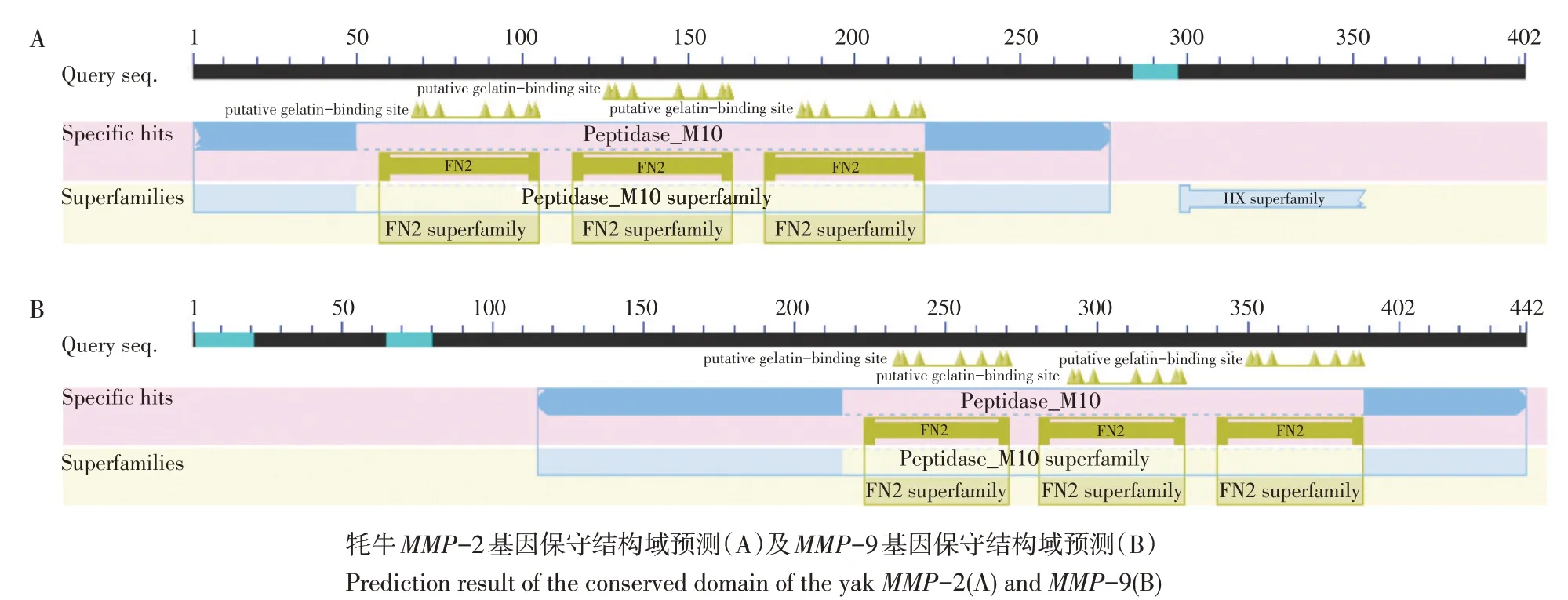
图3 MMP-2和MMP-9保守结构域预测Fig.3 Prediction of MMP-2 and MMP-9 conserved domain
2.5 牦牛MMP-2和MMP-9蛋白高级结构及其功能
牦牛MMP-2和MMP-9蛋白二级结构均含有α-螺旋(Hh)、β-折叠(Tt)、无规则卷曲(Cc)和延伸链(Ee),其中MMP-2和MMP-9无规则卷曲含量均最高。在二级结构基础上分析其三级结构,MMP-2与1gxd.2.A结构具有87.79%相似性,MMP-9与1l6j.1.A结构相似性为84.34%。两种蛋白三级结构预测结果与二级结构结果一致(见图4)。
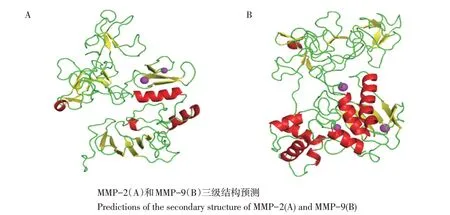
图4 牦牛MMP-2和MMP-9蛋白高级结构预测结果Fig.4 Prediction resultsof advanced structure of yak MMP-2 and MMP-9 proteins
利用Psipred-FFPred 3预测MMP-2和MMP-9蛋白质功能。结果显示,两种蛋白通过与金属离子Ca2+和Zn2+结合实现主要功能,且与Zn2+结合更紧密;无信号肽结构的MMP-2其内肽酶活性和转运调节比有信号肽的MMP-9更活跃,而MMP-9主要在细胞外区域发挥作用。STRING分析发现(见图5),MMP-2与基质金属蛋白酶抑制剂2(Metalloproteinase inhibitor 2,TIMP-2)蛋白相关性高达0.999,与MMP-14和Ⅰ型胶原蛋白(Collagenα-1,COL1A1)相关性分别高达0.955和0.991;MMP-9与TIMP-1和TIMP-2相关性分别高达0.995和0.992,且与胶原类MMPs(MMP-1、MMP-8)相关性均高达0.968。
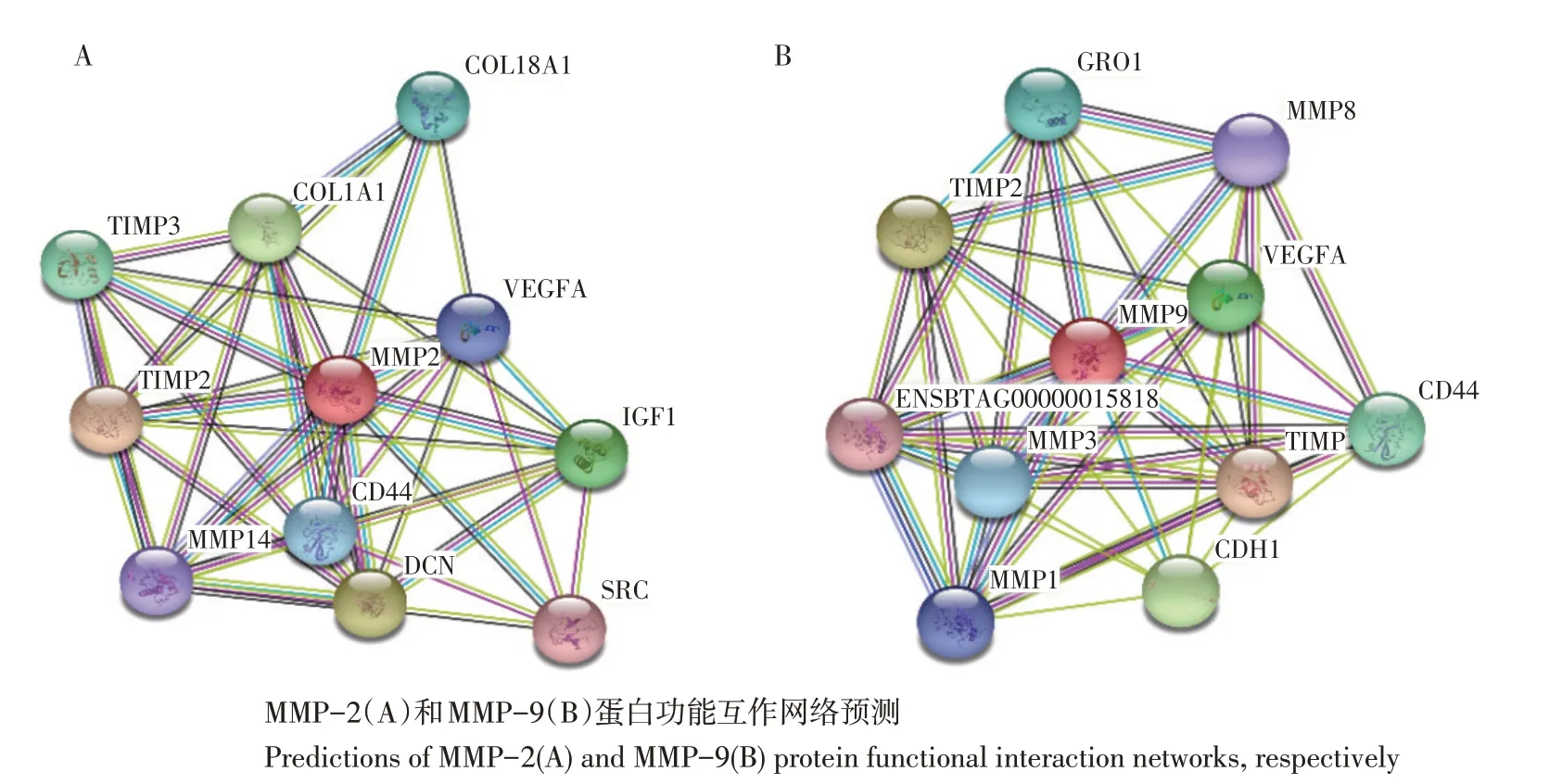
图5 MMP-2和MMP-9蛋白网络互作分析Fig.5 MMP-2 and MMP-9 protein network interaction analysis
2.6 牦牛MMP-2和MMP-9基因组织表达水平
通过实时荧光定量PCR检测MMP-2、MMP-9、MMP-14、TIMP-1、TIMP-2、CL1A1和CL3A1基因在0.5、1.5和2.5岁麦洼牦牛臀大肌和心脏中mRNA表达。结果见图6,MMP-2和MMP-9在不同年龄牦牛臀大肌组织中表达水平均随年龄增长而上升,MMP-2在0.5~2.5岁、1.5~2.5岁呈显著差异(P<0.05),MMP-9在0.5~1.5岁、0.5~2.5岁呈极显著差异(P<0.01)。MMP-14和CL3A1随其年龄增长表达量显著增加(P<0.05),然而CL1A1表达随年龄增长而下降,其中在0.5~1.5岁、1.5~2.5岁存在显著差异(P<0.05)。此外,TIMP-1和TIMP-2在牦牛不同年龄臀大肌组织中表达相对稳定,差异不显著。
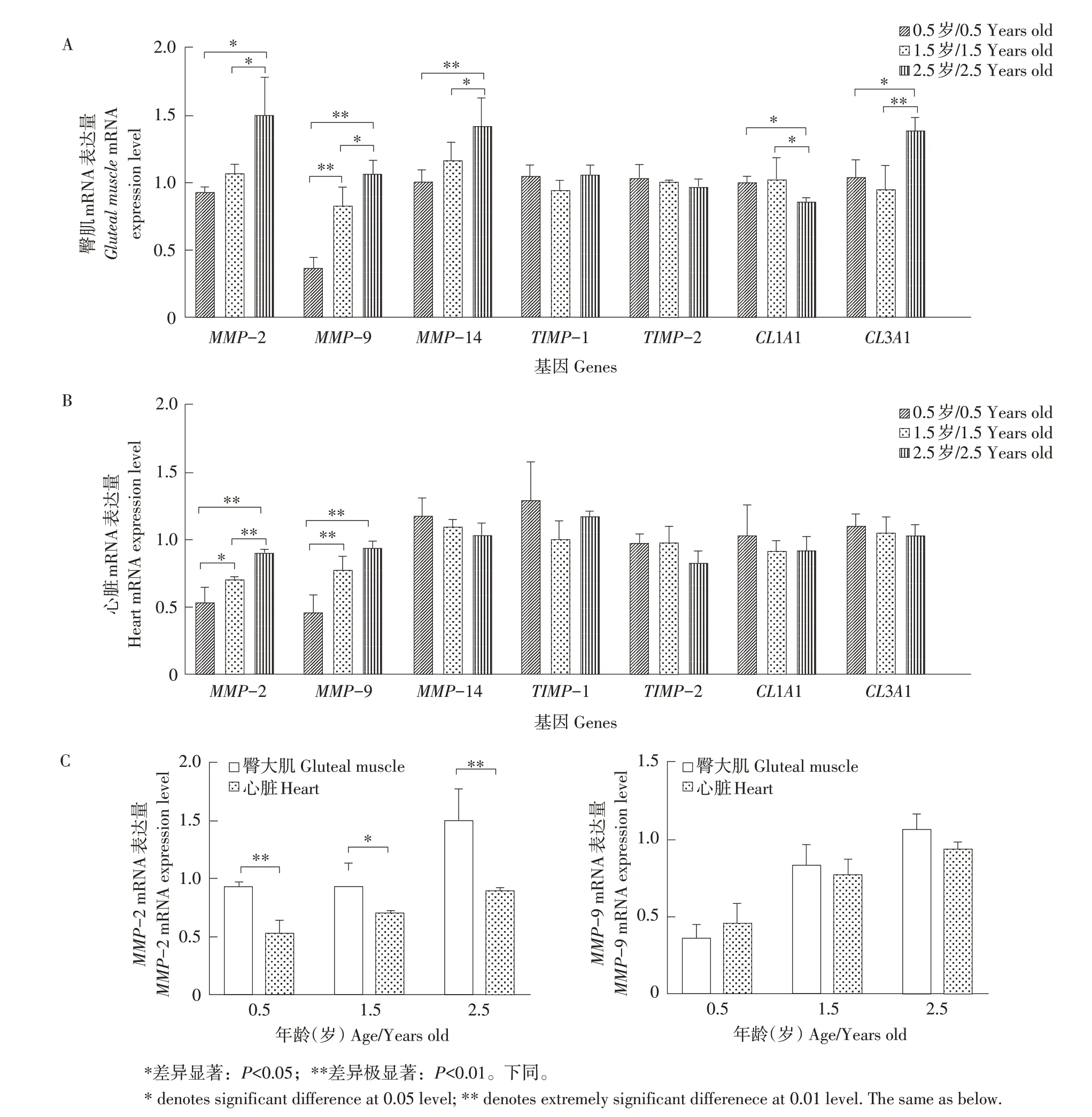
图6 牦牛MMP-2、MMP-9、MMP-14、TIMP-1、TIMP-2、CL1A1和CL3A1基因组织表达分析Fig.6 mRNA expression of yak MMP-2,MMP-9,MMP-14,TIMP-1,TIMP-2,CL1A1 and CL3A1 genes in different tissues
MMP-2和MMP-9在不同年龄牦牛心脏组织中mRNA表达随年龄增长而增加。其中MMP-2在0.5~1.5岁呈显著差异(P<0.05),0.5~2.5岁、1.5~2.5岁呈极显著差异(P<0.01)。MMP-9在0.5~1.5岁、0.5~2.5岁呈极显著差异(P<0.01)。然而,MMP-14、TIMP-1、TIMP-2、CL1A1和CL3A1在0.5、1.5、2.5岁牦牛心脏组织中表达量差异均不显著。
MMP-2在同一年龄臀大肌mRNA表达水平均高于心脏组织,分别在0.5岁和2.5岁呈极显著差异(P<0.01),1.5岁呈显著差异(P<0.05)。MMP-9在臀大肌和心脏中的mRNA表达差异不显著。
2.7 牦牛MMP-2和MMP-9蛋白在臀大肌中表达
采用免疫组化技术检测MMP-2和MMP-9蛋白在不同年龄牦牛臀大肌组织中表达情况(见图7),发现二者均呈随年龄增长呈增加趋势,其中MMP-2在0.5~1.5、0.5~2.5岁呈极显著差异(P<0.01),MMP-9在0.5~2.5、1.5~2.5岁呈极显著差异(P<0.01)。
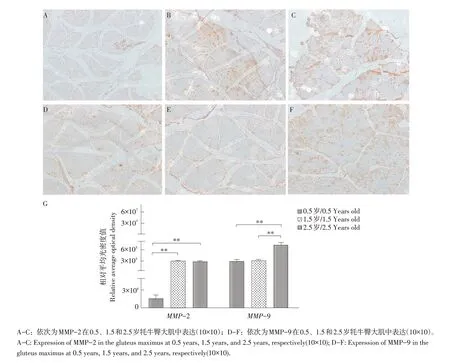
图7 不同年龄牦牛臀大肌中MMP-2和MMP-9蛋白表达分布Fig.7 Expression of MMP-2 and MMP-9 in gluteus maximus at different ages
3 讨论
MMP-2和MMP-9基因已被证明可在牛[6-7]、猪[12]、鸡[13]等畜禽肌肉生长发育调控中发挥重要作用。本研究发现牦牛MMP-2和MMP-9编码氨基酸中甘氨酸含量均最高,其次分别为天冬氨酸和亮氨酸。甘氨酸是保证肉质风味所必需前体氨基酸,含较多甘氨酸的肉质味道鲜美,营养丰富[14]。亮氨酸作为支链氨基酸一种,有助于促进人体训练后肌肉损伤修复,可通过下调雄性激素或减少肌蛋白分解的方式减轻肌肉劳损并防止骨骼肌损伤[15]。本研究结果表明,明胶类酶MMPs对牦牛肉质有影响。心脏收缩所需能量来源之一是通过TCA循环氧化脂肪酸天冬氨酸合成过程,从而生成大量ATP。作为赖氨酸等其他氨基酸合成前体之一的天冬氨酸,其合成可缓解因压力超负荷引起的心脏肥大,起改善心肌收缩功能、保护心肌作用[16],所以明胶类酶MMPs蛋白中天冬氨酸对心脏功能也有影响。MMPs主要通过对组织ECM中胶原蛋白降解调控肌肉生长发育,同时明胶类酶MMPs作为FN2结构域(可识别、捕获明胶)超家族分支之一,利用该结构域可增强肌肉调控等相关功能。MMP-2激活时形成pro-MMP-2/MMP-14/TIMP-2三联体,可促进明胶酶捕获ECM胶原,增强水解胶原能力[17]。这与本研究对牦牛明胶类酶MMPs蛋白互作预测分析结果相符。MMP-9与胶原类MMPs相关性均高达0.968,表明MMP-9对各类胶原蛋白有较强降解效果,而蛋白功能互作预测也为明胶类酶MMPs在肌肉组织ECM中对关键底物胶原蛋白水解提供理论依据。此外,MMP-2和MMP-9蛋白均含有多个磷酸化位点和糖基化位点,MMPs磷酸化与糖基化对酶活性调控有重要作用。Sariahmetoglu等使用碱性磷酸酶对MMP-2蛋白酶中Thr250、Tyr271、Ser32、Ser160和Ser365磷酸化位点进行去磷酸化反应,发现MMP-2酶活性由此提升,但MMP-9与MMP-2磷酸化产生效果存在差异[18]。Nam等研究发现人类胃上皮细胞被幽门螺旋杆菌感染后,细菌释放CagA毒力因子可激活细胞ERK磷酸化信号通路中的SHP-2酪氨酸磷酸酶,侵染后细胞MMP-9活性因酪氨酸磷酸化而增强[19]。Ru等发现CD147(心肌细胞上广泛表达的跨膜糖蛋白)糖基化,可诱导心脏中MMP-2和MMP-9分泌和活化,促进MMPs降解I型和III型胶原蛋白,缓解因胶原交联引起心肌肥大[20]。明胶类酶MMPs均为分泌蛋白[21],而本研究结果显示MMP-2无N-糖基化位点、无信号肽,MMP-2催化域的前肽区存在一个半胱氨酸开关基序[22],可通过磷酸化通路如ERK1/2进行激活和分泌[10],且pro-MMP-2可在细胞膜上与MMP-14和TIMP-2结合,形成pro-MMP-2/MMP-14/TIMP-2三联体,故经分析认为MMP-2通过此方式分泌细胞[17]。根据信号肽假说,牦牛MMP-2可能是一类非典型分泌蛋白[23],具体研究有待进一步验证。
牦牛MMP-2和MMP-9蛋白在细胞内、外均有分布。Yeghiazaryan等利用明胶酶谱法检测经运动训练后小鼠比目鱼肌中活性MMP-2和MMP-9分布情况[24],发现肌细胞核内MMP-2酶原和激活态以及细胞质中MMP-9激活态分布明显上升,说明明胶类酶MMPs可参与肌肉对训练的适应性反应,且在肌核功能调控作用中,MMP-2比MMP-9更显著。该研究还发现训练后小鼠比目鱼肌细胞ECM中充满激活的肌肉卫星细胞或成肌细胞,表明高表达的MMP-9可激活肌肉卫星细胞,参与骨骼肌修复。在小鼠心肌组织的平滑肌细胞和心肌细胞中均检测出MMP-2和MMP-9蛋白表达,且无论是在胞内亚细胞器(胞质溶胶、细胞核)或是胞外蛋白(如肌节),均能检测到MMP-2和MMP-9蛋白酶以及与心肌发育调控相关的作用底物如钙调节蛋白-1、心肌素、α-辅肌动蛋白和MHC[25]共表达。本研究对牦牛MMP-2和MMP-9细胞亚细胞器定位预测结果与前人研究结果相符,故也可为牦牛明胶类酶MMPs在细胞层面功能验证研究提供数据参考。
MMP-2和MMP-9基因在牦牛肌肉组织中mRNA表达随年龄增加而显著上升。麦洼牦牛主要分布在海拔3 700 m高原环境,而活性氧(ROS)随血液携氧量增加而增加[26],牦牛较南阳牛ROS含量低,牦牛和南阳牛MMP-2和MMP-9表达水平存在差异[27],这可能是本研究MMP-2基因表达与祁艳霞等[6]在不同年龄南阳牛肌肉组织中MMP-2表达结果相反的原因。牦牛性成熟年龄为3.5~4.5周岁,0.5~2.5岁牦牛属于幼年期,肌肉生长发育速度较快,各类细胞干性处于最佳时期。MMP-2和MMP-9在牦牛肌肉组织中的表达与年龄增长呈显著正相关,作为明胶类酶MMPs底物的Ⅰ型和Ⅲ型胶原蛋白,也是影响肉品质重要蛋白质[28],同时Ⅰ型胶原蛋白是骨骼肌中含量最高胶原[29]。两种蛋白是MMP-2和MMP-14的主要降解对象[30],所以幼年期牦牛臀大肌组织中CL1A1基因表达在0.5~2.5岁呈现显著性下降可能与MMP-2和MMP-14表达显著升高有关。此外,TIMP-1和TIMP-2在不同年龄麦洼牦牛肌肉组织中表达水平无显著差异,表明MMP-2和MMP-9在基因表达水平上可能存在对CL1A1有抑制作用。此外,臀大肌免疫组织化学结果与RT-qPCR结果趋势相似,表明明胶类酶MMPs的基因表达与组织分布有紧密关联,后续可增加对该酶蛋白表达水平验证试验。
随MMPs家族在肌肉组织及细胞中研究日益增多,已有报道证明明胶类酶MMPs对骨骼肌组织及肌细胞修复、增殖和分化等生物过程有直接影响,故MMPs对骨骼肌组织的调控作用尤为重要。目前未见牦牛不同生长阶段明胶类酶MMPs基因表达水平的报道,本研究得到的MMP-2和MMP-9在不同年龄骨骼肌组织中mRNA和蛋白表达存在显著差异,说明牦牛明胶类酶MMPs表达具有组织差异特点,也表明明胶类酶MMPs可作为潜在的牦牛骨骼肌生长发育靶点或者牦牛选育的分子标记。
4 结论
本研究首次测序获得牦牛MMP-2和MMP-9基因序列,且发现MMP-2和MMP-9在牦牛臀大肌和心脏中mRNA表达与年龄呈显著正相关,二者在臀大肌组织中基因和蛋白表达分布趋势相似。研究结果为进一步探索牦牛明胶类酶MMPs在牦牛肉品质与肌肉生长方面调控作用提供参考。

