番茄BZR基因家族鉴定及非生物胁迫下表达模式分析
陈 旭,沈春洋,莫福磊,吕 瑞,李鑫茂,豆志滔,王傲雪*
(1.东北农业大学园艺园林学院,哈尔滨 150030;2.东北农业大学生命科学学院,哈尔滨 150030)
番茄是世界主要经济作物之一,原产自南美洲且在我国广泛种植。近年来,低温、干旱、极端高温等非生物胁迫是制约番茄产量的重要因素,通过分子手段发掘番茄抗逆优质基因是解决这一难题的可行办法[1]。油菜素内酯(Brassinosteroid,BR)是新型植物内源激素,且是第一个被分离出具有活性的油菜素甾族化合物,可将植物体内存在的抗逆潜能充分激发,使其通过内部调节减缓植物遭遇各种不利外界环境时受到的伤害[2-3]。BZR(Brassinazole resistant)是一个转录因子家族,作用于BR信号通路下游,主要通过调控一些响应BR的相关基因表达调节植物生长发育并参与植物逆境应答反应[4]。Yin等在拟南芥中首次发现并鉴定得到BZR基因家族[5]。有报道称BZR1蛋白在其N末端存在一个非典型螺旋-环-螺旋(Basic helix-loop-helix,bHLH)DNA结合基序(即BZR结构域),可结合E-box结构(CANNTG)或BRRE元件,诱导或者抑制靶基因表达[6-7]。研究发现,BES1(BRI1-EMS-suppressor 1)也是一种转录因子,且和BZR1被划分为同一个家族;二者DNA结合结构域相似性较高,因此BES1在植物BR信号通路中也同样发挥关键作用,该基因主要调控植物生长发育及一系列胁迫反应[8]。
拟南芥中响应干旱胁迫的转录因子RD26是BES1蛋白靶基因。当RD26过表达时抑制BR信号调节生长,在拟南芥中,转录因子RD26与BES1存在相互作用,RD26过表达时抑制BES1在BR调节中的活性,负调控植物响应干旱胁迫[9]。Saha等在白菜中发现15个BZR基因,对白菜冷处理后发现,BrBEH4在冷敏感白菜品种和耐冷白菜品种中表达模式不同,且证实BrBZR可能是调节CBF冷应答途径的一种转录激活因子,提高白菜耐冷性[10]。高温胁迫主要损害植物叶绿体和线粒体功能,导致体内活性氧(ROS)过度积累,造成氧化损伤。Yin等在番茄中发现BZR1-like蛋白调控BR反应,并通过调节FERONIA(FER)同系物提高番茄耐热性[5]。CRISPR-bzr1突变体植株显示生长减慢,且对EBR不敏感。BZR1突变损害RBOSH1诱导、抑制质外体中H2O2产生和耐热性减弱。而BZR1过表达则增强质外体H2O2产生和高温应答能力,得出BZR1是番茄耐高温关键基因[11]。
目前,在番茄中对于BZR转录因子家族研究相对较少。本研究利用生物信息学手段,综合分析BZR基因家族生物学特征和表达模式,并利用实时荧光定量PCR技术分析番茄BZR基因在不同胁迫条件下表达情况,为BZR基因对番茄逆境胁迫响应研究提供理论参考。
1 材料与方法
1.1 植物材料与处理
本试验选用番茄材料为AC(Ailsa Craig);选取颗粒饱满种子,播种于基质土:蛭石为3∶1栽培基质中,常规栽培管理,光周期为16 h/8 h。当番茄生长至四叶一心时,作低温胁迫、干旱胁迫、高温胁迫及盐胁迫。低温胁迫处理条件为:4°C处理0、1、6、12和24 h;干旱胁迫处理条件为:浓度为10%聚乙二醇(Polyethylene glyco,PEG)处理0、1、6、12和24 h;高温胁迫处理条件为:42℃处理0、1、6、12和24 h;盐胁迫为200 mmol.L-1NaCl溶液浸泡幼苗根部0、1、6、12和24 h。
每个处理设置3个生物学重复,取每株番茄幼苗嫩叶,置于离心管中,然后迅速放置在液氮中速冻,保存于-80℃冰箱中备用。
1.2 番茄BZR基因家族成员鉴定
在茄科数据库网站SGN(Sol Genomics Network,https://solgenomics.net/)下载番茄基因组文件(SL4.0)和基因组注释、总蛋白序列文件(ITAG4.0)。在Pfam数据库(https://pfam.xfam.org/)下载BZR保守结构域(PF05687)隐马尔可夫模型(Hidden markov model,HMM)文件。使用HMMER 3.0软件hmmsearch功能,在番茄总蛋白序列中搜索与BZR结构域相似蛋白,且设置E值为1×10-5过滤搜索结果,得到候选番茄BZR基因家族成员。将候选成员蛋白质序列提交到SMART(http://smart.embl.de/)、Pfam和CDD(Conserved Domains Database,https://www.ncbi.nlm.nih.gov/cdd)3个数据库,确认其是否含有BZR结构域,确定番茄BZR基因家族成员。
1.3 番茄BZR基因家族成员序列分析
利用ExPasy(https://www.expasy.org)在线网站预测SlBZR基因编码氨基酸长度、等电点和相对分子质量。使用MEGA7.0中MUSCLE比对番茄BZR蛋白序列,获得番茄BZR蛋白间进化关系。使用MEME-v4.12.0鉴定番茄BZR蛋白序列中保守基序(Motif),最大保守结构域数量设置为10,最小motif宽度为6,最大motif宽度为20。然后利用TBtools分析并可视化进化树、保守基序信息。为鉴定BZR基因相关顺式作用元件,提取BZR基因转录起始位点上游1 500 bp碱基基因组序列,提交到PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站预测顺式作用元件。
1.4 系统发育分析与染色体定位
在Ensembl Plants数据库下载拟南芥(Arabidopsis thaliana)、马铃薯(Solanum tuberosum)与葡萄(Vitisvinifera)蛋白序列文件,利用1.2中方法鉴定拟南芥、马铃薯与葡萄中BZR基因家族成员,将鉴定得到物种BZR蛋白序列与番茄BZR蛋白序列使用MEGA7.0中MUSCLE比对,利用邻接法(Neighbor joining,NJ)构建系统发育树,bootstrapping值设置为1 000,其余参数为默认值,最后使用iTOL(https://itol.embl.de)网站美化进化树。
1.5 基于转录组数据表达分析
在GEO(Gene Expression Omnibus,https://www.ncbi.nlm.nih.gov/geo/)数据库下载番茄在干旱和高温胁迫下转录组数据,用于提取SlBZR基因家族成员在两种逆境处理下表达量,使用TBtools绘制基因表达热图。
1.6 RNA提取与qRT-PCR验证
采用Trizol法提取RNA,使用反转录试剂盒(东洋纺)将RNA反转录为cDNA。使用荧光染料SYBR(东洋纺)作qRT-PCR试验,反应体系参考文献[12]方法,反应程序参照试剂说明书,每个样品3次生物学重复和3次技术重复。相对表达量计算方法采用2-ΔΔCt法,使用Graphpad作可视化绘图,引物序列如表1所示。
2 结果与分析
2.1 番茄全基因组中BZR基因鉴定
使用HMMER软件在番茄全基因组范围内共鉴定得到9个候选SlBZR基因家族成员,提取9个候选番茄BZR基因家族成员蛋白序列提交到SMART、Pfam和CDD数据库鉴定其保守结构域,发现9个候选SlBZR基因家族成员均具有BES_N蛋白结构域。如表2所示,根据9个基因在染色体上先后顺序,将这9个基因分别命名为SlBZR1~SlBZR9;编码氨基酸长度在180(SlBZR8)~695(SlBZR1)个氨基酸之间;编码蛋白质相对分子质量最小为20.39 ku(SlBZR8),最大为77.86 ku(SlBZR1);等电点介于5.33(SlBZR1)~9.73(SlBZR2)之间。

表2 番茄BZR基因家族成员基本信息Table 2 Base information of BZR gene family in tomato
2.2 番茄BZR基因家族成员序列信息
为探究番茄SlBZR基因家族成员序列信息,使用MEME和TBtools软件分析9个SlBZR基因家族成员进化关系及保守基序,结果如图1所示。9个Sl-BZR基因在保守基序方面一致性较高,Motif1在所有SlBZRs蛋白上均出现。结合进化关系聚类发现,SlBZR2、SlBZR3、SlBZR4、SlBZR5、SlBZR6和SlBZR9均含有Motif3、Motif5、Motif7和Motif10,而SlBZR1和SlBZR7特有保守基序为Motif2和Motif6。SlBZR8仅含有Motif1,因此被单独划分为一个进化分支。
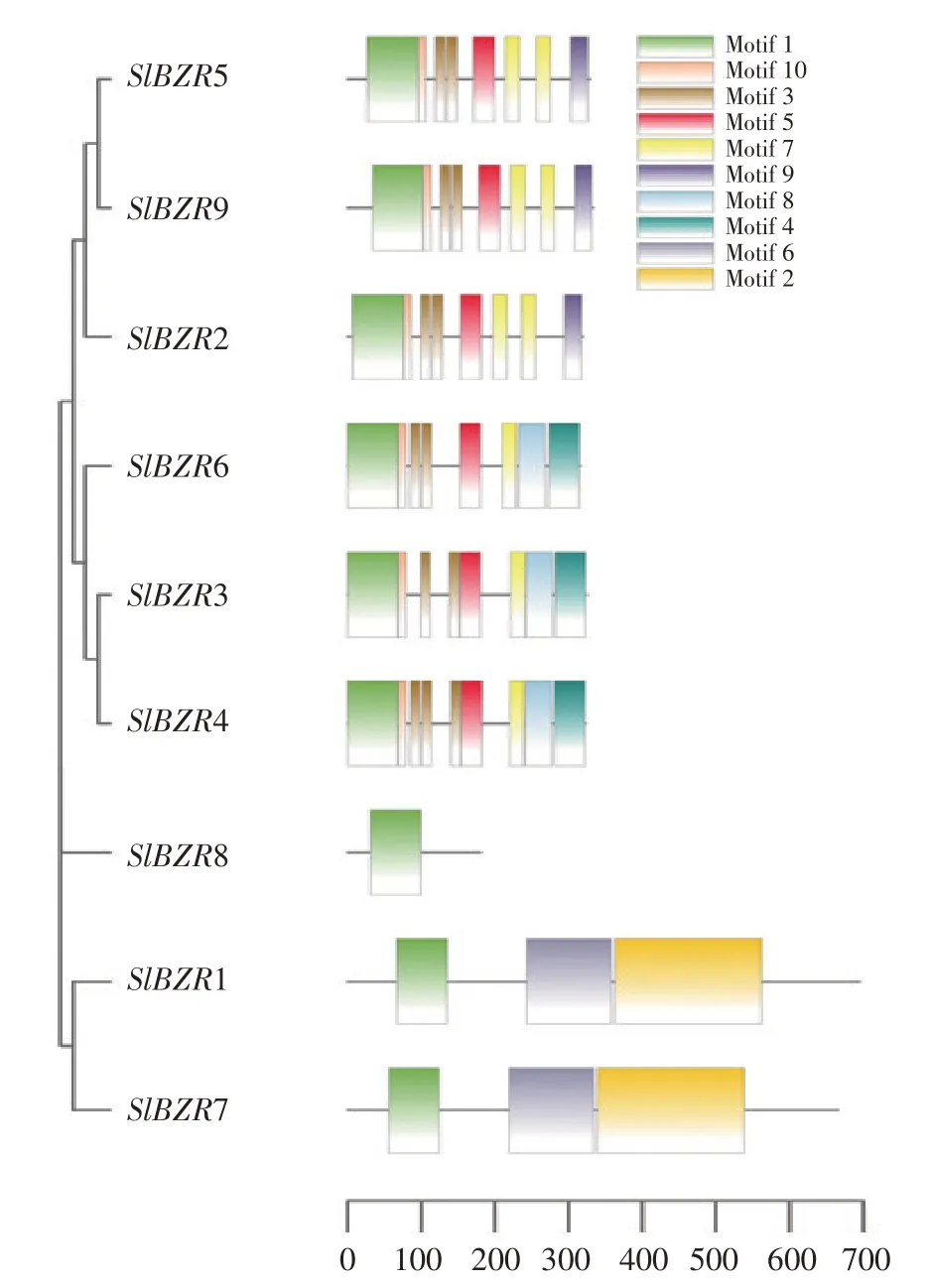
图1 SlBZR基因家族成员进化关系及保守基序Fig.1 Evolutionary relationships and conserved motifs of SlBZR genes
2.3 番茄BZR基因染色体定位分布
在番茄全基因组范围内共鉴定得到9个SlBZR基因,以上9个基因分布于番茄12条染色体中8条染色体上,根据其在基因组注释文件中信息,使用TBtools可视化SlBZR在染色体上的位置,以展示SlBZR基因分布及基因间距离。如图2所示,除2号染色体上分布有两个SlBZRs基因外,1、3、4、7、8、10、12号染色体均仅有1个SlBZR基因。同时,SlBZR2和SlBZR3位于2号染色体中间部分,即着丝粒附近,而其他所有SlBZRs基因均分布在染色体两端远离着丝粒区域。

图2 番茄BZR基因染色体定位Fig.2 Chromosomemapping of BZR genesin tomato
2.4 番茄BZR基因系统发育分析
为研究番茄BZR基因进化关系,按照本研究材料与方法1.2中鉴定方法,分别在拟南芥、马铃薯与葡萄中鉴定BZR基因家族成员,并绘制番茄、拟南芥、马铃薯与葡萄4个物种BZR家族成员系统发育树。结果如图3所示,4个物种BZR基因成员系统发育树共分为I~V个亚家族,4个物种中与番茄BZR基因家族成员进化关系最近的BZR基因均为马铃薯中BZR成员,而拟南芥和葡萄中BZR成员,与番茄BZR成员在进化上关系较远;如IV亚家族,仅有两个葡萄中BZR成员。
2.5 番茄BZR基因顺式作用元件预测
为预测SlBZR基因生物学功能,使用Plant-CARE数据库对SlBZR基因起始密码子上游1 500 bp启动子区域作顺式作用元件分析(见图4)。结果表明,SlBZR相关基因启动子区存在丰富的顺式作用元件,可能对其生物学功能影响较大。在所预测31个顺式作用元件中,SlBZR基因启动子上均含有较多CAAT-box(启动子和增强子区域中常见顺式作用元件)、TATA-box(转录起始的核心启动子元件)。SlBZR5含有较多AT~TATA-box元件、SlBZR3含有较多Box元件、SlBZR4含有较多ABRE元件(参与脱落酸响应的顺式作用元件)、SlBZR1含有较多MYC元件且SlBZR6含有较多ERE元件(乙烯响应元件)。部分顺式作用元件尽管含量较少但仍具有重要生物学功能,如ARE(厌氧诱导元件)等。
2.6 基于转录组数据番茄BZR基因表达模式分析
为探究番茄SlBZR基因在非生物胁迫下表达情况,本研究在GEO数据库下载通过干旱与高温胁迫处理番茄叶片转录组数据。转录组(FPKM)数据包括干旱处理、高温处理和对照,如图5所示,图5a为干旱处理(D,drought),每组数据为不同处理天数(d,day);图5b为高温处理(H,heat),每组数据为不同处理小时数(h,hour)。有8个SlBZR基因在不同条件下均表达,而SlBZR8基因在高温胁迫下不表达。SlBZR3、SlBZR6和SlBZR9在干旱处理后与对照相比,随处理时间增加,表达量呈先升后降趋势,且表达量最高时均在干旱处理3 d时,SlBZR1和SlBZR8在干旱处理4 d时上调表达最明显。SlBZR2和SlBZR5经干旱处理后表达量均比对照组低。同时在高温胁迫下发现,处理后表达量比对照低,如SlBZR2、SlBZR5和SlBZR9。而SlBZR3、SlBZR4、SlBZR6和SlBZR7在高温胁迫下与对照相比,随胁迫时间增加,表达量呈先升再降又升趋势。由此表明,SlBZR基因不同表达方式也间接揭示SlBZR基因家族在番茄响应逆境胁迫中的功能多样性。
2.7 番茄BZR基因家族成员在非生物胁迫下表达模式分析
为验证RNA-Seq数据准确性,研究番茄中Sl-BZR基因家族对非生物胁迫反应,本研究选择4个SlBZR家族成员,分别为SlBZR3、SlBZR6、Sl-BZR8和SlBZR9。
如图6所示,在冷胁迫下,随时间推移,与对照相比SlBZR6和SlBZR8表达量呈现上调表达(Sl-BZR6在冷胁迫12 h后其相对表达量骤降,但整体仍上调表达);SlBZR3和SlBZR9则表现为先降再升趋势。冷胁迫下,与对照相比,SlBZR6上调表达最明显,其相对表达量约为对照组(冷处理0 h)6倍。盐胁迫时,SlBZR3、SlBZR6和SlBZR9均在处理12 h时呈相对表达量峰值,而SlBZR8则出现在6 h时(约为对照组5.7倍),且SlBZR6无明显上调趋势。干旱胁迫前12h,SlBZR6、SlBZR8和SlBZR9相对表达量呈逐步升高趋势,且4个基因均在处理12 h后达最高相对表达量,且24 h后相对表达量略低于12 h。高温胁迫下,SlBZR3在12 h前相对表达量随时间呈阶梯上调,其余基因在高温胁迫下无明显上调或下调趋势,且SlBZR3和SlBZR8在高温胁迫24 h时相对表达量显著低于对照,其他两个基因则略低于对照,与转录组数据结果一致。

图6 4个番茄BZR基因不同胁迫处理下相对表达量Fig.6 Relativeexpression of four tomato BZR genesunder different stresstreatments
3 讨论
作为植物转录因子家族之一,BZR家族基因通过在转录水平调控下游各类靶基因,参与植物多种生理过程和生长发育[13]。目前,已在多种植物中发现BZR基因家族,如拟南芥[9],大豆[14],小麦[15]和水稻[16]等。植物中存在的BZR蛋白功能复杂,如调控响应BR的基因表达调节植株生长发育和使植株抗逆性增强等[4]。然而在番茄中,关于BZR基因家族研究较少。
本研究共鉴定出9个SlBZR基因家族成员,且获得其序列特征和结构、保守基序、染色体位置和启动子区顺式作用元件等信息;此外基于转录组数据,获得9个基因在干旱和高温下表达模式,已通过qRT-PCR验证其结果。如表2所示,SlBZR基因家族成员平均分子质量为42.5 ku,平均pI为8.11。前人研究得出BZR蛋白结构包含N端核定位信号序列、高度保守DNA结合结构域、磷酸化区域、PEST序列及C端结构域,这可能是导致Sl-BZR基因家族平均等电点大于7的原因[5]。BZR1和BES1(和BZR1同属一类的转录因子)可调节下游BR响应基因表达,且二者均既发挥转录激活子功能又发挥转录抑制子功能[4]。其DNA结合域通常包含一个bHLH(螺旋-环-螺旋)结构,BZR1 DNA结合域是BZR1相关蛋白中最保守区域,由第一外显子编码,可与BRRE元件特异结合,从而实现对靶基因诱导或抑制[7,10]。如图1所示,该基因家族成员含保守基序,有较高一致性,进化分支划分也较清晰。同时本研究也发现SlBZR基因并不属于内含子富集型基因家族,因此推断在SlBZR基因家族不断多样化过程中可能导致内含子丢失情况发生[17]。图4显示所鉴定9个SlBZR基因启动子上游顺势作用元件功能分析,发现其均含有丰富顺式作用元件,如CAAT-box、TATA-box、ABRE、MYC和ERE等。顺式作用元件按照功能大体分为三大类:生长发育相关顺式作用元件(如G-box)[18]、激素反应相关顺式作用元件(如ABRE)[19]和应激反应相关顺式作用元件(如LTR)[20]。在SlBZR基因家族中均检测到该元件存在,表明SlBZR基因家族在抗逆中发挥功能原因之一可能是家族顺式作用元件的丰富性。本研究揭示SlBZR基因对低温胁迫、干旱胁迫、高温胁迫和盐胁迫响应。如图6所示,SlBZR对4种处理均有响应,但不同SlBZR成员表达水平存在差异。另有小麦研究表明,将过表达的TaBZR2转入小麦(Triticum aestivumL.)可提高其植株抗旱性[15]。如图5所示,SlBZR基因在干旱组和高温组表达模式相近,但也有个别基因呈现较大差异。SlBZR8在高温组未表达,而在干旱处理4 d时呈显著上调趋势,5 d后其表达量又下降。随后将这9个SlBZR基因作qRT-PCR试验,结果表明大部分基因表达与转录数据分析结果一致。Chen和Li等发现在拟南芥中,转录因子CBF、WRKY6及脱落酸受体PYL6编码抗寒基因表达,而BZR1对此调控过程起促进作用[21-22]。另外本研究发现,SlBZR3在高温和盐胁迫下表达量显著上调;Sl-BZR8在冷处理下表达量显著上调(特别是24 h后上调近4倍)。而SlBZR8在盐处理前期尤其是6 h后表达量上调明显,可能在盐胁迫早期反应中发挥作用。在拟南芥中,bes1-D突变体与野生型植株相比在盐胁迫条件下叶片萎蔫程度比野生型植株叶片更小[23],本研究在番茄中同样验证BZR基因响应盐胁迫。
综上所述,本研究首次在番茄中鉴定BZR基因家族成员,通过生物信息学分析及非生物胁迫下qRT-PCR分析,揭示番茄BZR基因家族成员,在番茄生长发育、逆境胁迫与激素响应方面可能发挥重要作用,为研究SlBZR基因在番茄响应逆境胁迫过程提供思路,也为进一步研究SlBZR基因家族在番茄育种和抗性改良中作用提供基础。

