L-肉碱对NEFA致肝细胞氧化应激损伤的保护作用
刘志鹏,于志勇,迟 良,胡学远,刘焕奇
(青岛农业大学动物医学院,山东 青岛 266109)
奶牛酮病主要是由于机体能量供给和支出出现负平衡(Negative energy balance,NEB),导致糖脂代谢紊乱引发的营养代谢性疾病之一[1-2]。调查研究显示,全球亚临床酮症患病率为24%[3],我国酮病发病率约为15%~30%,且呈现逐年升高趋势[4],不仅威胁奶牛健康,也制约奶牛业发展。奶牛通常在产犊后5~6周进入泌乳高峰期,但其采食高峰期和食欲恢复一般在产犊后8~9周,特别是高产奶牛泌乳初期,能量代谢往往处于负平衡,极易造成能量代谢机能障碍[5-6]。此时,泌乳所需能量、脂肪和蛋白质需求增加,而干物质摄入量低于产奶所需能量,为满足产奶需要,奶牛会动员体脂供能。大量体脂动员,使脂肪被水解为甘油和非酯化脂肪酸(Non-esterified fatty acid,NEFA)并释放入血液,转运到其他组织被氧化利用,当血液中NEFA超出细胞需求量时,过剩的NEFA会转运到肝脏进一步代谢。NEFA在肝脏被酯化成丙酮,导致奶牛发生高酮血症,血液中酮体过度累积会引起奶牛食欲不振,进一步加重奶牛NEB状态[7]。同时,肝细胞中过量NEFA无法被及时氧化利用,产生大量氧自由基及活性氧(Reactive oxygen species,ROS),造成肝脏氧化应激损伤,加重酮病病情。
L-肉碱参与脂肪酸氧化及促进脂质代谢氧化。在脂肪代谢过程中,L-肉碱作为载体与酯酰CoA结合成酯酰肉碱,将长链脂肪酸从细胞质转运至线粒体基质,最终释放出酯酰CoA参与β氧化为细胞提供能量[8]。肉碱具有抗氧化特性,可在某些代谢紊乱中保护细胞免受有毒活性氧侵害[9]。肉碱可清除氧自由基,抑制亚油酸脂质过氧化[10]。L-肉碱可提高谷胱甘肽过氧化物酶(Glutathione-peroxidase,GSH-Px)、过氧化氢酶(Catalase,CAT)和超氧化物歧化酶(Superoxide dismutase,SOD)等抗氧化酶活性,减轻因年龄增长而发生的过氧化损伤[11];补充肉碱可恢复肝细胞肉碱脂酰转移酶-Ⅰ(Carnitine palmityl transferase-Ⅰ,CPT-Ⅰ)酶活性,恢复线粒体膜电位水平,减轻线粒体损伤,减少细胞凋亡[12]。L-肉碱作为一种抗氧化剂,可显著提高机体抗氧化能力,减少氧化损伤,增强机体免疫力和抗病能力,但其可否对NEFA导致的肝脏氧化应激损伤有保护作用鲜有报道。因此,本试验通过建立NEFA诱导小鼠肝细胞AML12氧化应激损伤模型,探讨L-肉碱对NEFA致AML12细胞氧化应激损伤的保护效果,旨在为酮病治疗提供一种新思路。
1 材料与方法
1.1 主要试剂
DME/F12培养基、胎牛血清(FBS)购于美国Hy-Clone公司;油酸、亚油酸、棕搁酸、棕榈油酸、硬脂酸均购自美国Sigma公司;52.6 mmol.L-1NEFA贮存液[配方:油酸1.375 mL(4.35 mmol.L-1)、亚油酸0.152 mL(0.49 mmol.L-1)、棕榈酸0.818 g、棕榈油酸0.151 mL(0.53 mmol.L-1)和硬脂酸0.410 g混于113 mL 0.1 mol.L-1KOH,60℃混匀至全部溶解;再加入7.5 mL预热HCl溶液和67.8 mL双蒸水混匀;用0.22μm滤器滤过除菌后于-20℃保存;20 mmol.L-1L-肉碱贮存液(配方:L-肉碱原粉购于美国Sigma公司,无菌称取80.6 mg L-肉碱粉末加入加入25 mLDME/F12,滤过除菌后于-4℃保存);丙二醛(MDA)检测盒、过氧化氢酶(CAT)检测盒、谷胱甘肽过氧化物酶(GSH-Px)检测盒、总超氧化物歧化酶(T-SOD)检测盒、活性氧(ROS)检测试剂盒均购于南京建成生物工程有限公司;CCK-8细胞增殖及细胞毒性检测试剂盒、线粒体绿色荧光探针检测试剂盒(Mito-Tracker Green)、线粒体膜电位检测试剂盒(JC-1)均购于江苏碧云天生物有限公司;其他化学试剂为均来自国产分析纯。
1.2 细胞株与细胞培养
AML12小鼠正常肝细胞系购置于美国模式培养物集存库(ATCC),STR鉴定正确。细胞复苏后于含10%胎牛血清、1%青链霉素的DME/F12完全培养基,5%CO2,37℃恒温培养箱中培养。
1.3 试验方法
1.3.1 细胞增殖与细胞毒性检测
生长于对数期AML12细胞消化重悬后,接种于96孔板,每孔加入0.7×105个细胞和200μL完全培养液,置于培养箱中培养至占孔底80%~90%。测定细胞毒性时,每孔分别加入含终浓度为0、0.6、1.2和1.8 mmol.L-1NEFA完全培养液,于37℃孵育24 h;测定细胞增殖时,L-肉碱处理组加入终浓度为1.8 mmol.L-1(跟据预试验筛选最适浓度)L-肉碱与适当浓度NEFA溶液于37℃共孵育24 h。之后,每孔加入10μL CCK-8溶液,继续37℃培养2 h,于450 nm处测定各孔吸光值。每孔设置5个重复,确保试验数据准确性。
1.3.2 氧化应激相关指标测定
MDA含量、T-SOD活性、CAT活性与GSH-Px活性测定:将生长于对数期AML12细胞,消化重悬后按每孔加入5×105个细胞接种于6孔板中,待细胞生长至50%~60%时,加入不同药物处理,分为NEFA组(含终浓度为1.2 mmol.L-1NEFA,细胞毒性试验得出最佳浓度)、L-肉碱组(含终浓度为1.8 mmol.L-1L-肉碱)和L-肉碱干预组(1.8 mmol.L-1L-肉碱+1.2 mmol.L-1NEFA),对照组加同等体积细胞培养液,待细胞生长至80%~90%时收集各组细胞,制备细胞匀浆。于1 000 r.min-1离心10 min,弃置上清收集沉淀。向沉淀中加入1 mL PBS,充分混匀清洗细胞,反复2次。离心完成后,用0.5 mL PBS重悬细胞,于超声细胞破碎仪中,充分破碎细胞。随后根据MDA检测盒及CAT、GSH-Px和T-SOD活性检测试剂盒反应体系和步骤作检测;ROS含量检测:根据ROS检测试剂盒,待6孔板中细胞经L-肉碱和/或NEFA处理后,生长至80%~90%时,每孔加入10μmo.L-1DCFH-DA荧光探针,与培养液混匀再培养60 min。之后消化细胞,重悬并用PBS洗涤2次,于1 000 r.min-1离心5 min,收集细胞沉淀并用1×PBS重悬细胞,加入新的6孔板中,避光转移至荧光显微镜下,观察细胞荧光。
1.3.3 线粒体分布检测
6孔板中细胞经L-肉碱和/或NEFA处理后,取对数期AML-12细胞,吸除6孔板中全部培养液,改换为预先37℃温浴的Mito-Tracker Green工作液,轻缓摇动使之分散均匀,置于37℃培养箱中孵育30 min。孵育完成后换为每孔2 mL完全培养液,避光移至荧光显微镜下观察。激发光波长为490 nm,发射波长为516 nm。
1.3.4 线粒体膜电位测定
根据线粒体膜电位检测试剂盒,6孔板中细胞生长至80%~90%时,使用PBS洗涤1次。然后每孔加1 mL培养液与1 mL JC-1工作液,充分混匀后置于37℃培养箱孵育20 min。孵育结束后,吸除所有培养液,每孔加入2 mL预冷的JC-1染色缓冲液,轻摇洗涤细胞2次,每次3 min。清洗完成后去除JC-1染色缓冲液,每孔加入2 mL完全培养液,避光转移至荧光显微镜下,30 min内完成观察。检测JC-1单体时,激发波长设置为490 nm,发射波长设置为530 nm;检测JC-1聚合物时,激发波长设置为525 nm,发射波长设置为590 nm。
1.4 数据处理
使用GraphPad Prism7.04软件作差异性分析和作图,使用Image J软件对细胞荧光图片作定量分析,统计方法采用单因素方差分析,配合Tukey事后检验。当分析结果P<0.05时,表明试验结果差异极显著。
2 结果与分析
2.1 L-肉碱对NEFA致AML12细胞毒性的影响
细胞毒性检测结果(见图1)显示,AML12细胞存活率随NEFA浓度增加而降低,NEFA浓度在1.2 mmol.L-1(P<0.01)、1.8 mmol.L-1(P<0.01)时与对照组(0 mmol.L-1)相比均极显著下降,表明高浓度NEFA具有明显细胞毒性。因此,后续试验选取1.2 mmo.L-1NEFA作为体外刺激浓度进行试验。细胞增殖检测结果发现L-肉碱单独处理对细胞活性无显著影响,而当L-肉碱与NEFA共孵育时,细胞存活率较仅加入1.2 mmol.L-1NEFA组极显著上升(P<0.01),表明L-肉碱对NEFA造成的细胞毒性具有保护效果。

图1 L-肉碱对NEFA致细胞毒性的影响Fig.1 Effect of L-carnitineon NEFA induced cytotoxicity
2.2 L-肉碱对NEFA致AML12细胞氧化应激的影响
氧化应激相关指标检测结果显示,与对照组相比,NEFA处理后,细胞MDA含量极显著升高(见图2A,P<0.01),T-SOD活性极显著降低(见图2B,P<0.01),表明NEFA引起细胞氧化应激损伤。检测结果还发现,L-肉碱对细胞MDA,TSOD水平无显著影响,而在NEFA中加入L-肉碱共孵育组中,细胞MDA含量较单独NEFA处理组极显著降低(P<0.01),T-SOD活性则呈现与MDA相反趋势(P<0.01),表明L-肉碱对NEFA诱导的细胞氧化应激损伤有保护效果。
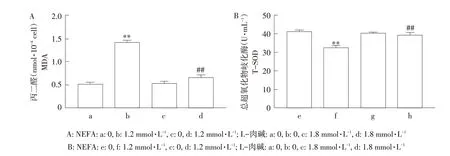
图2 L-肉碱对NEFA诱导AML12细胞MDA和T-SOD变化的影响Fig.2 Effect of L-carnitine on NEFA-induced MDA level and T-SOD vitality in AML 12 cells
抗氧化酶CAT和GSH-Px活性检测结果显示,与对照组相比,NEFA极显著降低肝细胞CAT(见图3A,P<0.01)和GSH-Px(见图3B,P<0.01)活性,进一步表明NEFA引起细胞氧化应激损伤。L-肉碱对细胞CAT和GSH-Px水平无显著影响,而在NEFA中加入L-肉碱共孵育组中,细胞CAT(P<0.01)和GSH-Px(P<0.01)活性极显著增加,表明L-肉碱对NEFA诱导的细胞氧化应激损伤有保护效果。

图3 L-肉碱对NEFA诱导AML12细胞CAT和GSH-Px变化的影响Fig.3 Effect of L-carnitine on NEFA-induced CAT level and GSH-Px vitality in AML 12 cells
为进一步证实L-肉碱对NEFA诱导AML12细胞氧化应激损伤的保护作用,本试验检测ROS含量。
如图4所示,与对照组(见图4A)相比,NEFA组(见图4B)细胞荧光强度显著增加,而L-肉碱组(见图4C)细胞荧光强度不变;L-肉碱+NEFA共孵育组(见图4D)荧光强度较NEFA单独处理组荧光强度明显降低。相对定量分析发现,L-肉碱+NEFA(见图5)共孵育组极显著降低NEFA引起ROS上调(P<0.01),提示NEFA通过诱导ROS产生,导致细胞产生氧化应激损伤;添加L-肉碱可减少NEFA诱导的ROS增加。
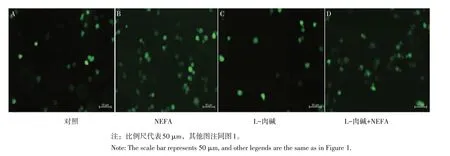
图4 L-肉碱对NEFA诱导AML12细胞ROS变化的影响Fig.4 Effect of L-carnitineon NEFA-induced ROSlevels in AML 12 cells
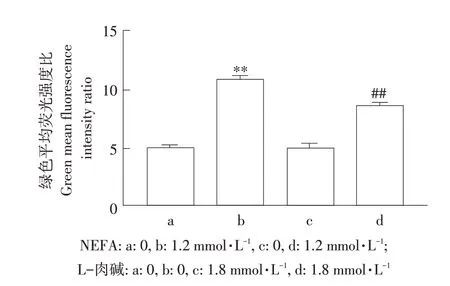
图5 定量分析L-肉碱对NEFA诱导AML12细胞ROS变化的影响Fig.5 Quantitative analysis the effect of L-carnitineon NEFA-induced ROSlevelsin AML12 cells
2.3 L-肉碱对NEFA诱导AML12细胞线粒体分布变化的影响
在证实NEFA诱导AML-12细胞氧化应激损伤基础上,本试验继续探索L-肉碱对NEFA导致AML-12细胞线粒体损伤程度的影响。如图6所示,对照组(见图6A)中细胞绿色荧光均匀分布在胞质中,NEFA组(见图6B)中集中分布于细胞膜周边,且荧光面积和强度显著降低,细胞中出现黑色空洞,表明线粒体在受到NEFA刺激后,发生线粒体聚集,甚至有些线粒体失去活性。而在L-肉碱处理组(见图6C),线粒体荧光分布与对照组相似,L-肉碱+NEFA共孵育组(见图6D)荧光强度比单独NEFA处理组荧光强度明显升高。量化分析结果显示,L-肉碱+NEFA共孵育组(见图7)对比NEFA组,线粒体异常分布率显著降低(P<0.01),表明L-肉碱对NEFA造成的线粒体分布异常有保护作用。
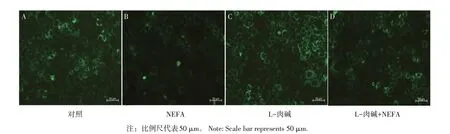
图6 L-肉碱对NEFA诱导AML12细胞线粒体分布变化的影响Fig.6 Effect of L-carnitine on NEFA-induced Mitochondrial distribution in AML 12 cells
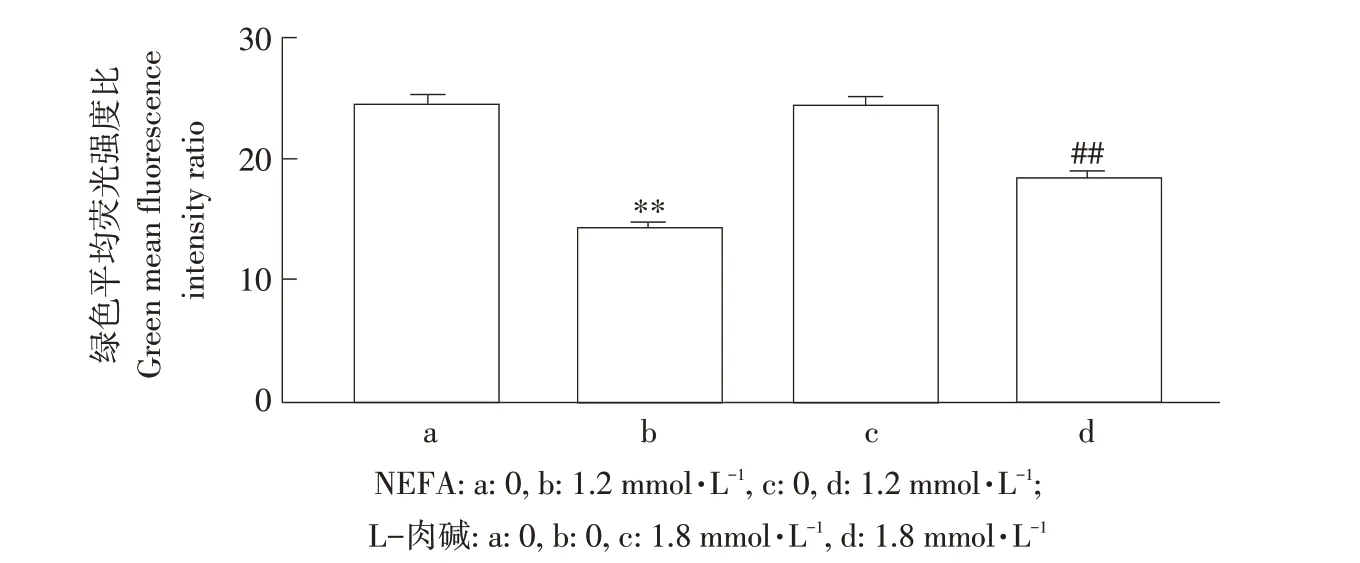
图7 定量分析L-肉碱对NEFA诱导AML12细胞线粒体分布的影响Fig.7 Quantitative analysis the effect of L-carnitine on NEFA-induced Mitochondrial distribution in AML 12 cells
2.4 L-肉碱对NEFA诱导AML12细胞线粒体膜电位变化的影响
NEFA诱导ROS产生,ROS主要产生部位为细胞线粒体,ROS大量升高引起线粒体膜电位异常,诱导细胞死亡。因此本试验检测L-肉碱对NEFA导致AML-12细胞线粒体膜电位变化。由图8可知,NEFA组(见图8B)高线粒体膜电位红色荧光较对照组(见图8A)和L-肉碱处理组(见图8C)减少,而低线粒体膜电位绿色荧光增加,表示NEFA可降低线粒体膜电位。但与NEFA组相比,经L-肉碱处理后(见图8D)细胞红色荧光明显增强,绿色荧光明显减弱,表明L-肉碱可以改善NEFA介导的线粒体膜电位降低。相对定量分析发现(见图9),NEFA组红/绿平均荧光强度比率与对照组(P<0.01)和L-肉碱处理组(P<0.01)相比均极显著降低,表明NEFA可降低细胞线粒体膜电位。而添加L-肉碱后,与NEFA单独处理组相比,红/绿平均荧光强度比率显著升高(P<0.05),表明添加L-肉碱可改善NEFA对线粒体膜电位的抑制作用。
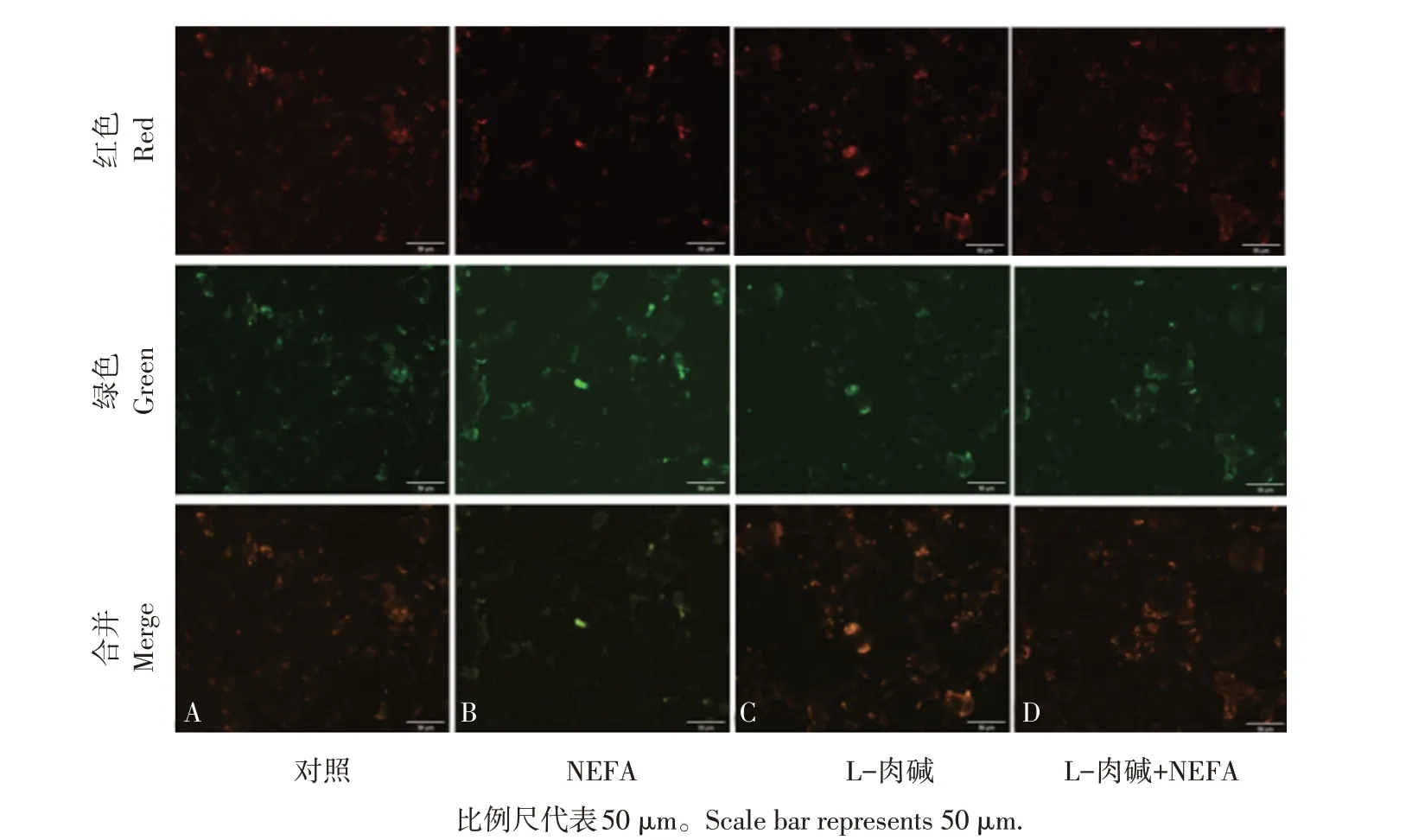
图8 L-肉碱对NEFA诱导AML12细胞线粒体膜电位变化的影响Fig.8 Effect of L-carnitineon NEFA-induced mitochondrial membranepotential changes in AML 12 cells
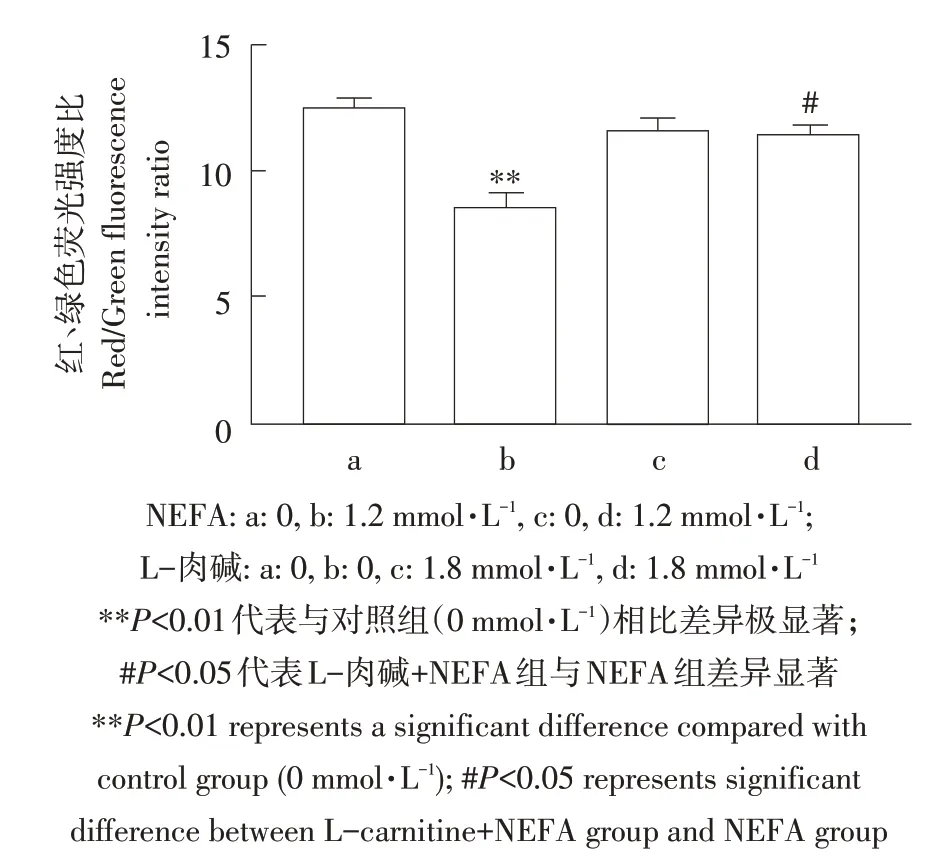
图9 定量分析L-肉碱对NEFA诱导AML12细胞线粒体膜电位变化的影响Fig.9 Quantitative analysisthe effect of L-carnitine on NEFA-induced mitochondrial membrane potential changes in AML12 cells
3 讨论
奶牛酮病主要特征性之一为NEFA显著升高,其已被作为预测酮病发生有效指标[13]。研究显示,酮病奶牛体内NEFA与SOD、GSH-Px等抗氧化酶活性呈负相关,与MDA、H2O2等氧化应激指标变化呈正相关。同时NEFA也被证实可引起奶牛肝细胞氧化应激反应[14]。因此,本试验建立起小鼠肝细胞(AML12)NEFA暴露模型,研究L-肉碱对NEFA致细胞氧化应激损伤作用。
本试验中,NEFA在1.2 mmol.L-1时可显著降低小鼠肝细胞AML12细胞活性,说明此浓度可引起显著细胞毒性。王兴慧等研究证实NEFA可通过抑制PGC-1α表达,引起肝脏脂代谢酶基因表达紊乱,导致肝细胞脂蓄积[15]。董记红等研究中,1.2 mmol.L-1NEFA造成犊牛肝细胞SOD活性显著降低,MDA水平显著上升[16]。Li等研究表明1.2和2.4 mmol.L-1NEFA组LDH释放显著增加,GSH-Px含量显著降低,细胞内ROS水平显著升高[17]。因此,本试验结合细胞毒性试验,最终选取1.2 mmol.L-1浓度进行后续试验。NEFA浓度选择不同可能与细胞种属差异有关,但从小鼠和牛肝细胞中均发现NEFA可引起细胞氧化应激损伤。
肉碱为一种广泛存在于生物体内的类维生素氨基酸衍生物,其在调节脂肪酸代谢、氧化还原反应、炎症信号传导等众多生理功能中起重要作用[18]。研究表明,L-肉碱预处理可显著提高氧化应激细胞模型T-AOC,抗氧化剂水平(T-GSH、GSH),同时提高抗氧化酶(SOD、CAT、GSH-Px)活力[19]。L-肉碱在氧化应激恢复中起重要作用[20]。本试验结果发现NEFA可上调小鼠肝细胞AML-12 MDA水平,降低抗氧化酶SOD、CAT、GSH-Px活性,而添加L-肉碱可提高SOD、CAT、GSH-Px活性以及减少MDA含量,与上述研究结果基本相似。SOD活力能一定程度反映细胞氧化应激状态和清除活性氧的能力,常与MDA检测相互参照,利用MDA含量验证细胞受活性氧侵害损伤程度,二者联合鉴定细胞氧化应激状态。添加L-肉碱后,SOD活力相对于NEFA单独处理组有明显提高,可能是L-肉碱利用其氧化还原特性直接消耗掉部分O-,亦补充L-肉碱直接或间接激活其他抗氧化酶活化途径,但仍需进一步验证。
线粒体为ROS主要产生部位。酮症奶牛NEB状态导致肝细胞中NEFA处于高代谢状态,其在线粒体氧化过程中会产生大量ROS,导致氧化应激损伤,诱导细胞凋亡[21-22]。研究表明,在奶牛肝细胞中,ROS水平和凋亡率以NEFA剂量依赖性方式增加。高浓度NEFA可产生过量ROS,导致单核细胞氧化应激,说明NEFA可通过线粒体释放大量ROS,进而破坏氧化/抗氧化平衡,造成细胞氧化应激损伤。本研究发现NEFA诱导大量ROS产生,而添加L-肉碱后,细胞中ROS荧光强度明显降低。ROS定量分析结果也显示相似结果,说明L-肉碱可显著降低NEFA诱导的细胞氧化应激水平。结合MDA含量与SOD、CAT、GSH-Px活力变化,推断出L-肉碱对NEFA诱导的细胞氧化应激损伤有一定保护作用。
线粒体内稳态对细胞正常功能至关重要[23]。氧化应激引起线粒体功能紊乱,线粒体功能障碍包括线粒体膜电位改变,线粒体数量减少以及由于细胞和组织中ROS积累而导致其氧化蛋白活性改变[24]。NEFA诱导产生的ROS可损伤线粒体功能,进一步对细胞造成损伤,最终导致肝功能异常。利用荧光探针Mito-Tracker Green标记线粒体细胞内分布,结果显示NEFA处理降低肝细胞细胞绿色荧光面积和强度,表明线粒体在受到NEFA刺激后,肝细胞线粒体发生聚集,甚至有些线粒体失去活性,而添加L-肉碱共孵育后细胞荧光强度较单独NEFA处理组明显升高,表明L-肉碱对NEFA造成的线粒体分布异常有一定程度保护作用。对线粒体膜电位检测也有类似结果,NEFA处理肝细胞后,线粒体膜电位明显降低,而添加抗氧化剂L-肉碱可稳定NEFA导致的线粒体膜电位下降。结合ROS变化和线粒体分布结果,更加确证L-肉碱对NEFA诱导的肝细胞氧化应激损伤具有保护作用,可以考虑将其作为饲料添加剂应用于奶牛酮病的预防及辅助治疗。但本试验未使用奶牛肝细胞进行验证因此存在一定局限性,后续仍需在牛肝细胞和酮病奶牛中开展相关研究。
4 结论
本试验从体外证实NEFA可诱导小鼠肝细胞线粒体损伤,引起细胞ROS释放,造成细胞SOD、CAT、GSH-Px活性下降,MDA水平显著升高,最终导致小鼠肝细胞氧化应激损伤;L-肉碱可通过稳定线粒体膜电位、改善线粒体异常分布,从而减少细胞ROS释放、提高SOD、CAT、GSH-Px活性和减少MDA含量,保护NEFA致小鼠肝细胞氧化应激损伤。

