梓醇对高糖诱导SH-SY5Y细胞凋亡的Bcl-2蛋白和 YAP蛋白的影响
韩飞飞,刘亚群,廖晶,田美娇,王一林,李宗泽
(锦州医科大学,辽宁 锦州 121000)
2010年,全世界估计有2.85亿人患有糖尿病,预计到2030年,这一数字将增加到4.39亿[1]。糖尿病脑病(diabetic encephalopathy,DE)是糖尿病的主要并发症,其主要特征是神经组织结构和化学物质组成的异常,并伴有认知功能障碍[2]。DE给患者的家庭带来了巨大的痛苦,令患者的生活质量严重下降,然而遗憾的是,时至今日,DE发病的详细机制仍不清楚。
高血糖状态下引起的机体氧化损伤导致的神经细胞凋亡被认为是糖尿病脑病发生的重要原因之一,Nan F的研究指出,甲基乙二醛是高血糖症的高反应性代谢产物,也是糖基化终产物的主要前体,可以诱导SH-SY5Y细胞的氧化应激和凋亡[3]。Dolors Puigoriol在高脂膳食诱导的糖尿病小鼠模型体内,氧化应激(oxidative stress,OS) 和活性氧(reactive oxygen species,ROS)的水平明显升高[4]。虽然大量临床研究指出,氧化应激、神经元细胞凋亡、DE间存在着相关性,但具体涉及到的信号通路仍不甚明了。
HiPPO信号通路最早在果蝇体内被发现,属于一种抑制性信号通路。机体可以通过该信号通路的核心成分对细胞的增殖、分化和凋亡进行调节[5]。Fan Yu的研究指出,在糖尿病脑病小鼠模型体内,存在Hippo信号通路的异常,改善Hippo信号通路的转导异常,可能有助于DE的治疗[6]。转录辅激活因子Yes-相关蛋白(yes-associated protein,YAP)是Hippo通路的下游效应分子,Bcl-2蛋白是Hippo信号通路的调节因子之一。Gun Woo Won的研究发现,抗凋亡蛋白Bcl-2可以通过与Hippo信号通路中的关键蛋白哺乳动物ste20-like激酶(mammalian ste20-like kinases,MST1/2)和支架蛋白Salvador-1(SAV1)的直接作用来调节Hippo信号通路所致的细胞凋亡[7]。
梓醇是我国传统中药地黄的主要成分,具有很强的抗氧化能力,Liu S的研究认为,梓醇能够有效改善链脲佐霉素(streptozocin,STZ)诱导的SH-SY5Y细胞的凋亡,是一种很好的神经保护剂[8]。I-Cheng Chen 的实验发现,梓醇在脊髓小脑的共济失调模型中具有很强的抗氧化损伤作用[9]。我们之前的研究也验证了梓醇可以明显改善高糖导致的SH-SY5Y细胞的凋亡,但是详细机制并未探讨[10]。
本研究拟采用高糖诱导SH-SY5Y细胞凋亡模拟糖尿病脑病状态下的神经元凋亡模型,选用梓醇作为保护药物,探讨其抗凋亡作用机制是否与Bcl-2蛋白和YAP蛋白有关。
1 资料与方法
1.1 一般资料
梓醇购自购自中国药品生物制品检定所(纯度≥98%);CCK-8试剂盒(美国Glpbio公司);D-无水葡萄糖、胰蛋白酶-EDT消化液、胎牛血清、AnnexinV Alexa Fluor488/PI凋亡检测试剂盒、活性氧检测试剂盒(北京索莱宝生物科技有限公司);DMEM低糖培养基(美国Themro Fisher公司)。兔抗人YAP1多克隆抗体、小鼠抗人Actin单克隆抗体、山羊抗兔IgG抗体、山羊抗鼠IgG抗体(美国Themro Fisher公司)。
1.2 方法
1.2.1 细胞培养与分组
人神经母细胞瘤SH-SY5Y细胞购自北京协和医学院基础医学院。SH-SY5Y细胞采用含有10%胎牛血清的低糖DMEM培养液,添加青霉素100 Ku/L和链霉素100 mg/L,置于恒温37 ℃、5%二氧化碳培养箱中培养。细胞分为正常对照组:用低糖DMEM培养48 h;高糖组:用含葡萄糖80 mmol/L的DMEM培养液培养48 h;梓醇保护组:用含葡萄糖80 mmol/L+梓醇0.5、1、2 mg/mL的DMEM培养液培养48 h。
1.2.2 CCK-8法检测细胞活力
取对数生长期的细胞,调整细胞密度至105个/mL接种在96孔板中,每孔100 μL,于细胞培养箱中37 ℃培养24 h。细胞贴壁后,按照1.2.1的处理方法培养细胞。培养结束后,每孔加入10 μL CCK8溶液,放入培养箱中孵育2 h。酶标仪450 nm处测量吸光度值(A值)[11]。
1.2.3 DCFH-DA探针法检测活性氧含量
按照 1∶1000 用无血清培养液稀释 DCFH-DA,使终浓度为 10 μmol/L。收集按照1.2.1的处理方法培养的各组细胞后,悬浮于稀释好的DCFH-DA中,调节细胞浓度至107个/毫升,于细胞培养箱内37 ℃孵育20 min。每隔3 min颠倒混匀一下,使探针和细胞充分接触。使用 488 nm 激发波长,525 nm 发射波长的荧光酶标仪检测各组细胞内的荧光强度[12]。
1.2.4 流式细胞术检测细胞凋亡率
按照1.2.1的处理方法培养处理各组细胞结束后,加入1 mL 4 ℃预冷的PBS重悬细胞,离心后沉淀细胞。用结合缓冲液重新悬浮细胞,调节其浓度为2×106个/毫升,取100 μL的细胞悬液于5 mL流式管中,加入5 μL Annexin V/Alexa Fluor 488混匀后于室温避光孵育5 min,加入10 μL 20 μg/mL 的碘化丙锭溶液(PI),并加400 μL PBS溶液,立刻进行流式检测[13]。
1.2.5 Western blot法检测蛋白质的含量
取对数生长期的细胞,按照2×105个/孔接种于细胞培养皿中,根据1.2.1的处理方法培养细胞。培养结束后,收集细胞,加入细胞裂解液,提取细胞总蛋白,经 10% SDS-PAGE 凝胶电泳分离,冰浴转移至硝酸纤维素膜上,5%脱脂奶粉室温封闭2 h,用YAP的一抗(1∶1000)4 ℃孵育过夜,PBST洗3次,每次10 min,分别加入对应的二抗(1∶5000)室温孵育2 h,PBST洗3次,每次10 min。内参选用Actin。采用化学发光法显影,通过凝胶成像仪采集图片,蛋白表达水平采用AlphaView SA软件分析蛋白表达情况[14]。
1.3 统计学方法
采用SPSS 23.0统计软件进行描述性分析与方差分析,实验数据采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 CCK-8法检测细胞活力
与正常对照组相比,高糖对细胞增殖有明显的抑制作用(P<0.05)。不同浓度的梓醇对高糖的抑制增殖作用有明显的改善(P<0.05),见表1。
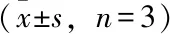
表1 梓醇对高糖作用SH-SY5Y细胞增值率的影响
2.2 DCFH-DA探针法检测活性氧含量
与正常对照组相比,高糖组ROS含量明显升高(P<0.05)。不同浓度的梓醇保护组细内ROS含量明显减少(P<0.05),并呈剂量依赖性,见表2。
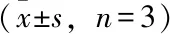
表2 梓醇对高糖作用SH-SY5Y细胞内ROS含量的影响
2.3 流式细胞术检测细胞凋亡率
与正常对照组相比,高糖组细胞的早期凋亡率明显升高(P<0.05)。与高糖组相比,梓醇保护组细胞的早期凋亡率明显降低(P<0.05),并呈剂量依赖性,见表3,图1。
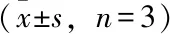
表3 梓醇对高糖作用SH-SY5Y细胞凋亡率的影响
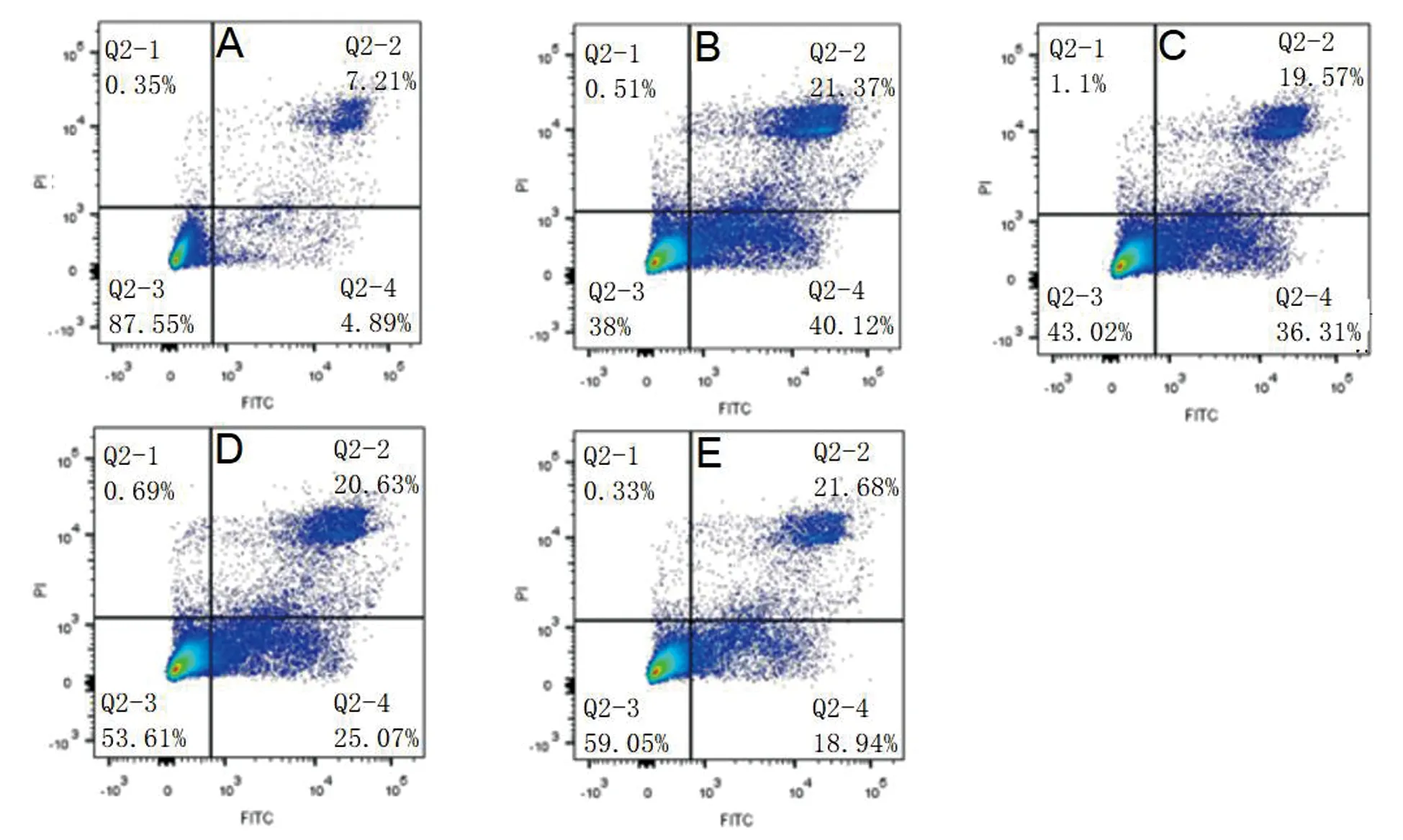
A:正常对照组;B:高糖组;C:梓醇0.5 mg/mL组;D:梓醇1 mg/mL组;E:梓醇2 mg/mL组
2.4 Western blot法检测YAP、Bcl-2蛋白质的含量
与正常对照组相比,高糖组YAP蛋白,Bcl-2蛋白含量明显下降(P<0.05),与高糖组相比,梓醇保护组细胞YAP蛋白,Bcl-2蛋白含量明显升高(P<0.05),结果见表4、图2。
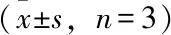
表4 Western blot法检测YAP、Bcl-2蛋白质的含量
3 讨 论
糖尿病并发症(糖尿病肾病、足溃疡、视网膜病变等)和合并症(糖尿病合并肿瘤、糖尿病合并脂肪肝等)是糖尿病患者致残、致死的首要原因。高血糖引发并发症/合并症的原因众多,如多元醇通路、蛋白激酶C、糖基化终末产物、炎症等,但究其上游均与氧化应激/活性氧自由基(ROS)的过度生成有关。Huang等人的研究指出,在糖尿病大鼠模型体内,存在丙二醛(MDA)、活性氧(ROS)的异常升高[15]。本研究发现,高糖组的细胞内ROS水平达到了(292.16±9.21)%,而细胞凋亡率则为(40.77±1.98)%,与正常组相比均明显升高(P<0.05),提示高糖状态下的SH-SY5Y细胞凋亡很可能与氧化应激损伤有关。梓醇作为传统中药地黄的主要有效成分之一具有很强的抗氧化能力,Yang等人的研究发现,梓醇可以明显改善H2O2诱导的原代皮层神经细胞的凋亡,并降低神经元细胞内的MDA和ROS水平[16]。本研究发现,低、中、高浓度梓醇保护组的ROS水平分别为(213.87±8.03)%、(188.43±8.76)%、(127.91±7.65)%,与高糖组相比均明显下降(P<0.05),并呈剂量依赖性,提示梓醇可以有效改善高糖所致的SH-SY5Y细胞的氧化损伤。而低、中、高浓度梓醇保护组的细胞存活率分别为(35.3±2.13)%、(24.57±1.16)%、(19.69±3.07)%,与高糖组相比均明显下降(P<0.05),并呈剂量依赖性,提示梓醇可以对抗高糖所致的SH-SY5Y细胞凋亡。
Hippo信号通路可以被物理、化学以及病理生理状态等多种类型的信号所调节,Peng的研究指出,高糖可以通过氨基己糖通路令Hippo通路中的关键效应分子发生糖基化的修饰从而激活其转录活性[17]。转录辅激活因子Yes-相关蛋白和带有PDZ结合基序的转录辅助激活物是Hippo通路的下游效应分子,Bcl-2蛋白是Hippo信号通路的调节因子之一。但同时,Gun Woo Won的研究发现,Bcl-2也可以通过与Hippo信号通路中的MST1/2和SAV1的直接作用来调节Hippo信号通路对抗细胞凋亡。本研究中Western blot的结果显示,在梓醇保护组中Bcl-2蛋白、YAP蛋白的表达与高糖组相比均有所提高(P<0.05),这说明梓醇可能是通过上调抗凋亡蛋白Bcl-2的含量来调节Hippo信号通路中的关键蛋白YAP的含量实现减轻高糖所致的SH-SY5Y的细胞凋亡,但是这种抗凋亡作用的详细分子机制还需要进一步的研究。

