三维有序大孔明胶调节非洛地平释放速率的研究
阿布都西库尔·托合提,黄艳莹,吴超
(锦州医科大学,辽宁 锦州 121000)
根据生物药剂学分类系统(biopharmaceutics classification system,BCS),BCS II类药物具有低溶解度和高渗透性的特点,溶出的速度和程度限制了它们的口服吸收效率。因此如何改善差水溶性药物的溶解度吸引了广泛关注。多孔材料拥有孔道有序可调、大比表面积和高孔容积的特性,这些性质非常适合作为药物载体[1-3]。纳米级的孔道能够降低药物粒子的大小进而增加药物粒子比表面积,根据Noyes-Whitney方程,溶出速率将得到增加。近来,多孔材料的研究主要集中在介孔和大孔材料,介孔材料的孔径在2~50 nm,常用的包括介孔二氧化硅、介孔碳等[4-5]。相比于介孔材料,大孔材料有更大的孔径、更高的载药量和更快的溶出速率,更适合作为难溶性药物载体材料,常用的比如三维有序大孔二氧化硅或碳等[6-7],但是无机多孔材料具有不可预知的生物安全性和不能降解等问题,在应用上受到限制,所以有机大孔材料的研究变得非常必要,目前已出现三维有序壳聚糖和三维有序大孔淀粉等[8-9],在本研究中制备三维有序大孔明胶材料用于改善难溶性药物溶解性并调控药物释放。明胶作为药剂学常用辅料,已被广泛应用,具有生物安全性和可降解性,所以三维有序大孔明胶具备作为口服药物载体的潜力。
1 材料和方法
1.1 试药
非洛地平(FLDP,武汉远成共创科技有限公司,纯度≥99%,批号:140220);甲基丙烯酸甲酯(MMA)和明胶(国药集团化学试剂有限公司);十二烷基硫酸钠,二氯甲烷,过硫酸钾,四氢呋喃,醋酸和无水乙醇购自天津永晟精细化工有限公司。其它试剂均为分析纯(市售)。
1.2 仪器
AL204 电子天平(Mettler Toledo公司); DF101S 集热式磁力搅拌器(巩义予华仪器有限责任公司);TG16-WS台式高速离心机(湘仪离心机仪器有限公司); JEOL JSM-7001F扫描电子显微镜(日本电子株式会社);差示扫描量热仪(DSC 60,Shimadzu公司);RC-806 智能溶出仪(天津市天大天发科技有限公司); UV-9100型紫外分光光度计(普析通用仪器有限公司)。
1.3 TDMG的制备
采用乳液聚合法制备聚甲基丙烯酸甲酯(PMMA)纳米球[10]。将80 mL水和3.7 mL甲基丙烯酸甲酯置于三颈瓶中,反应在氮气下80 ℃水浴中进行20 min,在600 rpm/min搅拌下,20 mL K2S2O8(4.9 mmol/L)加入上述反应体系,继续搅拌4~5 h,得到的乳状液冷却至室温,然后高速离心10 min,得到的沉淀物经干燥处理,即为PMMA纳米球。将10 g明胶溶解在100 mL水中,在80 ℃水浴搅拌下溶解,将制备的PMMA纳米球铺在垫有微孔滤膜的布氏漏斗底部并压实,然后10%的明胶水溶液在负压下倒入布氏漏斗中,多余的明胶液被抽掉,将PMMA纳米球间隙吸附的明胶溶液在4 ℃下使其凝胶,空气中干燥,得到干混合物,然后浸泡在四氢呋喃中去除PMMA模板,最后用无水乙醇洗3次,干燥得到TDMG。
1.4 载药过程
100 mg的TDMG分散于FLDP三氯甲烷溶液(100 mg/mL)中,搅拌5 h后,经离心,真空干燥,得到FLDP-TDMG。重复上述过程,实现载药量最大化,通过紫外分光光度法在237 nm处测其载药量[11]。
1.5 表征
DSC用于测定TDMG 载体载药前后FLDP的状态变化。测试在N2氛围下进行,氮气流速为 40 mL/min。升温范围是(40~300)℃,升温速率是10 ℃/min。
1.6 药物释放
依据桨法,利用RC-806溶出仪考察FLDP-TDMG的体外药物释放行为。溶出介质为500 mL水(2%十二烷基硫酸钠),温度为(37±0.5)℃,搅拌桨转速为(100±1) rpm。5 mg的FLDP原料药和相当于5 mg原料药的FLDP-TDMG载药样品投入释放介质[12-13]。分别于特定的时间点(5 min、10 min、15 min、20 min、30 min、45 min、60 min、2 h、4 h、6 h、8 h、10 h、12 h、24 h、36 h、48 h)取样5 mL,补充等体积空白介质。取0.45 μm滤膜过滤后的续滤液经紫外分光光度法在237 nm测定吸光度。计算出累积释放度。
1.7 在不同生理条件下TDMG的变化
1.7.1 降解实验
一定量TDMG样品分散在0.5%胰酶溶液中,37 ℃振摇,在1、6、12和24 h,样品经离心去除上清,用无水乙醇固化30 min,然后30 ℃真空干燥,记录重量变化,SEM观察TDMG形态变化。
1.7.2 膨胀度测定
一定量的TDMG分别被放置在3 mL去离子水中,分别于5、20、40、120、360、720和1440 min离心,获得的沉淀用吸水纸除去表面水分,称重(Wwet),然后再40 ℃干燥48 h,得到干样品,称重(Wdry),根据重量膨胀度公式(SW)=(Wwet- Wdry)/Wdry×100%计算水分增重,同时,体积膨胀也被测量,在10 mL量筒中加入一定体积蒸馏水,记录刻度,放入干燥TDMG,记录增加体积(Vdry),在5、20、40、120、360、720和1440 min,分别记录体积变化数据,通过体积膨胀度公式SV=(Vwet- Vdry)/Vdry×100%计算膨胀度。
2 结 果
2.1 TDMG的制备及表征
由SEM图1a可以看出,TDMG呈现三维有序连通的大孔结构,孔径约是100 nm。三维有序连通的大孔结构能够储存大量的药物,纳米级有序孔道能够有效限制药物粒子大小,降低药物结晶度,使药物以微晶态存在,连通的孔道结构有利于药物的释放,适合改善难溶性药物的水溶性。为了进一步验证药物在载体中的存在状态,通过乙酸的溶蚀,将TDMG框架溶解,得到药物网络结构,如图1b所示,FLDP以一种棒状的微晶分散在TDMG的三维孔道中。
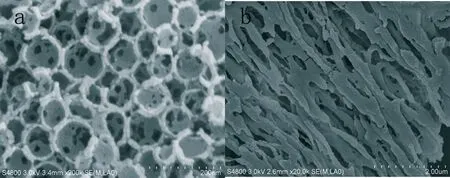
图1 TDMG(a)和FLDP网络(b)的扫描电镜图
2.2 载药量
通过溶剂挥发法将FLDP分散到TDMG的三维孔道中,结果表明,TDMG的载药量是(51.7±0.45)%,说明药物被吸附在载体三维孔道中。
2.3 差式扫描量热法(DSC)
FLDP、TDMG、FLDP和TDMG物理混合物(PM)及FLDP-TDMG被DSC表征,结果如图2,FLDP在148 ℃出现相转变吸热峰。TDMG 没有出现吸热峰,表明其为无定形态。PM和FLDP-TDMG在148 ℃出现FLDP的相转变吸收峰。这说明FLDP在PM中仍药物晶体形式存在,而FLDP-TDMG小的吸热峰说明FLDP以微晶状态存在于TDMG的孔道中,结晶度显著降低。

图2 FLDP、TDMG、PM及FLDP-TDMG的DSC 曲线图
2.4 FLDP-TDMG体外溶出实验
图3表明FLDP原料药60 min时药物仅溶出(29.9±2.77)%,而FLDP-TDMG的累积溶出度高达(54.2±4.08)%,相比于原料药,由于载体的三维网络结构的空间限制效应,在初始阶段TDMG能够改善FLDP的溶出速率,在2~24 h之后,FLDP-TDMG的药物释放量缓慢增加,呈缓释效果,并在24 h达到(94.5±2.68)%,相比之下FLDP原料药的药物释放量仅达到(36.3±4.17)%,原因是FLDP为BCSⅡ类难溶性药物,晶体形式药物溶出度低,而FLDP-TDMG的药物释放分两个阶段,在初始阶段,微晶态的药物能够通过三维有序大孔连通结构快速的溶出,随着TDMG吸水膨胀,孔道被挤压缩小,扩散阻力增加,药物通过明胶网络缓慢扩散,释放速率降低,展现缓释效果。
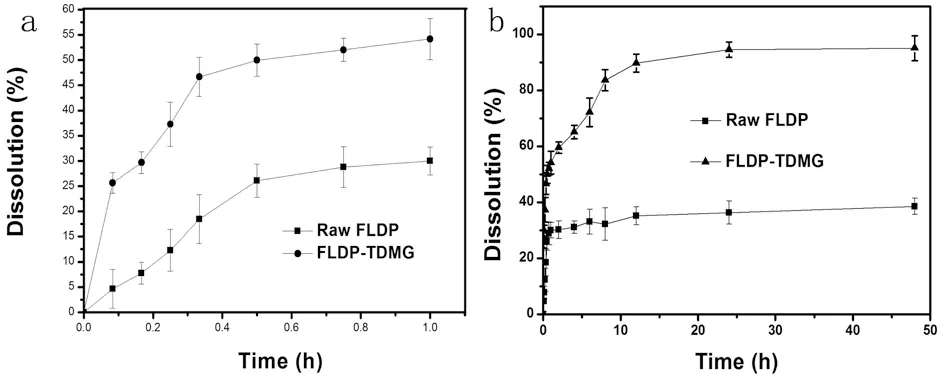
图3 FLDP、FLDP-TDMG的药物释放曲线
2.5 在不同生理条件下 TDMG 的变化
2.5.1 TDMG的生物降解性
TDMG在0.5%胰蛋白酶溶液中放置不同时间表现出不同程度的降解。浸泡1、6、12和24 h后结构变化,见图4,三维有序大孔结构随着消化时间的延长,结构逐渐被降解。图5a表示的是消化不同时间的TDMG失重曲线,1 h后TDMG失重率为(12.4±2.19)%,24 h后失重率为(54.4±5.57)%。以上结果表明,TDMG是可生物降解的,其骨架的降解有助于药物的释放。这使得TDMG与无机三维有序大孔材料相比,在作为难溶性药物载体方面更具前途。

图4 不同时间TDMG降解图片
2.5.2 膨胀度
如图5b和图5c所示,TDMG的吸水增重在12 h后大于270%,体积膨胀度大于180%,在24 h接近200%。这种极好的膨胀特性将在药物释放过程中起到一定的作用。TDMG整体结构的膨胀,导致3D多孔网络被挤压,增加了药物扩散阻力,延缓了药物的释放,但是当明胶骨架膨胀到较大程度并开始逐渐降解时,药物从明胶骨架中的扩散又变得更容易,这与药物释放规律相符。

图5 TDMG的降解重量损失曲线(a)、重量膨胀度(b)和体积膨胀度(c)
3 讨 论
FLDP属于BCSⅡ难溶性药物,水中溶解度小,但透膜性好,借助于纳米多孔材料的空间限制效应能够有效抑制药物结晶度,降低粒子大小,改善药物的水溶性,本实验设计制备的TDMG具有生物可降解性,其三维有序的大孔连通结构能够有效的储存更多药物,同时限制药物粒子尺寸,进而增加药物比表面积,改善FLDP水溶性。由于TDMG具有吸水膨胀的特性,药物的释放表现为两个阶段,在开始阶段,药物存在小的突释,5 min接近(25.6±2.07)%,然后在1 h达到(54.2±4.08)%,之后随时间延长,药物释放表现为缓释效应,这主要是因为TDMG在初始阶段3D网络未受吸水膨胀的影响,药物释放呈现较快速率,之后随着TDMG的膨胀,孔道网络收到压缩,扩散阻力增加,药物释放速率降低,表现为缓释,这样的释放行为使其非常适合作为难溶性药物的分散辅料,FLDP-TDMG作为中间体,可以制备成不同的剂型,满足不同的需求。因此TDMG具备改善难溶性药物水溶性和调控药物释放的特性,在改善难溶性药物口服生物利用度方面具备较好潜力,为丰富难溶性药物临床用药提供更多参考。

