爆发式磁刺激联合多感官刺激对意识障碍患者的促醒作用
黄绍春,田丽,张新颜,刘莉,饶江,朱慧敏
脑损伤后遗症中最严重的就是意识障碍,如昏迷、无反应觉醒综合征和微小意识状态。这些患者缺少有意识地自主活动、失去基本的日常生活活动能力,给家庭和社会带来沉重负担和巨大的压力。但目前对此尚无特效药物及康复治疗方法[1-3]。重复经颅磁刺激(rTMS)是一项非侵入性脑刺激技术,主要用于癫痫、精神疾病、脊髓损伤、脑梗死等病的辅助治疗,近年来也逐渐用于促醒,并取得一定效果[4-6]。有研究[7]表明,TMS中的爆发式磁刺激(TBS)模式对皮质具有更强更持久的刺激作用,且刺激时间明显缩短,本研究回顾性分析TBS联合多感官刺激对脑损伤所致意识障碍患者的临床疗效,以期为以后进一步临床应用及研究TBS促醒作用提供指导。
1 对象与方法
1.1 对象 选取2017年6月至2020年12月在南京脑科医院康复医学科行康复治疗的CNS损伤(脑出血、脑梗死、脑外伤)致意识障碍并行TBS治疗的患者共28例为观察组。同时选取性别、年龄、临床诊断及意识障碍程度相匹配的28例CNS损伤患者为对照组。入组标准:(1)首次急性CNS损伤,并经体格检查和影像学资料证实;(2)昏迷恢复量表(CRS-R)评为植物状态或微小意识状态;(3)年龄18~80岁;(4)病程1个月~1年;(5)无心、肺等其他器官严重损伤。排除标准:(1)重度脑积水、精神疾病;(2)发病前严重认知障碍、情绪障碍;(3)使用镇静催眠药;(4)左侧额顶部颅骨确如或存在其他修补异物。两组患者性别、疾病类型、病灶侧别比例差异均无统计学意义,具有可比性。
1.2 方法
1.2.1 治疗方法 两组均行常规药物治疗、康复训练和多感官刺激,观察组在此基础上增加TBS治疗。
1.2.1.1 药物治疗 药物治疗包括控制基础疾病、抗凝或抗血小板聚集等用药。
1.2.1.2 康复训练[8](1)多感官刺激:给予患者视觉、听觉、嗅觉、触觉等感觉刺激,训练时采用患者喜欢和熟悉的声音、图像、视频、气味、味道等素材。(2)运动功能训练:良肢位摆放、正常关节活动度的维持、体位训练等;下肢单车训练,中医传统技术,神经肌肉电刺激。(3)心功能康复:床上的主动被动关节活动、体位训练、单车训练,床边坐、床边辅助下到自主站立、日常生活活动训练;神经肌肉电刺激;肢体气压治疗。(4)呼吸功能康复:体位训练、咳嗽的诱发、气道廓清技术、床上或床边运动训练及膈肌电刺激。(5)吞咽训练:面肌及唇舌运动功能训练、口腔及面部感觉刺激、味觉刺激、气脉冲感觉刺激、K点刺激;气道保护训练;基于食物调配的直接摄食训练、进食的代偿策略训练。
1.2.1.3 经颅磁刺激治疗 采用丹麦武汉依瑞德公司生产的YRD CCY-Ⅱ型经颅磁刺激器及惰性液态冷却8字形线圈(单个线圈内径为7.5 cm),磁刺激峰值强度为3 T。将磁刺激线圈中心对准左侧额叶背外侧部位,即国际EEG学会10-20电极导联定位标准F3位置。首先在健侧初级运动皮质区寻找到运动热点,并将其为止标注在定位帽上,然后测量健侧静息运动阈值(RMT)。采用Volz等[9]研究中采用的间断TBS(iTBS)方案:刺激左侧额叶背外侧,强度为健侧RMT的30%,丛内频率50 Hz,丛内计数3,丛内刺激时间0.06 s,从间频率5 Hz,丛间计数10,刺激时间2 s,间隔时间2 s,间歇时间8 s,重复次数8 s,总时间6 min,总刺激数1 080,1次/d,每周6次。安全性要求为无头痛,无痫性发作等不良反应。
1.2.2 评定方法 患者均在治疗前和治疗结束时进行相关评定,包括GCS、昏迷恢复量表(CRS-R)、Braden压疮评分、日常生活能力量表(ADL)、经颅磁运动诱发电位(MEP)潜伏期和患侧RMT。分为:(1)GCS评分:分为睁眼、语言、运动3类。睁眼反应分为5级,语言反应分为6级和肢体运动分为6级。检查患者后计算得分总和,最高15分,最低3分。GCS评分13~14分提示轻度昏迷,9~12分提示中度昏迷,3~8分提示重度昏迷。(2)Braden评分:主要从感知能力、潮湿程度、活动能力、移动能力、营养摄取以及剪切力(和摩擦力)6个方面评估压疮风险。总分为23分,<11分为高危者,12~14分中度危险,15~17分为低危险,≥18分无危险。(3)ADL:采用改良Barthel指数,包括10项内容,分别为大小便控制、进食、修饰洗漱、洗澡、如厕、穿衣、转移、行走、上下楼梯。100分为生活自理,>60分为基本自理,60~40分生活需要协助,40~20分生活大部分依赖他人,<20分生活完全依赖。(4)CRS-R量表:总分最高23分,有视觉、听觉、运动、言语反应、交流、唤醒度6个子项目,每个分量表最高项目代表认知功能,最低项目代表反射功能。(5)患侧MEP潜伏期:在受试者患侧大脑M1区给予70%输出强度(阈上刺激)的TMS,于患侧拇短展肌记录MEP,取重复性好且波幅较大的5条波形,记录其潜伏期值,取平均值。(6)患侧RMT:测定肌肉放松状态下,刺激线圈刺激运动皮质收取引发相应靶肌产生复合动作电位,若10次中至少5次波幅(峰峰值)在50(放松状态)~200 μV,则此时的刺激强度即为RMT。
2 结 果
2.1 两组一般情况对比 对照组年龄(59.11±21.52)岁,观察组(57.00±15.68)岁;对照组病程[90(68,355)]d,观察组[86(35,338)]d;对照组治疗时间(51.44±32.67)d,观察组(48.67±26.78)d,两组差异均无统计学意义(均P﹥0.05)。
2.2 意识评分比较 见表1。(1)与治疗前相比,治疗后对照组和观察组GCS评分均明显提高(P=0.02,P=0.008),但治疗后两组组间GCS评分比较,差异无统计学意义(P﹥0.05),GCS差值(治疗后GCS-治疗前GCS)的组间比较显示,观察组差值提高更明显,差异有统计学意义(P=0.02)。(2)治疗前两组患者组间CRS-R评分比较差异无统计学意义(P=0.58),治疗前后两组组内比较,差异均有统计学意义(P=0.03,P=0.007)。治疗后观察组CRS-R评分较对照组明显提高(P=0.006)。两组治疗后CRS-R评分差值(治疗后CRS-R-治疗前CRS-R)比较,观察组CRS-R评分提高更大,差异有统计学意义(P=0.003)。
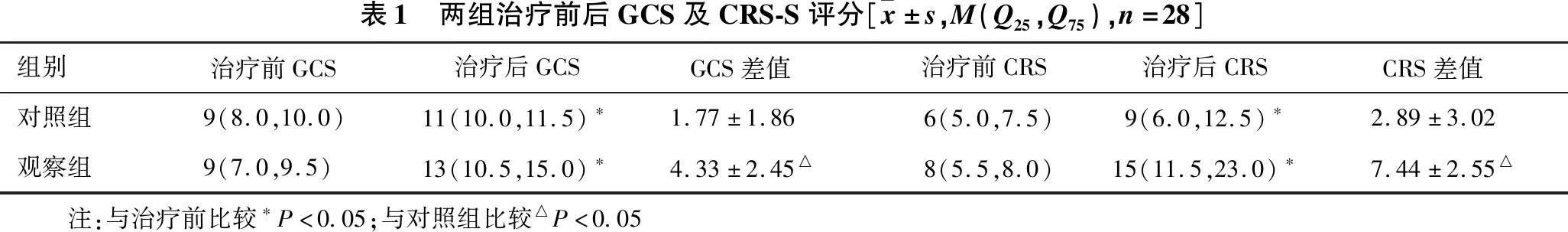
表1 两组治疗前后GCS及CRS-S评分[ x±s,M(Q25,Q75),n=28]组别治疗前GCS 治疗后GCSGCS差值 治疗前CRS治疗后CRS CRS差值 对照组9(8.0,10.0)11(10.0,11.5)∗1.77±1.86 6(5.0,7.5)9(6.0,12.5)∗2.89±3.02观察组9(7.0,9.5)13(10.5,15.0)∗4.33±2.45△ 8(5.5,8.0)15(11.5,23.0)∗7.44±2.55△ 注:与治疗前比较∗P<0.05;与对照组比较△P<0.05
2.3 并发症风险及自理能力比较 见表2。(1)治疗前后两组组间Braden评分比较差异均无统计学意义(均P﹥0.05)。治疗前后对照组组内比较Braden评分差异无统计学意义(P=0.85),观察组Braden评分明显增加,差异有统计学意义(P=0.04)。两组治疗后Braden差值(治疗后Braden-治疗前Braden)比较,差异无统计学意义(P=0.13)。(2)治疗前两组组间ADL评分比较差异无统计学意义(P=0.44)。治疗前后对照组组内比较差异无统计学意义(P=0.10),观察组ADL评分明显增加,差异有统计学意义(P=0.03)。与对照组相比,治疗后观察组ADL提高更显著,差异有统计学意义(P=0.04)。两组治疗后ADL评分差值(治疗后ADL-治疗前ADL)比较,观察组ADL值增加得更显著,差异有统计学意义(P=0.04)。
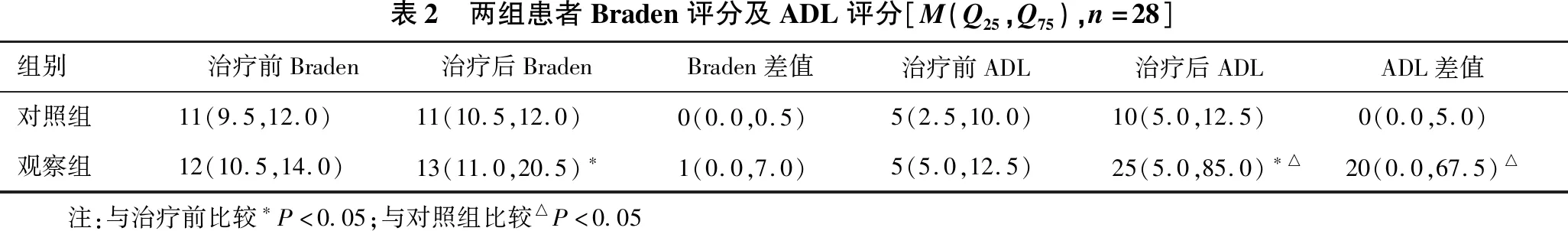
表2 两组患者Braden评分及ADL评分[M(Q25,Q75),n=28]组别治疗前Braden治疗后BradenBraden差值治疗前ADL 治疗后ADL ADL差值 对照组11(9.5,12.0)11(10.5,12.0) 0(0.0,0.5)5(2.5,10.0)10(5.0,12.5)0(0.0,5.0)观察组12(10.5,14.0)13(11.0,20.5)∗ 1(0.0,7.0)5(5.0,12.5)25(5.0,85.0)∗△20(0.0,67.5)△ 注:与治疗前比较∗P<0.05;与对照组比较△P<0.05
2.4 MEP比较 见表3。(1)治疗前后两组组间RMT值比较差异无统计学意义(P=0.52)。治疗前后对照组RMT值差异有统计学意义(P=0.03),观察组RMT值差异也有统计学意义(P=0.00)。治疗后两组患者RMT值组间比较差异有统计学意义(P=0.01)。(2)治疗前两组组间潜伏期值比较差异无统计学意义(P=0.58)。治疗前后对照组组内比较差异有统计学意义(P=0.02),观察组组内比较也有统计学意义(P=0.01),治疗后观察组潜伏期较对照组明显缩短(P=0.02)。
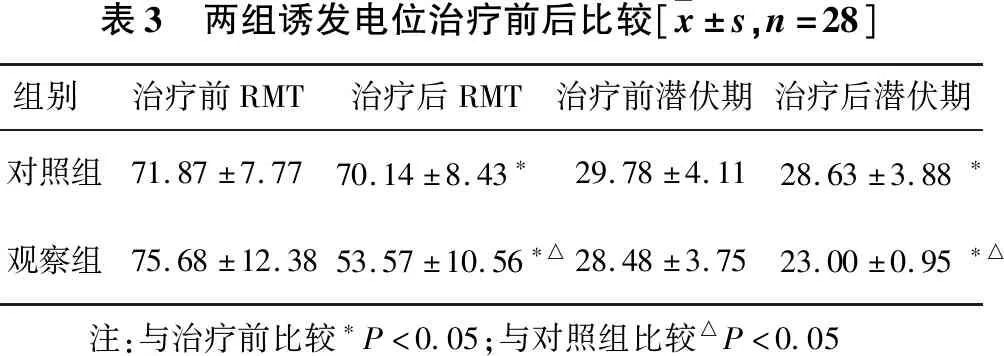
表3 两组诱发电位治疗前后比较[ x±s,n=28]组别治疗前RMT治疗后RMT治疗前潜伏期治疗后潜伏期对照组71.87±7.7770.14±8.43∗29.78±4.11 28.63±3.88∗观察组75.68±12.3853.57±10.56∗△28.48±3.7523.00±0.95∗△ 注:与治疗前比较∗P<0.05;与对照组比较△P<0.05
3 讨 论
昏迷原因有重度颅脑损伤致CNS受损;缺血、缺氧的神经细胞发生坏死、凋亡;脑组织酸碱失衡和神经电活动紊乱,传导系统兴奋性下降等。目前对意识障碍急性期以挽救生命为主,恢复期以促醒、认知功能改善为目标,治疗包括药物、高压氧、深部脑刺激、神经刺激及基因治疗等,但疗效均不理想[1,10]。
作为一种典型的非侵入性脑刺激方法,TMS在意识障碍方面的促醒作用已经受到越来越广泛的关注。有研究[11-13]尝试使用TMS治疗意识障碍并取得一些可喜的成果。然而Liu等[14]在一项非随机对照的研究中纳入7例意识障碍患者及11名健康者予20 Hz高频刺激左侧初级运动区,最后并未发现此刺激方案有明确的效果,仅静息态功能MRI提示部分脑区功能连接增强。另外Cincotta等[15]一项随机假对照研究表明20 Hz刺激植物状态患者初级运动区未取得任何指标改变。总结以上研究发现TMS刺激方案不统一,甚至到目前为止关于TMS治疗意识障碍仍没有明确统一的标准和方案。
TBS是TMS中的一种爆发式刺激模式,它刺激时间短、耐受性好。有学者[16]对8例意识障碍患者行TBS治疗,连续治疗5 d后患者意识状态明显改善,随访一周后复评意识状态,发现与治疗后即刻相比,随访时CRS-R量表总分及各子项分值变化不大,提示TBS有一定的促醒作用。郭霜等[17]研究显示20 Hz高频rTMS的促醒作用较10 Hz的强,但也有增加不良反应的风险。本研究显示所有患者治疗后意识状态等指标均有提高,特别是50 Hz的iTBS刺激左侧额叶背外侧后患者GCS和CRS-R评分提高更明显,表明对意识障碍患者意识恢复有明显的促进作用,TBS组取得更显著的效果,且无明显不良反应,与Wu等[16]的研究结果相似。进一步研究发现,所有患者诱发电位潜伏期和RMT均下降,表明神经兴奋性增高,神经功能进行重塑,而且经TBS治疗后诱发电位潜伏期和RMT下降得更明显,表明TBS有进一步促进脑功能重塑的功能。所有患者的ADL能力及Braden评分均明显提高,表明随着意识状态的改善,患者感觉、移动、活动及实际交流能力均有提高,对于并发症的预防及个人自理能力提高有重要意义。
本研究用量表评定意识状态、诱发电位评定皮质兴奋性以及传导通路的完整性,同时评定患者整体意识、行为改变,又进一步评定临床重点关注的并发症及自理能力,因此更加全面和客观。但本研究中治疗后GCS评分组间比较未见显著差异,进一步比较两组患者治疗前后GCS差值,发现TBS治疗后增加幅度更大。可能因为GCS评分主要用于评价颅脑损伤急性期的患者,与预后有一定的相关性,但在判断恢复期的特殊意识障碍时敏感度、特异性下降,而本研究中患者都处于恢复期,结果也表明仅CRS-R评分有明显提高,故CRS-R评分更加准确适用。本研究提示观察组治疗后褥疮风险降低,可能与患者意识状态改善,运动功能、感知觉、言语认知功能改善等综合因素有关,而且这些功能改善又导致自理能力的提高,减少对他人的生活依赖,这也是康复的最终目标。
本研究显示,TBS具有良好促醒作用,可能机制是扩张脑血管,改善病灶及其邻近区域的血液循环;调节大脑局部的皮质兴奋性,影响脑电活动及突触重塑;激活休眠的神经细胞,修复或重建神经网络;除了局部作用外,磁刺激还能通过神经环路产生远隔效应,激活网状结构激活系统,促进意识恢复[18]。其次,左侧DLPFC区域来自顶叶皮质的视觉、运动、空间结构和触觉的感觉输入,并投射到皮质下、单胺能和胆碱能神经元,同时还与工作记忆、执行功能、情绪、言语功能有密切联系。研究[19]显示,高频刺激左侧DLPFC能改善意识状态。本研究中观察组还给予了多感官的刺激,可以让患者处于丰富环境中,通过声音、光、影像、深浅感觉等刺激方式促进意识、运动、言语能、吞咽能、认知等脑功能网络的重塑,促进意识障碍的整体功能的改善。TBS是一种新型的rTMS形式,根据刺激发放形式的不同产生两种效应,连续性爆发式刺激具有抑制效应,而iTBS具有兴奋效应。与传统的rTMS相比,这一模式化的新型刺激方案治疗可通过短时间、低强度刺激可以产生更持久的皮质兴奋或抑制性刺激作用,同时也能够避免线圈过热现象[20],刺激模式更加接近人脑自然电生理活动,节律性爆发式动作电位的发放是大脑神经对各种信息进行编码的正常活动。
目前研究[21]发现,TMS-MEP源于皮质锥体细胞发放的下行冲动,能反映大脑皮质兴奋性及中枢到外周传导性变化情况,可用以评估患者神经功能,如运动诱发电位潜伏期的延长或波的缺失均提示患者神经功能及预后较差。本研究也发现两组患者治疗前RMT明显升高或缺失以及潜伏期明显延长甚至缺失,治疗后RMT明显下降,潜伏期明显缩短,同时TBS治疗后效果更显著,表明康复促醒尤其TBS治疗后患者皮质兴奋性升高,以及反复促通后神经传导通路重新开放或通过重塑形成新的传导通路,进一步证实脑重塑理论。
TBS可改善意识障碍患者受损脑组织循环及电活动,可提高常规康复训练的促醒效果,降低并发症风险,提高患者自理能力,降低对照料者的依赖程度。本研究属回顾性分析,需大样本前瞻性随机对照研究及多模态MRI以进一步探讨其促醒疗效及机制。

