mTOR在动脉粥样硬化中的研究进展
蔡梦阳,张媛媛,夏 晴,张邢炜
(1.杭州师范大学附属医院 心内科,浙江 杭州 310015;2.浙江大学医学院附属第一医院 心超中心,浙江 杭州 310003;3.杭州师范大学附属医院 转化医学平台,浙江 杭州 310015)
动脉粥样硬化(atherosclerosis,AS)是一种由多种因素引起的复杂病变,包括脂质沉积、炎症和泡沫细胞形成等。随着人口老龄化,AS及相关心血管疾病的发病人数持续增加[1]。巨噬细胞在内皮下的积聚被认为是AS形成的第一步,随着时间的推移,粥样硬化斑块纤维化加剧并引起钙质沉积,最终可侵犯管腔,导致缺血性疾病的发生[2]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种存在于哺乳动物体内的丝氨酸/苏氨酸蛋白激酶。mTOR在细胞增殖、存活、代谢、自噬、凋亡、迁移等生物学过程中均有重要作用。多项证据[3-4]表明,mTOR激活可引发内皮功能障碍、泡沫细胞形成和血管平滑肌细胞增殖等机制进而促进AS的发生和发展。本文综述mTOR在AS发生发展中的作用,开发mTOR抑制剂治疗AS的原理和遇到的挑战。
1 mTOR的特点
哺乳动物mTOR的靶点根据其主要功能分为mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2),分别与特定的衔接蛋白相互作用[5]。mTOR的结构域包括N端的HEAT 结构域、FAT结构域、FRB结构域、激酶结构域、抑制性结构域和FATC结构域(图1A)。mTORC1由mTOR、Raptor、mlST8和两个负调控结构PRAS40、Deptor组成,通过促进翻译、核糖体生物合成和自噬调节细胞生长。mTORC2则由mTOR、Protor、Rictor、Deptor、mSlN1 和mlST8组成(图1B),通过上调蛋白激酶B(protein kinase B, Akt)活性发挥内皮修复功能,同时控制细胞骨架蛋白的功能。因此,两种mTOR复合物(mTORC1和mTORC2)的激活可调节多种病理生理过程[6]。
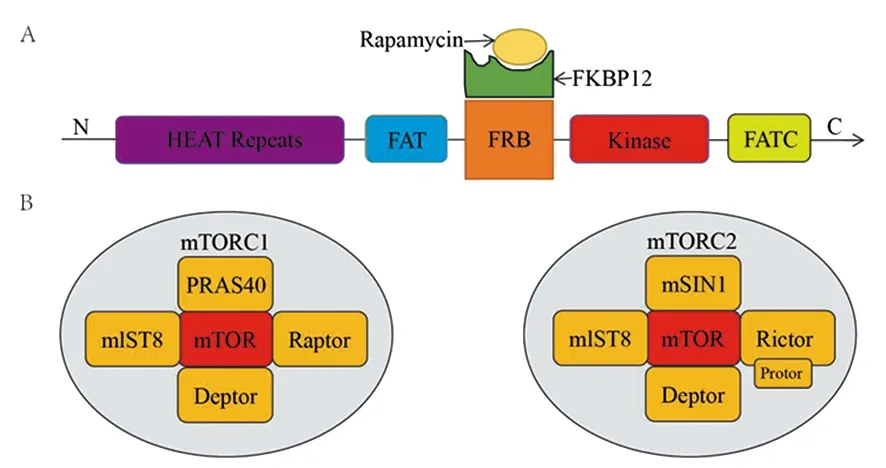
A:mTOR的结构域 ;B:mTOR复合物。图1 mTOR的结构示意图[5]Figure 1 Structure of mTOR [5]
2 mTOR在AS形成初期的作用
AS初期通常是指动脉内皮功能紊乱和泡沫细胞形成的时期,泡沫细胞是由巨噬细胞吞噬大量的脂质颗粒发展而来(图2)。研究[7]表明,mTOR在粒细胞-单核细胞祖细胞早期分化为单核细胞/巨噬细胞的过程中起着重要作用,其通过抑制信号转导和转录活化蛋白5(signal transduction and activator of transcription 5, STAT5)的活性并增加干扰素调节因子8(interferon regulatory factor 8, IRF8)和人蛋白酪氨酸激酶(CD115)表达来控制祖细胞进入单核细胞/巨噬细胞的发育过程。巨噬细胞表面的清道夫受体(scavenger receptor, SR)摄取氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)导致脂质积聚,进而完成巨噬细胞到泡沫细胞的转化,这被认为是AS发生的第一步。Yu等[8]研究发现,在转化为泡沫细胞的过程中,巨噬细胞中Toll样受体4(TLR4)的mRNA和蛋白水平上调,而这种上调是通过激活mTOR信号通路来介导的。抑制mTOR活性可降低TLR4表达并改善THP-1巨噬细胞胆固醇外流[8]。同时,脂多糖(lipopolysaccharide, LPS)诱导THP-1巨噬细胞可显著上调TLR4介导的炎症途径,从而激活mTORC2介导的Akt磷酸化,并上调mTORC1依赖的SR的表达,加剧脂质在THP-1巨噬细胞中积累,促进泡沫细胞的形成[9]。Zheng等[10]的研究发现,mTOR信号与沉默信息调节因子1(silent information regulator 1, SIRT1)信号转导之间存在紧密联系,其可通过抑制SIRT 1信号途径,促进泡沫细胞的形成,从而促进AS的形成。低密度脂蛋白受体(low density lipoprotein receptor, LDLR)在AS中扮演重要的角色,增加mTORC1活性可破坏LDLR的表达,导致血脂异常,从而促进AS的发生和发展[11]。

图2 mTOR在AS形成初期的作用(mTOR激活参与内皮功能紊乱和泡沫细胞的形成)[15]Figure 2 Role of mTOR in the initial stage of AS (activated mTOR activation involved in endothelial dysfunction and foam cell formation) [15]
正常的内皮功能是维持血管健康,抑制血栓形成、炎症和平滑肌细胞增殖所必需的。研究表明[12-13],抑制PI3K-Akt-mTOR途径介导的自噬作用可改善高糖/高脂应激诱导的内皮细胞功能障碍。临床上,药物涂层支架中的mTOR抑制剂对内皮功能具有良好的改善作用并可显著减少内膜增生[14]。Shi等[13]的研究表明,H2O2可导致氧化应激增加,激活Akt/mTOR信号通路,诱导血管内皮细胞功能障碍。
3 mTOR在AS病变早期的作用
脂质条纹的形成以及血管平滑肌细胞(vascular smooth muscle cells,VSMC)的迁移和增殖是AS早期病变的主要病理特征[16](图3)。Wang等[17]的研究发现,用小干扰RNA(small interfering RNA, siRNA)抑制mTOR的表达,可显著抑制泡沫细胞的形成,同时伴有脂质沉积的减少。此外,阻断mTOR的表达可明显促进泡沫细胞的胆固醇外向转运[16]。因此,笔者猜测mTOR通过抑制自噬途径促进泡沫细胞的形成与积累,进而形成脂质条纹。

图3 mTOR在AS病变早期的作用(mTOR激活促进脂肪条纹的形成和VSMC的迁移和增殖)[15]Figure 3 Role of mTOR in the early stage of AS (activated mTOR promoted the formation of fat stripes and the migration and proliferation of VSMC) [15]
VSMC是动脉中膜层的主要细胞,是维持动脉壁完整性的关键细胞,参与动脉壁重塑,并在AS的各个阶段发挥重要作用[18]。越来越多的证据表明,激活Akt/mTOR途径可促进VSMC的增殖和迁移,从而促进AS的发展[19]。长期的mTORC1过度表达会减少动脉管壁弹性纤维完整性和相关弹性能量存储损失从而引发动脉重塑[20]。既往研究[21-22]表明,腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)的激活抑制mTOR下游核糖体S6蛋白激酶(P70S6K)因子的磷酸化,从而抑制VSMC的增殖。Lu等[23]的研究结果发现,抑制ROS/NFκB/mTOR/p70S6K信号通路,可抑制人血小板衍化生长因子-BB(PDGF-BB)诱导的VSMCs增殖、迁移,同时抑制血管新生内膜形成。
4 mTOR在AS病变中晚期的作用
AS晚期特征性病变常表现为VSMC凋亡、斑块坏死、易损斑块形成、纤维帽断裂、管腔狭窄和血栓形成(图4)[16]。研究[15]表明,mTOR信号通路的激活可促进AS晚期的特征性病变。Wang等[24]发现,在载脂蛋白E(ApoE)敲除小鼠中应用二甲双胍可通过抑制PI3K/Akt/mTOR通路激活,从而减少VSMC凋亡。晚期AS中巨噬细胞的死亡促进斑块的坏死和不稳定,而mTOR激活可促进巨噬细胞凋亡[25]。大量研究表明,mTOR在调节自噬中起着重要作用[26],抑制mTOR在稳定动脉粥样斑块方面有着有益作用。研究[27]表明,敲除mTOR基因可改善血脂代谢紊乱,稳定AS斑块,减少斑块面积,增加纤维帽厚度和帽核比。AS斑块破裂常合并炎症活动暴发,巨噬细胞分泌的炎症因子包括MMP-2、MCP-1和TF,被认为是导致AS斑块不稳定和破裂的临床指标[28]。抑制mTOR的表达可下调基质金属蛋白酶2(MMP2)、单核细胞趋化蛋白-1(MCP-1)和组织因子(TF)基因的表达,从而减少炎症活动,有利于斑块的稳定[27]。RapaLink-1是第三代mTOR抑制剂,可有效减小动脉血栓斑块,抑制AS的起始和进展,同时减少巨噬细胞的浸润程度并上调自噬过程[29]。近期有研究发现PI3K/Akt/mTOR信号通路的激活可减少血小板的自噬,从而抑制血小板的活化,减缓血栓形成,这与既往的研究不符[30]。
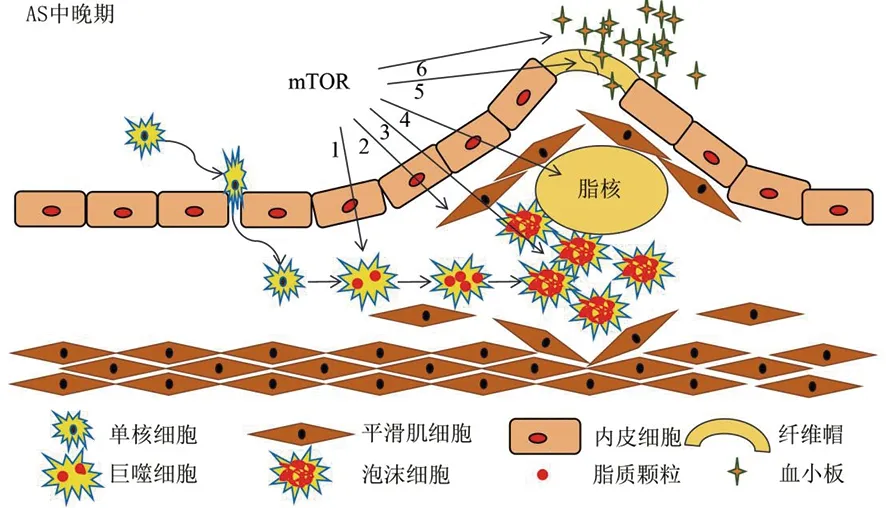
图4 mTOR在AS病变中晚期的作用(mTOR激活可促进VSMC凋亡、斑块坏死、易损斑块形成、纤维帽断裂、血小板的聚集和黏附)[15]Figure 4 Role of mTOR in the advanced stage of AS(activated mTOR promoted VSMC apoptosis, plaque necrosis, vulnerable plaque formation, fiber cap rupture, platelet aggregation and adhesion) [15]
5 mTOR抑制剂的应用及前景
首个应用于临床的mTOR抑制剂是一种天然的抗生素雷帕霉素,其并不直接抑制mTOR活性,而是通过与mTORC1的结构域形成复合物,发挥变构抑制剂的作用[6]。同时,雷帕霉素可导致Raptor与mTORC1分离,使磷酸化核糖体S6K蛋白激酶(S6K)和4E结合蛋白(4EBP)过程受阻,抑制相关蛋白的表达,诱导细胞凋亡[31]。目前临床上雷帕霉素衍生物主要有temsirolimus、everolimus 和 deforolimus[32]。研究表明,雷帕霉素及其衍生物仅可特异性抑制mTORC1,对mTORC2无显著影响。然而,长期使用雷帕霉素可能诱发一种糖尿病样综合征(严重的胰岛素抵抗、葡萄糖不耐受和血脂异常),从而限制其临床应用[33]。第二代mTOR抑制剂主要由mTOR/PI3K双重抑制剂和三磷酸腺苷(ATP)竞争性抑制剂组成,可以同时有效抑制mTORC1和mTORC2靶点[32]。然而,第二代mTOR抑制剂极易产生耐药性,因此限制了其临床应用。RapaLink-1是第三代mTOR抑制剂,与雷帕霉素相比疗效显著,尚未发现会产生耐药性,具有良好的应用前景[34]。
目前临床上mTOR抑制剂已被成功应用于治疗肿瘤相关性疾病,在心血管疾病领域,mTOR抑制剂主要被应用于冠状动脉血管装置以避免新生内膜生长。mTOR抑制剂不仅可以影响正在增殖的VSMC,同时可以影响内皮细胞,从而导致包括内皮化在内的血管延迟愈合[35]。因此,应用mTOR抑制剂治疗AS拥有广阔的前景。
6 结语
综上所述,mTOR 在AS形成过程中起着重要作用。在AS病变初期,激活mTOR可引起动脉管壁内皮功能障碍和泡沫细胞形成;在AS病变早期,mTOR激活可加速VSMC的增殖和脂肪条纹的形成;在AS病变中晚期,mTOR激活可导致血管内膜缺损、VSMC凋亡、纤维帽破裂、血栓形成等特征性病变。此外,mTOR的活性受多种上下游因子的调节,均对AS有一定影响。因此,抑制mTOR信号通路可作为治疗AS的潜在靶点,优化原有药物、研制新型药物、调控mTOR的表达,将成为临床防治AS的研究重点。

